- 244.00 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
分子结构与性质
时间:45分钟
1.(2019·烟台模拟)请回答下列问题:
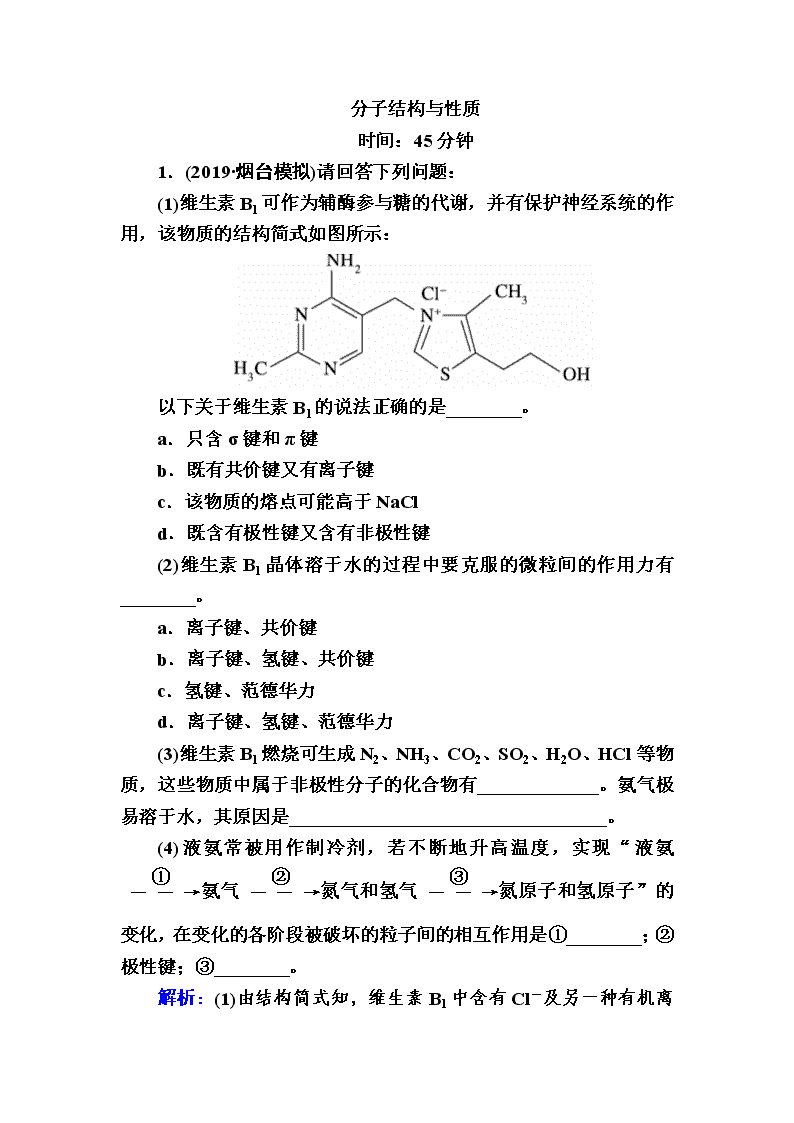
(1)维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用,该物质的结构简式如图所示:
以下关于维生素B1的说法正确的是________。
a.只含σ键和π键
b.既有共价键又有离子键
c.该物质的熔点可能高于NaCl
d.既含有极性键又含有非极性键
(2)维生素B1晶体溶于水的过程中要克服的微粒间的作用力有________。
a.离子键、共价键
b.离子键、氢键、共价键
c.氢键、范德华力
d.离子键、氢键、范德华力
(3)维生素B1燃烧可生成N2、NH3、CO2、SO2、H2O、HCl等物质,这些物质中属于非极性分子的化合物有_____________。氨气极易溶于水,其原因是__________________________________。
(4)液氨常被用作制冷剂,若不断地升高温度,实现“液氨氨气氮气和氢气氮原子和氢原子”的变化,在变化的各阶段被破坏的粒子间的相互作用是①________;②极性键;③________。
解析:(1)由结构简式知,维生素B1中含有Cl-
及另一种有机离子,存在离子键,其他原子之间形成共价键,故a错误、b正确;与氯化钠晶体相比,维生素B1中的阳离子比Na+半径大,晶格能小,熔点不可能高于NaCl,故c错误;维生素B1中碳碳键为非极性键,氮氢键、氧氢键、碳氢键等为极性键,故d正确。
(2)晶体溶于水的过程会电离出Cl-等,故需要克服离子键,维生素B1分子间存在氢键、范德华力,故d正确。
(3)N2为单质,另外五种化合物中属于非极性分子的是CO2。NH3极易溶于水,是因为NH3和水均为极性分子,NH3溶于水后,NH3与水之间可形成氢键,NH3可与水反应。
(4)液氨汽化破坏了分子间作用力,包括氢键和范德华力;氨气分解生成N2和H2,破坏了氮氢极性键;N2、H2生成氮原子和氢原子,破坏了非极性键。
答案:(1)bd (2)d (3)CO2 氨气分子为极性分子,易溶于极性溶剂水中,氨气分子与水分子间易形成氢键,氨气可与水反应 (4)氢键、范德华力 非极性键
2.(2019·辽宁葫芦岛一模)磷及其化合物是生活生产中重要的组成部分,请回答下列问题:
(1)与磷同主族、比磷多一个周期的元素基态原子的价电子排布式为____________。
(2)磷与同周期相邻的两种元素的第一电离能由大到小的顺序为____________(用元素符号表示)。
(3)亚磷酸(H3PO3)是一种常见的无机酸,其与过量的NaOH溶液反应生成Na2HPO3,请画出亚磷酸的分子结构:________。Cu2+被亚磷酸还原为单质,得到的电子填充到________轨道。
(4)已知PBr5晶体中存在PBr和Br-两种离子,则PBr中心P原子杂化类型为________,该离子的几何构型为________。而PCl5晶体中存在PCl和另一种阴离子,该阴离子配位数为6,请写出该离子的化学式:________________________。PBr5晶体中不能形成与PCl5
晶体一样的阴离子的原因可能是_________________________。
(5)铝和白磷在一定条件下可以制备磷化铝(AlP),磷化铝晶胞的结构如图,可以将其看作Si晶体的“广义等电子体”,可作半导体材料。
①根据“广义等电子原理”,下列物质中,可能是半导体的有________(填序号)。
A.SiC B.CaO2 C.GaAs D.Si3N4 E.BN
②磷化铝中,Al原子的配位数为________,若该晶胞密度为d g/cm3,用NA表示阿伏加德罗常数,则该晶体的边长为________ cm。
解析:(1)与磷同主族、位于磷下一个周期的元素是33号元素As,As最外层有5个电子,基态原子的价电子排布式为4s24p3。(2)同周期元素从左到右第一电离能呈增大趋势,第VA族元素p轨道为半充满稳定结构,第一电离能大于同周期第ⅥA族元素,所以磷与同周期相邻的两种元素的第一电离能由大到小的顺序为P>S>Si。(3)亚磷酸(H3PO3)与过量的NaOH溶液反应生成Na2HPO3,所以H3PO3是二元酸,结构式是;Cu2+的电子排布式是
1s22s22p63s23p63d9,Cu的电子排布式是1s22s22p63s23p63d104s1,所以Cu2+被还原时得到的电子填充到3d、4s轨道。(4)PBr中P原子的价层电子对数是4+=4,所以P原子杂化类型为sp3,没有孤对电子,所以该离子的几何构型为正四面体形;PCl5
中磷元素化合价为+5,另一种阴离子配位数为6,带1个单位负电荷,该离子的化学式为PCl;Br原子半径大,P原子周围无法容纳6个Br原子,不稳定,所以PBr5晶体中不能形成与PCl5晶体一样的阴离子。(5)①AlP原子数为2,价电子总数为8;SiC、GaAs、BN与AlP互为等电子体,化学性质相似,可能是半导体,ACE符合题意;②根据晶胞示意图,可知Al原子的配位数为4;②根据均摊法计算,每个晶胞含有Al原子数为8×+6×=4,含有P原子数为4,所以晶胞的质量是 g,设晶胞边长是a cm,则晶胞体积为a3 cm3,d g·cm-3=,则a=。
答案:(1)4s24p3 (2)P>S>Si (3) 3d、4s
(4)sp3杂化 正四面体形 PCl Br原子半径大,P原子周围无法容纳6个Br原子,不稳定
(5)①ACE ②4
3.(2019·山西太原模拟)(1)氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,该配合物结构如图所示。
①此配合物中,基态铁离子的价电子排布式为________。
②此配合物中碳原子的杂化轨道类型有________。
③此配合物中含有的化学键有________(填字母)。
A.离子键 B.金属键
C.极性键 D.非极性键
E.配位键 F.氢键
G.σ键 H.π键
(2)基态A原子的价电子排布式为3s23p5,铜与A形成化合物的晶胞如图所示(黑球代表铜原子)。
①该化合物的化学式为________________________,A原子的配位数是________。
②该化合物难溶于水,但易溶于氨水,其原因可能是
_____________________;与NH3互为等电子体的分子有________(写化学式,一种即可)。NH3的键角大于H2O的键角的主要原因是______________________________________________。
③已知该化合物晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则该晶体中Cu原子和A原子之间的最短距离为________pm(列出计算表达式即可)。
解析:(1)①铁离子3d能级上有5个电子,4s能级上没有电子,所以其价电子排布式为3d5。③
同种非金属元素之间存在非极性键,不同非金属元素之间存在极性键,含有孤电子对和空轨道的原子之间存在配位键,共价单键为σ键,共价双键中含有一个σ键和一个π键,所以该配合物中含有配位键、极性键、非极性键、氢键、σ键和π键,但氢键不是化学键。(2)根据价电子排布式判断出A原子为氯原子。①由晶胞结构可知,Cu原子处于晶胞内部,晶胞中含有4个Cu原子,Cl原子在顶点与面心上,晶胞中含有Cl原子数目为8×+6×=4,故化学式为CuCl,根据图示,铜原子周围有4个氯原子距离相等,且最小,即铜原子的配位数为4,则氯原子的配位数也是4。③晶胞的质量为 g,晶胞的体积为 cm3,则晶胞的边长为 cm,根据晶胞的结构可知,铜原子和氯原子之间的最短距离为立方体体对角线的,而体对角线为晶胞边长的倍,所以铜原子和氯原子之间的最短距离为× cm=× ×1010 pm。
答案:(1)①3d5 ②sp2、sp3 ③CDEGH
(2)①CuCl 4 ②Cu+可与氨形成易溶水的配位化合物 PH3(合理即可) NH3、H2O分子中N、O原子的孤电子对数分别是1、2,孤电子对数越多,对成键电子对的排斥力越强,键角越小
③× ×1010
4.(2019·山东潍坊模拟)C、P、Cl、Fe等元素及其化合物有重要的应用,回答下列问题:
(1)C原子的价电子排布图为________________。
(2)CCl4分子的立体构型是________________,其中心原子采取________杂化,与CCl4互为等电子体的一种离子是________(填离子符号)。
(3)PCl3属于____________分子(填“极性”或“非极性”)。
(4)FeO、NiO的晶体结构均与NaCl晶体结构相同,其中Fe2+
与Ni2+的离子半径分别为7.8×10-2 nm、6.9×10-2 nm,则熔点FeO________NiO(填“>”“<”或“=”),原因是
____________________________________________________。
(5)已知FeCl3的沸点为319 ℃,熔点为306 ℃,则FeCl3的晶体类型为____________________。
(6)已知Fe单质有如图所示的两种常见堆积方式:
a b
其中属于体心立方密堆积的是________(填“a”或“b”);若单质Fe按a方式紧密堆积,原子半径为r pm,NA表示阿伏加德罗常数的值,则单质Fe的密度为________________ g·cm-3(列出计算式即可)。
解析:(1)C的原子序数为6,最外层电子数为4,原子的价电子排布图为。
(2)CCl4分子中C原子价层电子对数=4+=4,所以采取sp3杂化;立体构型为正四面体;与CCl4互为等电子体的离子有SO、PO等。
(3)PCl3分子中含有的共价键是极性共价键,P原子上有孤电子对,分子立体构型为三角锥形,其结构不对称,属于极性分子。
(4)FeO、NiO的晶体结构相同,Fe2+、Ni2+所带电荷相同,但Fe2+的离子半径大于Ni2+的离子半径,则FeO的晶格能小于NiO的晶格能,因此熔点FeO