- 2.03 MB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1
选修 3 知识点总结
第一章 原子结构与性质
一.原子结构
1.能级与能层
2.原子轨道
3.原子核外电子排布规律
⑴构造原理:随着核电荷数递增,大多数元素的电中性基 态原子的电子按右图顺序填
入核外电子运动轨道(能级) ,叫做构造原理。
记忆方法有哪些?
2
能级交错:由构造原理可知,电子先进入 4s 轨道,后进入 3d 轨道,这种现象叫能级交
错。
说明: 构造原理并不是说 4s 能级比 3d 能级能量低 (实际上 4s 能级比 3d 能级能量高) ,
而是指这样顺序填充电子可以使整个原子的能量最低。 也就是说,整个原子的能量不能机
械地看做是各电子所处轨道的能量之和。
(2)能量最低原理
现代物质结构理论证实, 原子的电子排布遵循构造原理能使整个原子的能量处于最低状
态,简称能量最 低原理。
构造原理和能量最低原理是从整体角度考虑原子的能量高低,而不局限于某个能级。
(3)泡利(不相容)原理:基态多电子原子中,一个轨道里最多只能容纳两个电子,
且电旋方向相反(用“↑↓”表示) ,这个原理称为泡利( Pauli)原理。
(4)洪特规则:当电子排布在同一能级的不同轨道(能量相同)时,总是优先单独占
据一个轨道,而且自旋方向相同,这个规则叫洪特( Hund)规则。比如, p3 的轨道式为
或 ,而不是 。
洪特规则特例:当 p、d、f 轨道填充的电子数为全空、半充满或全充满时,原子处于较
稳定的状态。即 p0、d0、f0、p3、d5、f 7、p6、d10、f14 时,是较稳定状态。
前 36 号元素中,全空状态的有 4Be 2s22p0、12Mg 3s23p0、20Ca 4s23d 0;半充满状态的有:
7N 2s22p3、 15P 3s23p3、 24Cr 3d54s1、 25Mn 3d 54s2、 33As 4s24p3;全充满状态的有 10Ne 2s22p6、
18Ar 3s23p6、 29Cu 3d104s1、 30Zn 3d104s2、 36Kr 4s24p 6。
4. 基态原子核外电子排布的表示方法
(1)电子排布式
①用数字在能级符号的右上角表明该能级上排布的电子数, 这就是电子排布式, 例如 K:
1s22s22p63s23p64s1。
②为了避免电子排布式书写过于繁琐, 把内层电子达到稀有气体元素原子结构的部分以
相应稀有气体的元素符号外加方括号表示,例如 K:[Ar]4s 1。
③外围电子排布式(价电子排布式)
(2)电子排布图 (轨道表示式 )是指将过渡元素原子的电子排布式中符合上一周期稀有气
体的原子的电子排布式的部分(原子实)或主族元素、 0 族元素的内层电子排布省略后剩下
的式子。
每个方框或圆圈代表一个原子轨道,每个箭头代表一个电子。
如基态硫原子的轨道表示式为
举例:
↑↓ ↑↓ ↓ ↓↑ ↑ ↑
3
二.原子结构与元素周期表
1.原子的电子构型与周期的关系
(1 )每周期第一种元素的最外层电子的排布式为 ns1。每周期结尾元素的最外层电子排布
式除 He 为 1s2 外,其余为 ns2np6。He 核外只有 2 个电子,只有 1 个 s 轨道,还未出现 p 轨
道,所以第一周期结尾元素的电子排布跟其他周期不同。
(2)一个能级组最多所容纳的电子数等于一个周期所包含的元素种类。但一个能级组不
一定全部是能量相同的能级,而是能量相近的能级。
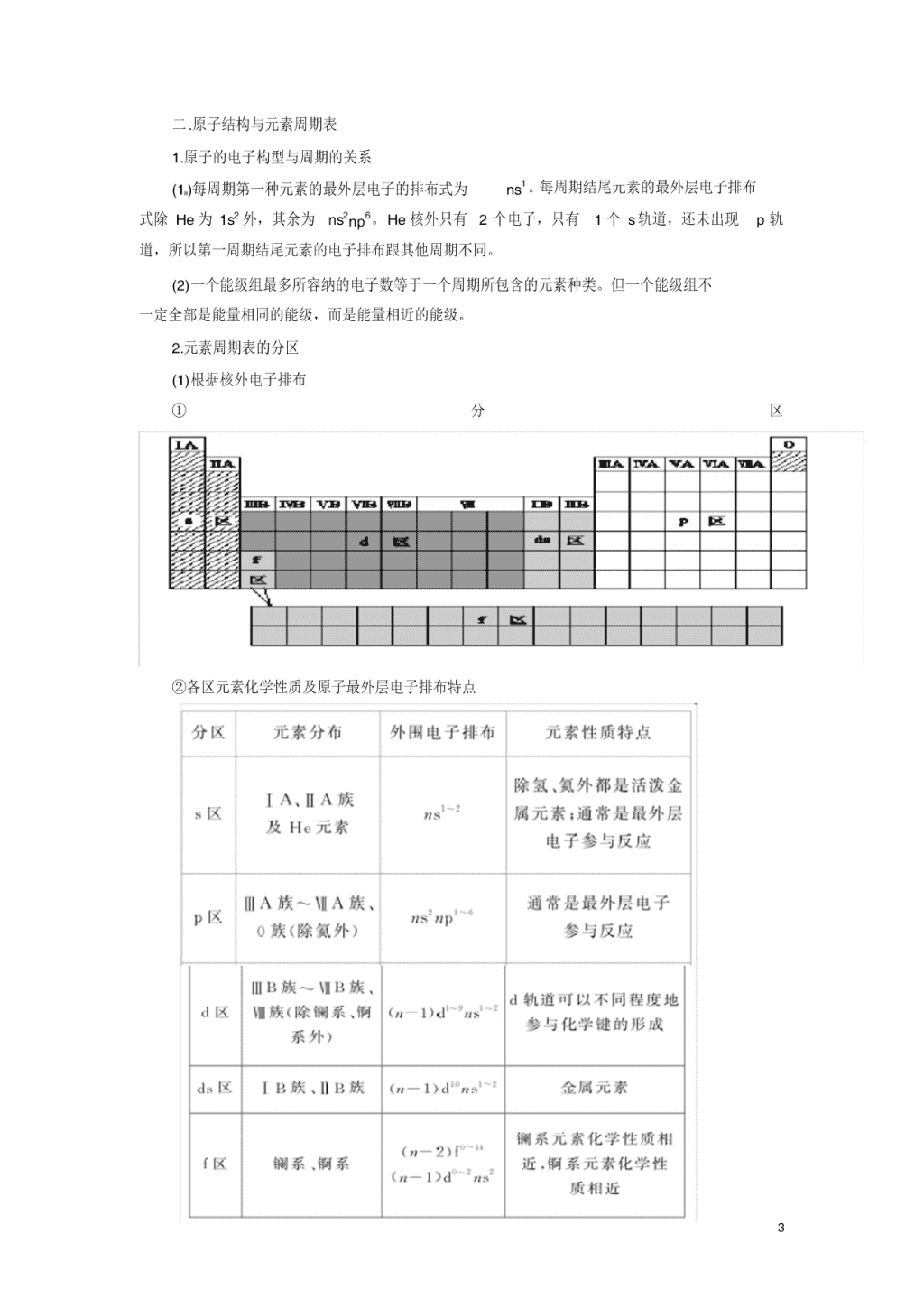
2.元素周期表的分区
(1)根据核外电子排布
① 分 区
②各区元素化学性质及原子最外层电子排布特点
4
③若已知元素的外围电子排布, 可直接判断该元素在周期表中的位置。 如:某元素的外
围电子排布为 4s24p4,由此可知,该元素位于 p 区,为第四周期Ⅵ A 族元素。即最大能层为
其周期数,最外层电子数为其族序数,但应注意过渡元素 (副族与第Ⅷ族 )的最大能层为其周
期数,外围电子数应为其纵列数而不是其族序数 (镧系、锕系除外 )。
三 .元素周期律
1.电离能、电负性
(1)电离能是指气态原子或离子失去 1 个电子时所需要的最低能量, 第一电离能是指电中
性基态原子失去 1 个电子转化为气态基态正离子所需要的最低能量。第一电离能数值越小,
原子越容易失去 1 个电子。在同一周期的元素中,碱金属 (或第Ⅰ A 族)第一电离能最小,稀
有气体 (或 0 族 )第一电离能最大,从左到右总体呈现增大趋势。同主族元素,从上到下 ,第
一电离能逐渐减小。同一原子的第二电离能比第一电离能要大
(2)元素的电负性用来描述不同元素的原子对键合电子吸引力的大小。以氟的电负性
为 4.0,锂的电负性为 1.0 作为相对标准 ,得出了各元素的电负性。电负性的大小也可以作为
判断金属性和非金属性强弱的尺度,金属的电负性一般小于 1.8,非金属的电负性一般大于
1.8,而位于非金属三角区边界的 “类金属 ”的电负性在 1.8 左右。它们既有金属性,又有非金
属性。
(3)电负性的应用
①判断元素的金属性和非金属性及其强弱
②金属的电负性一般小于 1.8,非金属的电负性一般大于 1.8,而位于非金属三角区边界
的“类金属” (如锗、锑等 )的电负性则在 1.8 左右,它们既有金属性,又有非金属性。
③金属元素的电负性越小, 金属元素越活泼; 非金属元素的电负性越大, 非金属元素越
活泼。
④同周期自左到右,电负性逐渐增大,同主族自上而下,电负性逐渐减小。
(4)电离能的应用
①根据电离能数据确定元素核外电子的排布如:
②确定元素在化合物中的化合价
③判断元素金属性强弱
2.原子结构与元素性质的递变规律
5
3.对角线规则
在元素周期表中,某些主族元素与右下方的主族元素的有些性质是相似的,如
第二章 分子结构与性质
一.共价键
1.共价键的本质及特征
共价键的本质是在原子之间形成共用电子对,其特征是具有饱和性和方向性。
2.共价键的类型
①按成键原子间共用电子对的数目分为单键、双键、三键。
②按共用电子对是否偏移分为极性键、非极性键。
③按原子轨道的重叠方式分为σ键和π键, 前者的电子云具有轴对称性, 后者的电子云
具有镜像对称性。
3.键参数
①键能:气态基态原子形成 1 mol 化学键释放的最低能量,键能越大,化学键越稳定。
②键长:形成共价键的两个原子之间的核间距,键长越短,共价键越稳定。
③键角:在原子数超过 2 的分子中,两个共价键之间的夹角。
④键参数对分子性质的影响
键长越短,键能越大,分子越稳定.
6
4.等电子原理:原子总数相同、价电子总数相同的分子具有相似的化学键特征,它们的许多
性质相近。
常见的等电子体:
二.分子的立体构型
1.分子构型与杂化轨道理论
杂化轨道的要点
当原子成键时,原子的价电子轨道相互混杂,形成与原轨道数相等且能量相同的杂化轨道。
杂化轨道数不同,轨道间的夹角不同,形成分子的空间形状不同。
2 分子构型与价层电子对互斥模型
价层电子对互斥模型说明的是价层电子对的空间构型, 而分子的空间构型指的是成键电子对
空间构型,不包括孤对电子。
(1)当中心原子无孤对电子时,两者的构型一致;
(2)当中心原子有孤对电子时,两者的构型不一致。
3.配位化合物
(1)配位键与极性键、非极性键的比较
7
(2)配位化合物
①定义:金属离子 (或原子 )与某些分子或离子 (称为配体 )以配位键结合形成的化合物。
②组成:如 [Ag(NH 3)2]OH ,中心离子为 Ag +,配体为 NH 3,配位数为 2。
三 .分子的性质
1.分子间作用力的比较
2.分子的极性
(1)极性分子:正电中心和负电中心不重合的分子。
(2)非极性分子:正电中心和负电中心重合的分子。
3.溶解性
(1)“相似相溶”规律:非极性溶质一般能溶于非极性溶剂,
极性溶质一般能溶于极性溶剂. 若存在氢键, 则溶剂和溶质之间的氢键作用力越大, 溶解性
越好。
(2)“相似相溶”还适用于分子结构的相似性,如乙醇和水互
溶,而戊醇在水中的溶解度明显减小.
4.手性
具有完全相同的组成和原子排列的一对分子, 如左手和右手一样互为镜像, 在三维空间里不
8
能重叠的现象。
5.无机含氧酸分子的酸性
无机含氧酸可写成 (HO)mROn ,如果成酸 元素 R 相同,则 n 值越大, R 的正电性越高,使
R—O—H 中 O 的电子向 R 偏移,在水分子的作用下越易电离出 H+,酸性越强,如 HClO
<HClO 2<HClO 3< HClO 4
第三章 晶体结构与性质
一.晶体常识
1.晶体与非晶体比较
9
2.获得晶体的三条途径
①熔融态物质凝固。 ②气态物质冷却不经液态直接凝固(凝华) 。③溶质从溶液中析
出。
3.晶胞
晶胞是描述晶体结构的基本单元。晶胞在晶体中的排列呈“无隙并置” 。
4.晶胞中微粒数的计算方法 ——均摊法
如某个粒子为 n 个晶胞所共有, 则该粒子有 1/n 属于这个晶胞。 中学中常见的晶胞为立
方晶胞
立方晶胞中微粒数的计算方法如下:
注意:在使用 “均摊法 ”计算晶胞中粒子个数时要注意晶胞的形状
二.四种晶体的比较
10
2.晶体熔、沸点高低的比较方法
(1)不同类型晶体的熔、沸点高低一般规律:原子晶体>离子晶体>分子晶体。
金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。
(2)原子晶体
由共价键形成的原子晶体中,原子半径小的键长短,键能大,晶体的熔、沸点高.如熔
点:金刚石>碳化硅>硅
(3)离子晶体
一般地说, 阴阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强,相应
的晶格能大,其晶体的熔、沸点就越高。
(4)分子晶体
①分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常的高。
11
②组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。
③组成和结构不相似的物质(相对分子质量接近) ,分子的极性越大,其熔、 沸点越高。
④同分异构体,支链越多,熔、沸点越低。
(5)金属晶体
金属离子半径越小,离子电荷数越多,其金属键越强,金属熔、沸点就越高。
三 .几种典型的晶体模型