- 455.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
练案[17]第六章 化学反应与能量
第17讲 化学反应与能量变化
A组 基础必做题
1.(2019·天津耀华中学模拟)未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列能源符合未来新能源上述要求的是( D )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.③④⑤⑥⑦⑧
C.③⑤⑥⑦⑧ D.⑤⑥⑦⑧
[解析] 围绕新能源丰富,污染小,可再生性等特点,分析作答。
2.(2019·山东济南模拟)下列说法中正确的是( C )
A.在化学反应过程中,发生物质变化的同时不一定发生能量变化
B.破坏生成物中全部化学键所需要的能量大于破坏反应物中全部化学键所需要的能量时,该反应为吸热反应
C.放热反应的ΔH<0
D.放热反应一定不用加热,吸热反应一定需要加热
[解析] A项,物质变化和能量变化是化学反应的两大特征;B项所述反应为放热反应;C项,放热反应的焓变为负,ΔH<0;D项,放热反应或吸热反应的条件都有可能需要加热或不需要加热。
3.(2019·北京门头沟区检测)化学反应常常伴随能量的变化,以下是H2与Cl2反应的能量变化示意图:
根据H2(g)+Cl2(g)===2HCl(g)反应的能量变化示意图,则下列说法正确的是( B )
A.氯化氢分子的电子式:H+[]-
B.该反应是工业制取盐酸的化学反应原理
C.形成1 mol H—Cl键要吸收431 kJ的能量
D.该反应中反应物总能量小于生成物总能量
[解析] HCl为共价化合物,A错误;形成1 mol H—Cl键要释放431 kJ的能量,C错误;1 mol H2(g)和1 mol Cl2(g)断键吸收的总能量小于2 mol HCl(g)形成时释放的总能量,故反应放热,D错误。
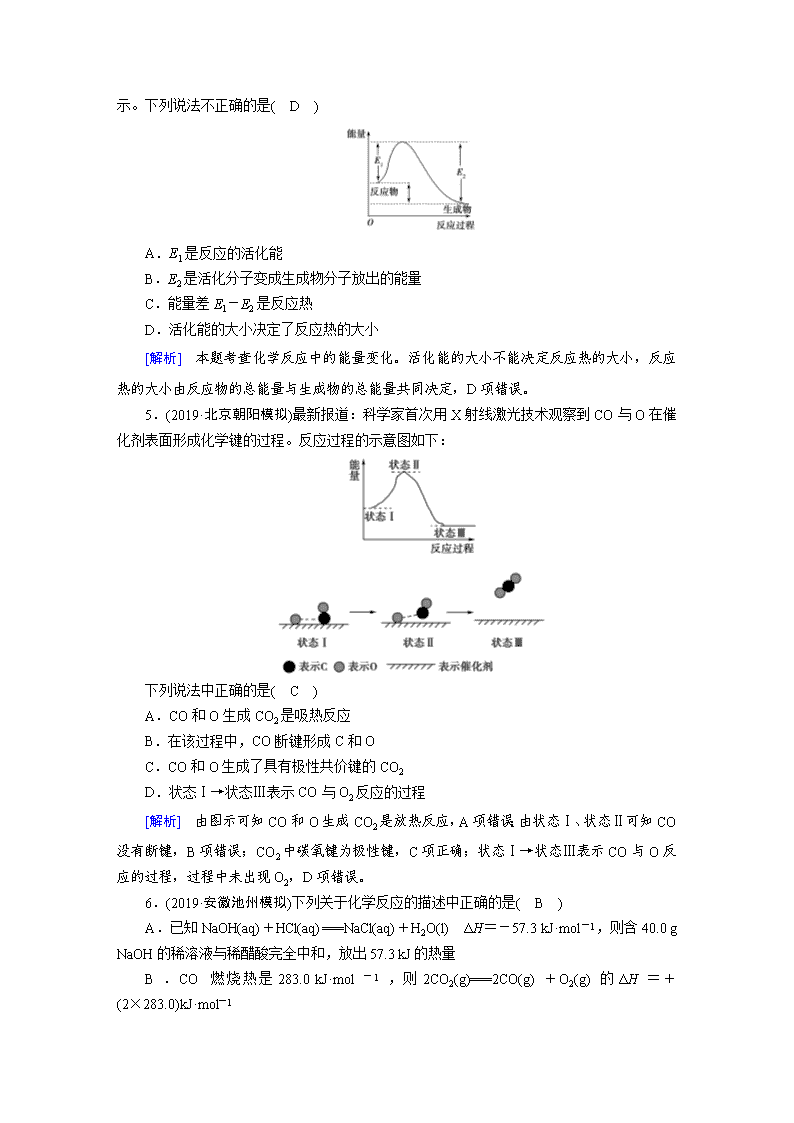
4.(2019·贵州贵阳检测)某化学反应体系中反应物、生成物的能量与活化能的关系如图所示。下列说法不正确的是( D )
A.E1是反应的活化能
B.E2是活化分子变成生成物分子放出的能量
C.能量差E1-E2是反应热
D.活化能的大小决定了反应热的大小
[解析] 本题考查化学反应中的能量变化。活化能的大小不能决定反应热的大小,反应热的大小由反应物的总能量与生成物的总能量共同决定,D项错误。
5.(2019·北京朝阳模拟)最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
下列说法中正确的是( C )
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2
D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
[解析] 由图示可知CO和O生成CO2是放热反应,A项错误;由状态Ⅰ、状态Ⅱ可知CO没有断键,B项错误;CO2中碳氧键为极性键,C项正确;状态Ⅰ→状态Ⅲ表示CO与O反应的过程,过程中未出现O2,D项错误。
6.(2019·安徽池州模拟)下列关于化学反应的描述中正确的是( B )
A.已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出57.3 kJ的热量
B.CO燃烧热是283.0 kJ·mol-1,则2CO2(g)===2CO(g)+O2(g)的ΔH=+(2×283.0)kJ·mol-1
C.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,
氢气燃烧的热化学方程式为2H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ·mol-1
[解析] A项,醋酸为弱酸,电离时要吸热,放出的热量应小于57.3 kJ;C项,甲烷的燃烧热指的是1 mol CH4燃烧生成液态H2O和CO2气体时放出的热量;D项热化学方程式中的ΔH应为-285.8×2 kJ·mol-1。
7.(2019·福建漳州联考)科学家发明了一种新型的燃料电池,其原电池总反应2H2(g)+O2(g)===2H+(aq)+2OH-(aq)的ΔH为[已知H2(g)的燃烧热为285.8 kJ·mol-1,中和热为57.3 kJ·mol-1]( C )
A.+686.2 kJ·mol-1 B.+457.0 kJ·mol-1
C.-457.0 kJ·mol-1 D.-686.2 kJ·mol-1
[解析] 根据已知条件可知:H+(aq)+OH-(aq)===H2O(l) ΔH1=-57.3 kJ·mol-1①,2H2O(l)===2H2(g)+O2(g) ΔH2=+571.6 kJ·mol-1②,根据盖斯定律,由-(①×2+②)求得2H2(g)+O2(g)===2H+(aq)+2OH-(aq) ΔH=-(ΔH1×2+ΔH2)=-(-114.6 kJ·mol-1+571.6 kJ·mol-1)=-457.0 kJ·mol-1,故C项正确。
8.(2019·四川成都检测)某实验小组用0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液进行反应热的测定,实验装置如图所示。
(1)装置中碎泡沫塑料的作用是__隔热保温,防止热量的损失___。
(2)写出该反应的热化学方程式[生成1 mol H2O(l)时的反应热为-57.3 kJ·mol-1]:__H2SO4(aq)+2NaOH(aq)===Na2SO4(aq)+2H2O(l)__△H=-114.6__kJ·mol-1____。
(3)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表所示。
①请填写表格中的空白:
温度
次数
起始温度t1/℃
终止温度
t2/℃
温度差
平均值
(t2-t1)/℃
H2SO4
NaOH
平均值
1
26.2
26.0
26.1
30.1
__4.0___
2
27.0
27.4
27.2
33.3
3
25.9
25.9
25.9
29.8
4
26.4
26.2
26.3
30.4
②近似认为0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1.0 g·mL-1,中和后生成溶液的比热容c=4.18 J·(g·℃)-1。则生成1 mol H2O(l)时的反应热ΔH__-53.5 kg·mol-1___(取小数点后一位)。
③上述实验数值结果与-57.3 kJ·mol-1有偏差,产生偏差的原因不可能是__b___(
填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(4)若将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液和稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为:__ΔH1=ΔH2<ΔH3___。
[解析] (3)①第2组数据偏差较大,应舍去。其他三组的温度差平均值约为4.0℃。②ΔH=-≈-53.5 kJ·mol-1。③放出的热量少可能是热量散失过多、多次加入碱或起始温度读得较高等原因。
(4)稀氢氧化钠溶液和稀氢氧化钙溶液中溶质都完全电离,它们的中和热相同;稀氨水中的NH3·H2O是弱电解质,在与盐酸的反应中,NH3·H2O的电离要吸收热量,故中和热要小一些(或ΔH偏大)。
[易错警示] (1)实验时用环形玻璃搅拌棒搅拌溶液的方法是上下搅动。不能用铜丝搅拌棒代替环形玻璃搅拌棒,因为铜传热快,热量损失大。(2)中和热不包括离子在水溶液中的生成热、物质的溶解热、电解质电离时的热效应。(3)取多次实验t1、t2的平均值代入公式计算,而不是取结果的平均值,计算时应注意单位的统一。但要注意数据的取舍,离群数据要舍去。
B组 能力提升题
9.(2019·安徽皖南名校联考)化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图所示为N2(g)和O2(g)反应生成NO(g)过程中的能量变化。
下列说法正确的是( B )
A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ
B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
C.通常情况下,N2(g)和O2(g)混合能直接生成NO
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
[解析] 1 mol N2和1 mol O2反应过程中,吸收的能量是946 kJ+498 kJ=1444 kJ,放出的能量是1264 kJ,所以1 mol N2(g)和1 mol O2(g)反应的反应热ΔH=+1444 kJ·mol-1-1264 kJ·mol-1=+180 kJ·mol-1,该反应为吸热反应,A错误;根据A中分析可知1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量,B正确;该反应是吸热反应,通常情况下,N2(g)和O2(g)
混合不能直接生成NO,一般需要高温或放电,C错误;NO不能与碱反应生成盐和水,不是酸性氧化物,D错误。
10.(2019·山东青岛联考)已知:H2(g)+Br2(g)===2HBr(g)ΔH=-72 kJ/mol,1 mol Br2(g)液化放出的能量为30 kJ,其他相关数据如表所示:
一定状态的分子
H2(g)
Br2(l)
HBr(g)
1 mol该分子中的化学键断裂吸收的能量/kJ
436
a
369
则上述表格中的a值为( C )
A.404 B.344
C.260 D.200
[解析] 设1 mol Br2(g)的化学键断裂吸收的热量为x kJ,由H2(g)+Br2(g)===2HBr(g) ΔH=-72 kJ/mol知ΔH=436 kJ/mol+x kJ/mol-369 kJ/mol×2=-72 kJ/mol,解得x=230。1 mol Br2(g)液化放出的能量为30 kJ,则a=260。
11.(2019·河南豫南九校联盟联考)根据碘与氢气反应的热化学方程式:
①I2(g)+H2(g)2HI(g) ΔH=-9.48 kJ/mol
②I2(g)+H2(g)2HI(g) ΔH=+26.48 kJ/mol
下列判断正确的是( D )
A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应①的产物比反应②的产物稳定
D.反应②的反应物总能量比反应①的反应物总能量低
[解析] 题中反应为可逆反应,反应时放热小于9.48 kJ,A项错误;反应①~②得I2(g)===I2(s) ΔH=-35.96 kJ/mol,B错误;①②两个反应生成相同的产物,产物的状态相同,则稳定性相同,C错误;对于同一物质,物质的量相同时固态物质的能量比气态物质的能量低,D正确。
12.(2019·新题预选)下列有关图像的叙述不正确的是( A )
A.图Ⅰ:H2的燃烧热为245 kJ·mol-1
B.图Ⅱ:b可能为使用催化剂的曲线,活化能降低
C.图Ⅱ:恒温恒容时,向容器中充入1 mol N2、3 mol H2,充分反应后放热小于92.2 kJ
D.图Ⅲ:HgO(s)===Hg(l)+O2(g) ΔH=+90.7 kJ·mol-1
[解析] 根据燃烧热的概念,H2的燃烧热为1 mol H2(g)完全燃烧生成稳定氧化物H2O(l)时所放出的热量,由图I可知H2O为气态,A项叙述错误。由图Ⅱ可知,曲线b
的活化能低于a的,b可能使用了催化剂,B项叙述正确。由于N2与H2合成NH3为可逆反应,故充分反应后达到平衡时放热小于92.2 kJ,C项叙述正确。由图Ⅲ可知,HgO(s)分解为Hg(l)和O2(g)为吸热反应,热化学方程式书写正确,D项叙述正确。
13.(2019·山东滨州检测)下列关于化学反应中能量变化的叙述正确的是( D )
A.由H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol知,中和热为57.3 kJ/mol
B.一定条件下,0.2 mol SO2(g)与0.1 mol O2(g)混合充分反应时放出的热量的18 kJ,则有2SO2(g)+O2(g)2SO3(g) ΔH=-180 kJ/mol
C.已知H2(g)+O2(g)===H2O(g) ΔH=-241.8 kJ/mol,则H2的燃烧热为241.8 kJ/mol
D.已知S(s)+O2(g)===SO2(g) ΔH1,S(g)+O2(g)===SO2(g) ΔH2,则ΔH1>ΔH2
[解析] 本题考查热化学知识,意在考查考生对化学基本概念与理论的应用能力。有弱碱或弱酸参与的中和反应的中和热不是57.3 kJ/mol,A错误;因为SO2(g)与O2(g)的反应是可逆的,0.2 mol SO2(g)与0.1 mol O2(g)混合充分反应时消耗的SO2(g)少于0.2 mol,故所给热化学方程式错误,B错误;与燃烧热对应的生成物中水应为液态,C错误;固态硫所具有的能量低于气态硫,D正确。
[特别提醒] 中和热:在稀溶液中,强酸跟强碱发生中和反应生成1 mol液态H2O时的反应热。需注意:①稀溶液是指物质溶于大量水中;②中和热不包括离子在水溶液中的生成热、物质的溶解热、电解质电离时的热效应;③中和反应的实质是H+和OH-化合生成H2O,即H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1。
14.(2019·河北衡水检测)在25 ℃、1.01×105 Pa下,将22 g CO2通入750 mL 1.0 mol·L-1的NaOH溶液中充分反应,放出x kJ热量。在该条件下,将1 mol CO2通入2L 1.0 mol·L-1的NaOH溶液中充分反应,放出y kJ热量,则CO2与NaOH反应生成NaHCO3的热化学方程式为( B )
A.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(2y-x) kJ·mol-1
B.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(4x-y) kJ·mol-1
C.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(2x-y) kJ·mol-1
D.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(8x-2y) kJ·mol-1
[解析] 根据题意,将22 gCO2通入750 mL 1.0 mol·L-1的NaOH溶液中充分反应,n(CO2)==0.5 mol,n(NaOH)=1.0 mol·L-1×0.75 L=0.75 mol,反应产物为碳酸钠和碳酸氢钠,反应的化学方程为2CO2+3NaOH===NaHCO3+Na2CO3+H2O,由0.5 mol CO2参加反应放出热量为x kJ知,2 mol CO2参加反应放出的热量为4x kJ,即热化学方程式为2CO2(g)+3NaOH(aq)===NaHCO3(aq)+Na2CO3(aq)+H2O(l) ΔH=-4x kJ·mol-1①,又将1 mol CO2通入2 L 1.0 mol·L-1NaOH溶液中充分反应入出y kJ的热量,则热化学方程式为2NaOH(aq)+CO2(g)===Na2CO3(aq)+H2O(l) ΔH=-y kJ·mol-1②,根据盖斯定律,由①-②可得
NaOH(aq)+CO2(g)===NaHCO3(aq) ΔH=-(4x-y)kJ·mol-1。
15.(2018·课标Ⅲ理综)(1)三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)===SiH2Cl2(g)+SiCl4(g) ΔH1=48 kJ·mol-1
3SiH2Cl2(g)===SiH4(g)+2SiHCl3(g) ΔH2=-30 kJ·mol-1
则反应4SiHCl3(g)===SiH4(g)+3SiCl4(g)的ΔH为__114___kJ·mol-1。
(2)丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
已知:①C4H10(g)===C4H8(g)+H2(g) ΔH1
②C4H10(g)+O2(g)===C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
③H2(g)+O2(g)===H2O(g) ΔH3=-242 kJ·mol-1
反应①的ΔH1为__+123___kJ·mol-1。
[解析] (1)给题给两个热化学方程式分别编号为①、②,利用盖斯定律,①×3+②即可得到4SiHCl3(g)===SiH4(g)+3SiCl4(g) ΔH=+114 kJ·mol-1。
(2)根据盖斯定律,由反应②-反应③可得反应①
C4H10(g)===C4H8(g)+H2(g) ΔH1=ΔH2-ΔH3=-119 kJ·mol-1-(-242 kJ·mol-1)=+123 kJ·mol-1。
16.(2019·山西名校联考)(1)在化工生产过程中,少量CO的存在会引起催化剂中毒。为了防止催化剂中毒,常用SO2将CO氧化,SO2被还原为S。已知:
①C(s)+O2(g)===CO(g) ΔH1=-126.4 kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ·mol-1
③S(s)+O2(g)===SO2(g) ΔH3=-296.8 kJ·mol-1
则SO2氧化CO的热化学方程式为__SO2(g)+2CO(g)===S(s)+2CO2(g)__ΔH=-237.4__kJ·mol-1____。
(2)用O2将HCl转化为Cl2,可提高效率,减少污染。传统上该转化通过下图所示的催化循环实现。
其中,反应①为2HCl(g)+CuO(s)===H2O(g)+CuCl2(s) ΔH1
反应②生成1 mol Cl2的反应热为ΔH2,则总反应的热化学方程式为__2HCl(g)+O2(g)===H2O(g)+Cl2(g)______ ______(反应热用ΔH1和ΔH2表示)。
(3)将CH4与H2O(g)通入聚焦太阳能反应器,可发生反应:
①CH4(g)+H2O(g)===CO(g)+3H2(g),该反应的ΔH=+206 kJ·mol-1
已知:②CH4(g)+2O2(g)===CO2(g)+2H2O(g)
ΔH=-802 kJ·mol-1,写出由CO2和H2O(g)生成CO的热化学方程式:__CO2(g)+3H2O(g)===2O2(g)+CO(g)+3H2(g)__ΔH=+1008__kJ·mol-1____。
(4)工业上合成氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g)CO(g)+H2(g);
②用天然气跟水蒸气反应:CH4(g)+H2O(g)CO(g)+3H2(g)
已知有关反应的能量变化如下图所示,则方法②中反应的ΔH=__(a+3b-c)_kg·mol-1___。
[解析] (1)由盖斯定律可知,待求反应式可通过反应2×②-2×①-③得到,进而求出待求反应的ΔH。
(2)反应②的热化学方程式为
CuCl2(s)+O2(g)===CuO(s)+Cl2(g) ΔH2。
故总反应2HCl(g)+O2(g)===H2O(g)+Cl2(g)
ΔH=ΔH1+ΔH2。
(3)由①式-②式得CO2(g)+3H2O(g)===2O2(g)+CO(g)+3H2(g) ΔH=+206 kJ·mol-1-(-802 kJ·mol-1)=+1008 kJ·mol-1。
(4)由图可知:
Ⅰ.CO(g)+O2(g)===CO2(g) ΔH=-a kJ·mol-1;
Ⅱ.O2(g)+H2(g)===H2O(g) ΔH=-b kJ·mol-1;
Ⅲ.CH4(g)+2O2(g)===CO2(g)+2H2O(g)
ΔH=-c kJ·mol-1。
根据盖斯定律可知反应②的ΔH为(-c+3b+a) kJ·mol-1。