- 409.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
原电池和电解池的工作原理
一.选择题(共15小题)
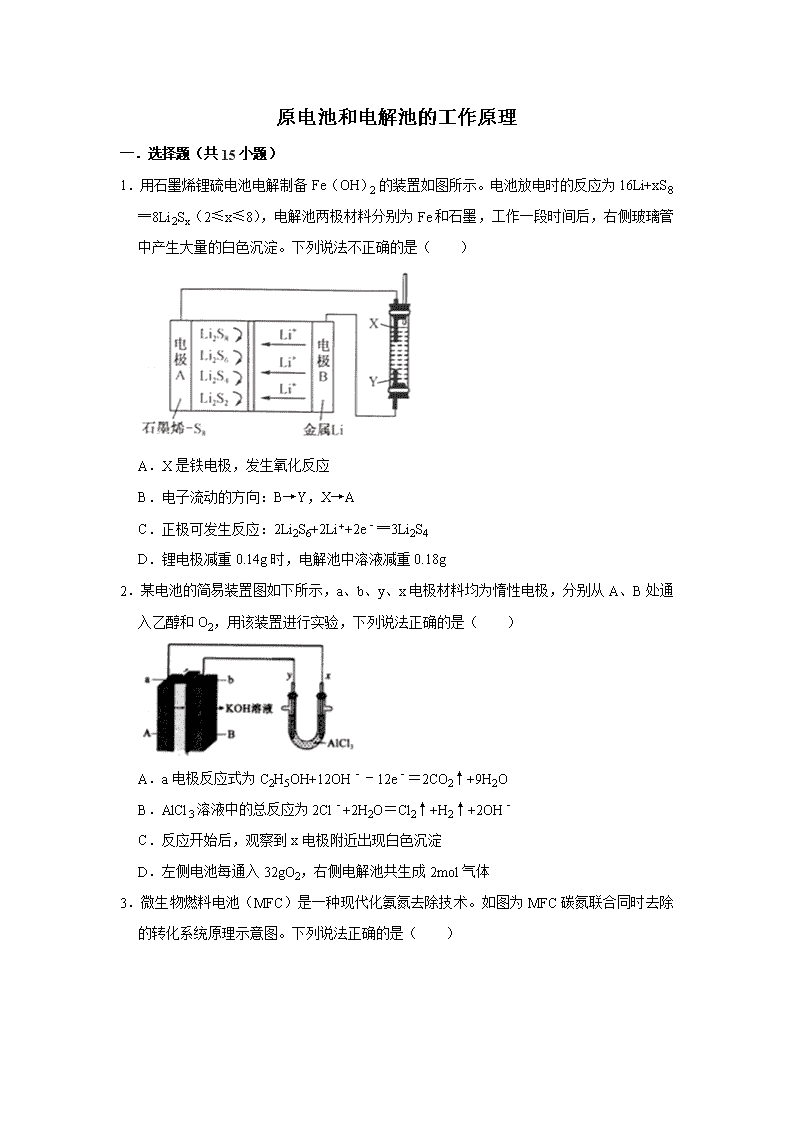
1.用石墨烯锂硫电池电解制备Fe(OH)2的装置如图所示。电池放电时的反应为16Li+xS8═8Li2Sx(2≤x≤8),电解池两极材料分别为Fe和石墨,工作一段时间后,右侧玻璃管中产生大量的白色沉淀。下列说法不正确的是( )
A.X是铁电极,发生氧化反应
B.电子流动的方向:B→Y,X→A
C.正极可发生反应:2Li2S6+2Li++2e﹣═3Li2S4
D.锂电极减重0.14g时,电解池中溶液减重0.18g
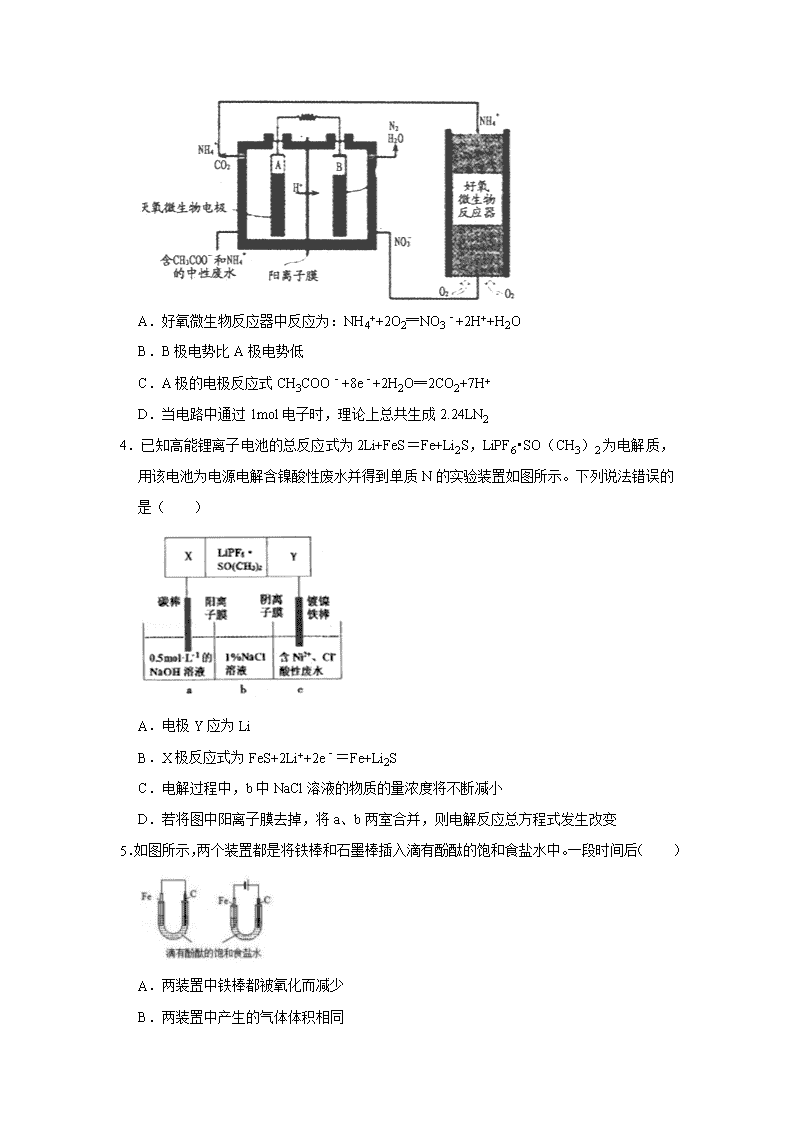
2.某电池的简易装置图如下所示,a、b、y、x电极材料均为惰性电极,分别从A、B处通入乙醇和O2,用该装置进行实验,下列说法正确的是( )
A.a电极反应式为C2H5OH+12OH﹣﹣12e﹣=2CO2↑+9H2O
B.AlCl3溶液中的总反应为2Cl﹣+2H2O=Cl2↑+H2↑+2OH﹣
C.反应开始后,观察到x电极附近出现白色沉淀
D.左侧电池每通入32gO2,右侧电解池共生成2mol气体
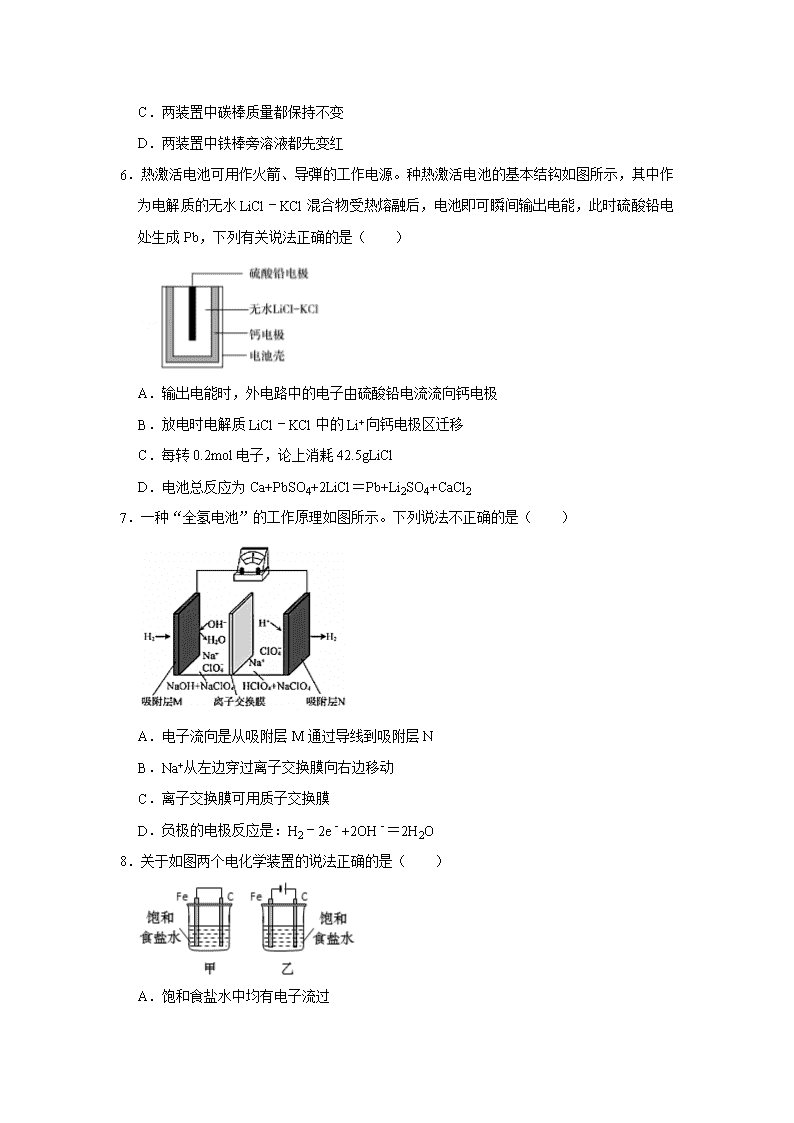
3.微生物燃料电池(MFC)是一种现代化氨氮去除技术。如图为MFC碳氮联合同时去除的转化系统原理示意图。下列说法正确的是( )
A.好氧微生物反应器中反应为:NH4++2O2═NO3﹣+2H++H2O
B.B极电势比A极电势低
C.A极的电极反应式CH3COO﹣+8e﹣+2H2O═2CO2+7H+
D.当电路中通过1mol电子时,理论上总共生成2.24LN2
4.已知高能锂离子电池的总反应式为2Li+FeS=Fe+Li2S,LiPF6•SO(CH3)2为电解质,用该电池为电源电解含镍酸性废水并得到单质N的实验装置如图所示。下列说法错误的是( )
A.电极Y应为Li
B.X极反应式为FeS+2Li++2e﹣=Fe+Li2S
C.电解过程中,b中NaCl溶液的物质的量浓度将不断减小
D.若将图中阳离子膜去掉,将a、b两室合并,则电解反应总方程式发生改变
5.如图所示,两个装置都是将铁棒和石墨棒插入滴有酚酞的饱和食盐水中。一段时间后( )
A.两装置中铁棒都被氧化而减少
B.两装置中产生的气体体积相同
C.两装置中碳棒质量都保持不变
D.两装置中铁棒旁溶液都先变红
6.热激活电池可用作火箭、导弾的工作电源。种热激活电池的基本结钩如图所示,其中作为电解质的无水LiCl﹣KCl混合物受热熔融后,电池即可瞬间输出电能,此时硫酸铅电处生成Pb,下列有关说法正确的是( )
A.输出电能时,外电路中的电子由硫酸铅电流流向钙电极
B.放电时电解质LiCl﹣KCl中的Li+向钙电极区迁移
C.每转0.2mol电子,论上消耗42.5gLiCl
D.电池总反应为Ca+PbSO4+2LiCl=Pb+Li2SO4+CaCl2
7.一种“全氢电池”的工作原理如图所示。下列说法不正确的是( )
A.电子流向是从吸附层M通过导线到吸附层N
B.Na+从左边穿过离子交换膜向右边移动
C.离子交换膜可用质子交换膜
D.负极的电极反应是:H2﹣2e﹣+2OH﹣=2H2O
8.关于如图两个电化学装置的说法正确的是( )
A.饱和食盐水中均有电子流过
B.甲中铁被腐蚀,乙中铁被保护
C.甲中正极反应式为4OH﹣﹣4e→2H2O+O2↑
D.乙中石墨电极上发生还原反应
9.LED系列产品是一类新型节能产品。图甲是NaBH4/H2O2燃料电池的装置示意图,图乙是LED发光二极管的装置示意图。下列叙述错误的是( )
A.电池应选用阳离子交换膜,Na+向A极区移动
B.电池A极区的电极反应式为:H2O2+2e﹣=2OH﹣
C.每有1 molNaBH4参加反应,转移电子数为4NA
D.要使LED发光二极管正常发光,图乙中的导线a应与图甲中的B极相连
10.水系锌离子电池是一种新型二次电池,工作原理如图。该电池以粉末多孔锌电极(锌粉、活性炭及粘结剂等)为负极,V2O5为正极,三氟甲磺酸锌[Zn(CF3SO3)2]为电解液。下列叙述错误的是( )
A.放电时,Zn2+向V2O5电极移动
B.充电时,阳极区电解液的浓度变大
C.充电时,粉末多孔锌电极发生还原反应
D.放电时,V2O5电极上的电极反应式为V2O5+xZn2++2xe﹣=ZnxV2O5
11.有关如图装置的说法中正确的是( )
A.若两电极直接连接,a是食盐水,则发生析氢腐蚀
B.若两电极直接连接,a是食盐水,则负极反应是:Fe﹣2e→Fe2+
C.若铁接电源负极,石墨接电源正极,a是食盐水,左侧电极上析出的气泡比右侧电极上的多
D.若铁接电源负极,石墨接电源正极,a是氯化铜,铁上有气泡
12.石墨烯电池是利用锂离子在石墨烯表面和电极之间快速大量穿梭运动的特性而研发的新型可充放电电池,其反应式为LixC6+Li1﹣xCoO2C6+LiCoO2,其工作原理如图所示。下列关于该电池的说法正确的是( )
A.充电时,Li+嵌入LiCoO2中
B.放电时,LiCoO2极发生的电极反应为LiCoO2﹣xe﹣═Li1﹣xCoO2+xLi+
C.放电时负极反应为:Li﹣e﹣═Li+
D.充电时,若转移1mole﹣,石墨烯电极增重7g
13.如图所示,装置Ⅰ为新型电池,放电时电极B的电极反应式为NaBr3+2Na++2e﹣=3NaBr,装置Ⅱ为铅蓄电池。首先闭合K1,断开K2,当铅蓄电池充电片刻后,断开K1,闭合K2,下列说法正确的是( )
A.断开K1,闭合K2时,装置Ⅱ中SO42﹣向a电极迁移
B.闭合K1,断开K2时,每有0.1 mol Na+通过离子交换膜,b电极上产生10.35g Pb
C.断开K1,闭合K2时,b电极的电极反应式为PbO2+2e﹣+SO42﹣+4H+=PbSO4+2H2O
D.装置Ⅰ放电时的电池反应式为 Na2S4+3NaBr═2Na2S2+NaBr3
14.大阳能路灯蓄电池是磷酸铁锂电池,其工作原理如图。M电极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1﹣x FepO4 LiFePO4+6C.下列说法正确的是( )
A.放电时Li+从左边移向右边,PO43﹣从右边移向左边
B.放电时,正极反应式为:Li1﹣xFePO4+xLi++xe﹣=LiFePO4
C.充电时M极连接电源的负极,电极反应为6C+xe﹣=C6x﹣
D.充电时电路中通过2.0mol电子,产生7.0gLi
15.碱性锌锰电池(电极材料为Zn和MnO2,电解质为KOH)有着很广的应用。下列有关碱性锌锰电池说法正确的是( )
A.Zn为正极,MnO2为负极
B.工作时电子由MnO2极经外电路流向Zn极
C.负极的电极反应为:Zn﹣2e﹣+2OH﹣=Zn(OH)2
D.工作时消耗1molMnO2,理论上生成氧化产物1mol
二.填空题(共4小题)
16.人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.
(1)工业上常用高浓度的K2CO3 溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如1下:
在阳极区发生的反应包括 和H++HCO3﹣═H2O+CO2↑.
(2)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇.
已知:25℃,101KPa下:
H2(g)+O2(g)═H2O(g)△H1=﹣242kJ•mol﹣1
CH3OH(g)+O2(g)═CO2 (g)+2H2O(g)△H2=﹣676kJ•mol﹣1
①写出CO2和H2生成气态甲醇等产物的热化学方程式 .
②下面表示合成甲醇的反应的能量变化示意图3,其中正确的是 (填字母序号).
(3)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置.已知某种甲醇微生物燃料电池中,电解质溶液为酸性,示意图如2下:
①该电池外电路电子的流动方向为 (填写“从A到B”或“从B到A”).
②A电极附近甲醇发生的电极反应式为 .
17.仔细分析如图装置,完成下面的填空:
(1)该反应的电流方向是 .
(2)盐桥中的阴离子向 溶液中移动.
(3)一段时间后,锌片上的现象是 ,铜片上的现象是 .
(4)锌极发生 反应,总反应方程式为 .
(5)30min后,1.3g的Zn参加了反应,则转移了 个电子.
18.甲醇是燃料电池的常见原料,现以熔融的K2CO3为电解质,以甲醇为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.图是甲醇燃料电池模型,试回答下列问题:
①写出该燃料电池的正极反应式 .
②b处应该通入 (填空气或者甲醇)M、N是阴离子交换膜,则阴离子移动的方向是 (填“从左到右”或“从右到左”)
③用该电池电解500mL,0.2mol/L的CuSO4溶液,消耗3.2g甲醇时,阴极析出Cu的质量为 .
19.氮、硫、氯及其化合物是中学化学重要的组成部分.
(1)氨气燃料电池使用的电解质溶液是 KOH 溶液,电池反应为:4NH3+3O2═2N2+6H2O.该电池负极的电极反应式为 ;用该电池进行粗铜(含 Al、Zn、Ag、Pt、Au 等杂质)的电解精炼,以CuSO4溶液为电解质溶液,下列说法正确的是 .
a.电能全部转化为化学能
b.SO42﹣的物质的量浓度不变(不考虑溶液体积变化)
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
e.若阳极质量减少64g,则转移电子数为2NA个
(2)已知KSP(BaSO4)=1.0×10﹣10,KSP(BaCO3)=2.5×10﹣9.
某同学设想用下列流程:BaSO4BaCO3BaCl2,得到 BaCl2,则①的离子方程式为 ,该反应的平衡常数K= .
原电池和电解池的工作原理
参考答案与试题解析
一.选择题(共15小题)
1.【分析】根据电池反应16Li+xS8=8Li2Sx(2≤x≤8)可知负极锂失电子发生氧化反应,电极反应为:Li﹣e﹣=Li+,Li+移向正极,所以A是正极,发生还原反应:S8+2e﹣=S82﹣,S82﹣+2Li+=Li2S8,3Li2S8+2Li++2e﹣=4Li2S6,2Li2S6+2Li++2e﹣=3Li2S4,Li2S4+2Li++2e﹣=2Li2S2,根据电极反应式结合电子转移进行计算。
【解答】解:A、电解制备Fe(OH)2的装置,所以铁被氧化,为阳极,发生氧化反应,所以Y为阴极,故A正确;
B、电子从电池的负极流至电解池的阴极,然后从电解池的阳极流回到电池的正极,即流动的方向:B→Y,X→A,故B正确;
C、电极A发生还原反应,即正极反应式为:2Li2S6+2Li++2e﹣=3Li2S4,故C正确;
D、负极反应为:Li﹣e﹣=Li+,锂电极减重0.14g时,当消耗的锂为0.02mol,外电路流过0.02mol电子时,电解池的总反应为:Fe+2H2OFe(OH)2↓+H2↑,溶液转移0.02mol的电子,消耗0.02mol的水,即减轻0.36g,故D错误;
故选:D。
2.【分析】由图知,左图是原电池,右图是电解池,原电池中投放燃料的电极是负极,投放氧化剂的电极是正极,则a负极,b是正极;电解池中阳极上氯离子放电,阴极上氢离子放电。反应开始后观察到x电极附近出现白色沉淀,说明x电极上氢离子放电,x电极附近生成氢氧根离子,所以x电极是阴极,y电极是阳极,由此分析解答。
【解答】解:A、电解质为碱,a电极为负极,电极反应式为C2H5OH+16OH﹣﹣12e﹣=2CO32﹣+11H2O,故A错误;
B、电解池中电池反应式为2AlCl3+6H2O3Cl2↑+3H2↑+2Al(OH)3↓,故B错误;
C、反应开始后,观察到x电极附近出现白色沉淀氢氧化铝,故C正确;
D、左侧电池每通入32gO2,即转移4mol电子,所以右侧电解池共生成mol=4mol混合气体,故D错误;
故选:C。
3.【分析】图示分析可知:酸性介质中,微生物燃料电池中氢离子移向B电极,说明A为原电池的负极,B为原电池的正极,NO3﹣离子在正极得到电子生成氮气、发生还原反应,CH3COO﹣在原电池负极失电子、发生氧化反应生成二氧化碳气体,NH4+在好氧微生物反应器中转化为NO3﹣,据此分析解答。
【解答】解:A.NH4+在好氧微生物反应器中转化为NO3﹣,结合电子守恒、电荷守恒得到反应的离子方程式为NH4++2O2═NO3﹣+2H++H2O,故A正确;
B.微生物燃料电池中氢离子移向B电极,说明A为原电池的负极,B为原电池的正极,所以B极电势比A极电势高,故B错误;
C.酸性介质中,CH3COO﹣在原电池负极失电子、发生氧化反应生成CO2气体,则A极的电极反应式为:CH3COO﹣﹣8e﹣+2H2O═2CO2+7H+,故C错误;
D.NO3﹣离子在正极得到电子生成氮气,电极反应式为2NO3﹣+12H++10e﹣=N2↑+6H2O,电路中通过1mol电子时,标准状况下,理论上总共生成0.1mol即2.24LN2,但由于选项中没有指明气体的存在条件,所以不能确定N2的体积,故D错误;
故选:A。
4.【分析】由反应FeS+2Li=Fe+Li2S可知,Li被氧化,应为原电池的负极,FeS被还原生成Fe,为正极反应,用该电池为电源电解含镍酸性废水并得到单质Ni,则镀镍铁棒为阴极,发生还原反应,连接原电池负极,碳棒为阳极,连接电源的正极,发生氧化反应,据此分析解答。
【解答】解:A、用该电池为电源电解含镍酸性废水并得到单质Ni,发生还原反应,则镀镍铁棒为阴极,连接原电池负极,碳棒为阳极,连接电源的正极,又由反应FeS+2Li=Fe+Li2S可知,Li被氧化,应为原电池的负极,FeS被还原生成Fe,为正极反应,所以电极X为FeS,Y为Li,故A正确;
B、电极X为FeS,为正极反应,反应式为FeS+2Li++2e﹣═Fe+Li2S,故B正确;
C、镀镍铁棒与电源负极相连是电解池的阴极,电极反应Ni2++2e﹣=Ni,电解过程中为平衡a、c中的电荷,a中的Na+和c中的Cl﹣分别通过阳离子膜和阴离子膜移向b中,这使b中NaCl溶液的物质的量浓度不断增大,故C错误;
D、若将图中阳离子膜去掉,由于放电顺序Cl﹣>OH﹣,则Cl﹣移向阳极放电:2Cl﹣﹣﹣2e﹣=Cl2↑,电解反应总方程式会发生改变,故D正确。
故选:C。
5.【分析】左装置构成原电池,铁作负极,石墨作正极,负极上铁失电子发生氧化反应,正极上氧气得电子发生还原反应,所以铁发生吸氧腐蚀;右装置构成电解池,铁是阴极,石墨是阳极,阳极上氯离子失电子发生氧化反应,阴极上氢离子得电子发生还原反应。
【解答】解:A、左边的铁为负极失电子,而右边的铁为阴极水中的氢离子放电,所以只有左边铁棒都被氧化而减少,故A错误;
B、左装置构成原电池,是铁发生吸氧腐蚀,无气体放出,而右边装置是电解产生氢气和氯气,所以两个装置产生气体的体积不等,故B错误;
C、两个装置中碳棒本身都不参加反应,所以两装置中碳棒质量都保持不变,故C正确;
D、左边装置中碳棒周围是氧气得电子生成氢氧根离子,而使酚酞变红,而不是在铁棒周围,故D错误;
故选:C。
6.【分析】由题目可知硫酸铅电极处生成Pb,则硫酸铅电极的反应为:PbSO4+2e﹣+2Li+=Pb+Li2SO4则硫酸铅电极为电池的正极,钙电极为电池的负极,由此分析解答。
【解答】解:A、输出电能时,电子由负极经过外电路流向正极,即从钙电极经外电路流向硫酸铅电极,故A错误;
B、Li+带正电,放电时向正极移动,即向硫酸铅电极迁移,故B错误;
C、钙电极为负极,电极反应方程式为Ca+2Cl﹣﹣2e﹣=CaCl2,根据正负极电极反应方程式可知2e﹣~2LiCl,每转移0.2mol电子,消耗0.2mol LiCl,即消耗85g的LiCl,故C错误;
D、负极反应方程式为Ca+2Cl﹣﹣2e﹣=CaCl2,正极电极反应方程式为:PbSO4+2e﹣+2Li+=Pb+Li2SO4,则总反应方程式为:PbSO4+Ca+2LiCl=Pb+CaCl2+Li2SO4,故D正确;
故选:D。
7.【分析】由工作原理图可知,左边吸附层M上氢气失电子与氢氧根结合生成水,发生了氧化反应为负极,电极反应是H2﹣2e﹣+2OH﹣═2H2O,右边吸附层N为正极,发生了还原反应,电极反应是2e﹣+2H+═H2,结合原电池中阳离子移向正极,阴离子移向负极,电子由负极经过导线进入正极,据此解答。
【解答】解:A.由工作原理图可知,左边吸附层M为负极,右边吸附层N为正极,则电子流向为从吸附层M通过导线到吸附层N,故A正确;
B.原电池中阳离子移向正极,阴离子移向负极,所以电解质溶液中Na+向右边移动,故B正确;
C.由工作原理图可知,左边溶液为碱性,右边溶液为酸性,所以离子交换膜可阻止左边的碱性溶液和右边的酸性溶液发生中和,故C错误;
D.左边吸附层M为负极极,发生了氧化反应,电极反应是H2﹣2e﹣+2OH﹣=2H2O,故D正确;
故选:C。
8.【分析】甲装置是原电池,金属铁是负极,发生失电子的氧化反应,乙装置是电解池,金属铁是阴极,阴极上是氢离子发生得电子的还原反应,根据原电池和电解池的工作原理知识来回答。
【解答】解:A、甲装置是原电池,金属铁是负极,发生失电子的氧化反应,乙装置是电解池,金属铁是阴极,都会形成闭合回路,但是电子不会经过电解质,故A错误;
B、甲装置是原电池,金属铁是负极,被腐蚀,乙装置是电解池,金属铁是阴极,铁被保护,故B正确;
C、甲装置是原电池,发生金属的吸氧腐蚀,正极反应式为2H2O+4e﹣+O2=4OH﹣,故C错误;
D、乙装置是电解池,金属铁是阴极,乙中石墨电极是阳极,发生氧化反应,故D错误。
故选:B。
9.【分析】根据图片知,双氧水得电子发生还原反应,则A电极为正极,B电极为负极,负极上BH4﹣得电子和氢氧根离子反应生成BO2﹣,正极电极反应式为H2O2+2e﹣=2OH﹣,负极发生氧化反应生成BO2﹣,电极反应式为BH4﹣+8OH﹣﹣8e﹣=BO2﹣+6H2O,根据原电池的工作原理来回答。
【解答】解:A、电池放电过程中,阳离子移向正极,Na+从负极区向正极区移动,故A正确;
B、根据图片知,双氧水得电子发生还原反应,则A电极为正极,正极电极反应式为H2O2+2e﹣=2OH﹣,故B正确;
C、负极发生氧化反应生成BO2﹣,电极反应式为BH4﹣+8OH﹣﹣8e﹣=BO2﹣+6H2O,有1molNaBH4参加反应转移电子数为8NA,故C错误;
D、要使LED发光二极管正常发光,图乙中的导线a阴极应与图甲中的B极负极相连,故D正确。
故选:C。
10.【分析】A、原电池中阳离子向正极移动;
B、充电时,阳极区发生氧化反应;
C、充电时,粉末多孔锌电极为阴极;
D、放电时,V2O5电极上发生还原反应。
【解答】解:A、原电池中阳离子向正极移动,所以放电时,Zn2+向V2O5电极移动,故A正确;
B、充电时,阳极区发生氧化反应,电极反应式为:ZnxV2O5﹣2xe﹣=V2O5+xZn2+,锌离子通过阳离子交换膜向左移动,所以阳极区电解液的浓度变小,故B错误;
C、充电时,粉末多孔锌电极为阴极,发生还原反应,故C正确;
D、放电时,V2O5电极上发生还原反应,电极反应式为:V2O5+xZn2++2xe﹣=ZnxV2O5,故D正确;
故选:B。
11.【分析】A.电解质为酸性环境下,金属发生析氢腐蚀;
B.原电池的负极发生失电子的氧化反应;
C.若铁接电源负极,石墨接电源正极,a是食盐水,铁电极上生成氯气,石墨上生成氢气;
D.若铁接电源负极,石墨接电源正极,a是氯化铜,铁为阴极,阴极上阳离子得电子。
【解答】解:A.若两电极直接连接,a是食盐水,则发生吸氧腐蚀,酸性环境下才发生析氢腐蚀,故A错误;
B.若两电极直接连接,a是食盐水,为原电池,负极发生失电子的氧化反应,则负极反应是:Fe﹣2e→Fe2+,故B正确;
C.若铁接电源负极,石墨接电源正极,a是食盐水,左侧石墨电极是阳极,该电极反应为:2Cl﹣﹣2e﹣=Cl2↑,右侧铁电极为阴极,该极上的电极反应为:2H++2e﹣=H2↑,两极上析出的气泡一样多,故C错误;
D.若铁接电源负极,石墨接电源正极,a是氯化铜,铁为阴极,阴极上阳离子得电子,则铁上析出Cu,没有气体生成,故D错误,
故选:B。
12.【分析】根据电池反应式知,负极反应式为LixC6﹣xe﹣=C6+xLi+、正极反应式为Li1﹣xCoO2+xLi++xe﹣=LiCoO2,充电时,阴极、阳极反应式与负极、正极反应式正好相反,根据二次电池的工作原理结合原电池和电解池的工作原理来解答。
【解答】解:A、充电时,Li+嵌入Li1﹣xCoO2中,故A错误;
B、放电时,LiCoO2极发生的电极反应为Li1﹣xCoO2+xLi++xe﹣=LiCoO2,故B错误;
C、放电时负极反应为:LixC6﹣xe﹣=C6+xLi+,故C错误;
D、充电时,阴极电极反应式为:C6+xLi++xe﹣=LixC6,所以若转移1mole﹣,石墨烯电极增重7g,故D正确;
故选:D。
13.【分析】装置Ⅰ为新型电池,放电时B电极的反应式为:NaBr3+2Na++2e﹣=3NaBr,说明为原电池正极反应,放电时为原电池反应:A为负极,电极反应为:2Na2S2﹣2e﹣=2Na++Na2S4,化学反应方程式为2Na2S2+NaBr3Na2S4+3NaBr;
装置Ⅱ为铅蓄电池,a为正极,b为负极,原电池中阴离子移向负极。
【解答】解:A、断开K1、闭合K2时,装置Ⅱ为原电池,b为负极,溶液中中SO42﹣向负极电极迁移,移向b电极,故A错误;
B.若闭合K1、断开K2时,有0.1molNa+通过离子交换膜,说明有0.1mol电子转移,闭合K1、K2时,灯泡和铅蓄电池并联,装置Ⅱ溶液中电子转移小于0.1mol,则b电极上产生Pb的物质的量小于0.05mol,质量小于10.35g,故B错误;
C、断开K1、闭合K2时,装置Ⅱ为原电池反应,b电极为负极,负极的电极反应式为Pb﹣2e﹣+SO42﹣=PbSO4,故C错误;
D.装置Ⅰ为新型电池,放电时的A电极为原电池的负极,电极反应式为:2Na2S2﹣2e﹣═Na2S4+2Na+,电池反应式为 Na2S4+3NaBr═2Na2S2+NaBr3,故D正确;
故选:D。
14.【分析】根据电池反应式知,M为负极,反应式为LixC6﹣xe﹣=6C+xLi+,N为正极,反应式为Li1﹣xFeO4+xLi++xe﹣=LiFePO4,充电时,阴极、阳极反应式与负极、正极反应式正好相反,
A.放电时,阳离子向正极移动,隔膜只允许Li+通过;
B.放电时,M电极上失电子发生氧化反应,N电极上得电子发生还原反应;
C.充电时M为阴极,连接原电池负极,该电极上得电子发生还原反应;
D.充电时,没有Li单质生成。
【解答】解:A.放电时,阳离子向正极移动,隔膜只允许Li+通过,所以Li+从左边移向右边,PO43﹣不发生移动,故A错误;
B.放电时,M电极上失电子发生氧化反应,N电极上得电子发生还原反应,正极反应式为Li1﹣xFePO4+xLi++xe﹣=LiFePO4,故B正确;
C.充电时M为阴极,连接原电池负极,该电极上得电子发生还原反应,电极反应式为6C+xLi++xe﹣=LixC6,故C错误;
D.充电时,没有Li单质生成,故D错误;
故选:B。
15.【分析】由碱性锌锰电池的总反应:Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2,可知电池的负极Zn是电子被氧化,电极反应式为:Zn+2OH﹣﹣2e﹣═Zn(OH)2,正极MnO2得电子被还原生成MnOOH,反应式为2MnO2+2H2O+2e﹣═2MnOOH+2OH﹣,电池工作时,外电路中电子由负极Zn经外电路流向正极MnO2,以此解答。
【解答】解:A.由碱性锌锰电池的总反应:Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2,可知MnO2得电子被还原生成MnOOH,为正极,Zn失去电子,为负极,故A错误;
B.电池工作时,外电路中电子由负极Zn经外电路流向正极MnO2,即电子由负极Zn经外电路流向正极MnO2,故B错误;
C.Zn失去电子生成Zn(OH)2,为负极,电极反应式为Zn﹣2e﹣+2OH﹣=Zn(OH)2,故C正确;
D.电池正极的反应为:2MnO2+2H2O+2e﹣═2MnOOH+2OH﹣,MnO2发生还原反应,即工作时消耗1molMnO2,理论上生成还原产物1mol,故D错误。
故选:C。
二.填空题(共4小题)
16.【分析】(1)阳极上氢氧根离子放电生成氧气;
(2)①根据盖斯定律计算;
②该反应是放热反应,反应物总能量大于生成物总能量,物质越稳定,其能量越小;
(3)①电子从负极沿导线流向正极;
②A电极上甲醇失电子发生氧化反应.
【解答】解:(1)阳极上氢氧根离子放电生成氧气和水,电极反应式为4OH﹣﹣4e﹣═2H2O+O2↑,故答案为:4OH﹣﹣4e﹣═2H2O+O2↑;
(2)①H2(g)+O2(g)═H2O(g)△H1=﹣242kJ/mol①
CH3OH(g)+O2(g)═CO2(g)+2H2O(g)△H2=﹣676kJ/mol②
将方程式3①﹣②得CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=3×(﹣242kJ/mol)﹣(﹣676kJ/mol)=﹣50 kJ/mol,
故答案为:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=﹣50 kJ/mol;
②该反应是放热反应,反应物总能量大于生成物总能量,物质越稳定,其能量越小,所以液态物质的能量小于气态物质,则符合条件的图象是a,故选a;
(3)①该燃料电池中,甲醇失电子发生氧化反应,所以A是负极,B是正极,电子从负极A流向正极B,故答案为:从A到B;
②A电极上甲醇失电子和水反应生成氢离子和二氧化碳,电极反应式为:CH3OH+H2O﹣6e﹣═6H++CO2↑,故答案为:CH3OH+H2O﹣6e﹣═6H++CO2↑.
17.【分析】该装置为原电池原理,锌做负极,锌逐渐溶解,发生氧化反应,铜棒为正极,发生还原反应生成氢气,电流有正极流向负极,阴离子向负极移动,根据电极方程式及得失电子守恒计算,以此解答该题.
【解答】解:该装置为原电池原理,锌做负极,锌逐渐溶解,发生氧化反应,铜棒为正极,发生还原反应生成氢气,电流有正极流向负极,阴离子向负极移动
(1)根据上述分析,Zn为原电池负极,铜为正极,电流由正极流向负极,及由铜极流向锌极,
故答案为:铜极流向锌极;
(2)原电池中阴离子向负极移动,故盐桥中阴离子向硫酸锌溶液中流动,
故答案为:ZnSO4;
(3)锌做负极,锌逐渐溶解,发生氧化反应,铜棒为正极,发生还原反应生成氢气,产生气泡,
故答案为:逐渐溶解;产生气泡;
(4)锌做负极,锌逐渐溶解,发生氧化反应,电极方程式为Zn﹣2e﹣=Zn2+,
故答案为:氧化;Zn﹣2e﹣=Zn2+;
(5)根据电极反应Zn﹣2e﹣=Zn2+,当有2mol电子转移,溶解65g锌,1.3g的Zn为0.02mol,此时转移0.04mol,转移0.24×1023个电子,
故答案为:0.24×1023.
18.【分析】①正极上氧气得到电子和二氧化碳反应生成碳酸根;
②甲醇在负极失电子,b侧通入,电解质中阴离子向负极移动;
③根据甲醇和转移电子之间的关系式计算转移电子的物质的量,再计算质量.
【解答】解:①正极上氧气得到电子和二氧化碳反应生成碳酸根,电极反应为O2+4e﹣+2CO2=2CO32﹣,
故答案为:O2+4e﹣+2CO2=2CO32﹣;
②根据图片知,甲醇在负极失电子,b侧通入,M、N是离子交换膜,只能阴离子通过,碳酸根离子在负极上发生反应,所以碳酸根离子从右向左移动,
故答案为:甲醇;从右到左;
③根据CH3OH﹣6e﹣+3CO32﹣=4CO2+2H2O知,当有3.2g甲醇发生反应时转移电子的物质的量0.6mol,CuSO4只有0.1mol,转移0.2mol电子时已经消耗完毕,析出Cu的质量为6.4g.
故答案为:6.4g.
19.【分析】(1)依据化学方程式分析氨气化合价变化,判断发生氧化反应的物质是氨气,原电池中在负极失电子,正极上氧气得到电子生成氢氧根离子;电解精炼铜时利用了电解原理,电能转化为化学能,也有少量转化为热能.电解精炼时粗铜做阳极,发生氧化反应,精铜做阴极,阴极上发生还原反应.电解时,溶液中的阳离子向阴极移动,在阴极上得电子.粗铜中的不活泼金属不能失电子,以阳极泥的形式沉积在阳极附近.溶液中铜离子浓度减小;
(2)硫酸钡中加入饱和碳酸钠溶液,发生沉淀转化生成碳酸钡沉淀,依据化学反应的离子方程式书写平衡常数,结合钡离子浓度相同得到平衡常数的计算式为溶度积常数比值,代入数值计算.
【解答】解:(1)电池反应为:4NH3+3O2=2N2+6H2O.该电池负极是氨气失电子生成氮气,反应的电极反应式为2NH3+6OH﹣﹣6e﹣=N2+6H2O,电解精炼铜时利用了电解原理,
a、电能转化为化学能,也有少量转化为热能,故a错误;
b、SO42﹣未参加电极反应,而体积不变,所以硫酸根离子的物质的量浓度不变,故b正确;
c、电解时,溶液中的阳离子向阴极移动,在阴极上得电子,溶液中Cu2+向阴极移动,故c错误;
d、粗铜中的不活泼金属不能失电子,以阳极泥的形式沉积在阳极附近,利用阳极泥可回收Ag、Pt、Au等金属,故d正确;
e.若阳极质量减少64g,铝、锌也失电子发生氧化反应,电子转移不是0.2mol,故e错误;
故答案为:2NH3﹣6e﹣+6OH﹣=N2+6H2O;bd;
(2)硫酸钡中加入饱和碳酸钠溶液,发生沉淀转化生成碳酸钡沉淀,反应的离子方程式为:BaSO4(s)+CO32﹣(aq)=BaCO3(s)+SO42﹣(aq),则平衡常数==×===0.04;
故答案为:BaSO4(s)+CO32﹣(aq)=BaCO3(s)+SO42﹣(aq);0.04.
日期:2019/4/29 8:43:10;用户:鑫飞中学;邮箱:xinfeizx@xyh.com;学号:27690441