- 184.00 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
绝密★启用前
人教版·选修 4 第四章 第三节 第 25 课时 电解原理的应用
一、选择题
1.关于电解 NaCl 水溶液,下列叙述正确的是( )
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近的溶液中滴入 KI 溶液,溶液呈黄色
C.若在阴极附近的溶液中滴入酚酞溶液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
2.电浮选凝聚法是工业上采用的一种污水处理方法,如图是电解污水的实验装置
示意图,实验用污水中主要含有可被吸附的悬浮物(不导电)。下列有关推断明显不
合理的是( )
A.阴极的电极反应式为 O2+4e-+2H2O 4OH-
B.通电过程中烧杯内产生可以吸附悬浮物的 Fe(OH)3
C.通电过程中会产生气泡,把悬浮物带到水面形成浮渣弃去
D.如果实验用污水导电性不良,可加入少量 Na2SO4 固体以增强导电性
3.粗铜中除含有铜以外,还含有少量锌、铁、银,在如图所示的装置中,用纯铜
和粗铜分别作为两极进行电解,下列有关叙述中,正确的是( )
A.可检测到电解液中有 Zn2+、Fe2+
B.可检测到电解液中有 Fe3+、Zn2+、Ag+
C.电解过程中,溶液中的铜离子浓度保持不变
D.通电一段时间后,取出两极,称得粗铜极减小的质量等于纯铜极增加的质量
4.欲在金属表面镀银,应把镀件挂在电镀池的阴极。下列各组中,选用的阳极金
属和电镀液均正确的是( )
A.Ag 和 AgCl 溶液 B.Ag 和 AgNO3 溶液
C.Pt 和 Ag2CO3 溶液 D.Pt 和 Ag2SO4 溶液
5.用惰性电极电解 AgNO3 溶液,下列说法不正确的是( )
A.电解过程中阴极质量不断增加
B.电解过程中溶液的 pH 不断降低
C.此时向溶液中加入适量的 Ag2O 固体可使溶液恢复到电解前的状况
D.电解后两极产生的气体体积比为 2∶1
6.用石墨作电极电解 CuCl2 和 KCl 的混合溶液,电解初期阴极和阳极分别析出的
物质是( )
A.H2、Cl2 B.Cu、Cl2
C.H2、O2 D.Cu、O2
7.取一张用饱和的 NaCl 溶液浸湿的 pH 试纸,两根铅笔芯作电极,接通直流电源,
一段时间后,发现 a 电极与试纸接触处出现一个双色同心圆,内圆为白色,外圆
呈浅红色。下列说法错误的是( )
A.b 电极是阴极
B.a 电极与电源的正极相连
C.电解过程中水是氧化剂
D.b 电极附近溶液的 pH 变小
8.某工厂以碳棒为阳极材料电解熔于熔融冰晶石(NaAlF6)中的 Al2O3,每产生 1 mol
Al,同时消耗 1 mol 阳极材料碳,则阳极收集得到的气体为( )
A.CO 与 CO2 物质的量之比为 1∶2
B.CO 与 CO2 物质的量之比为 1∶1
C.CO2 与 O2 物质的量之比为 2∶1
D.F2 与 O2 物质的量之比为 1∶1
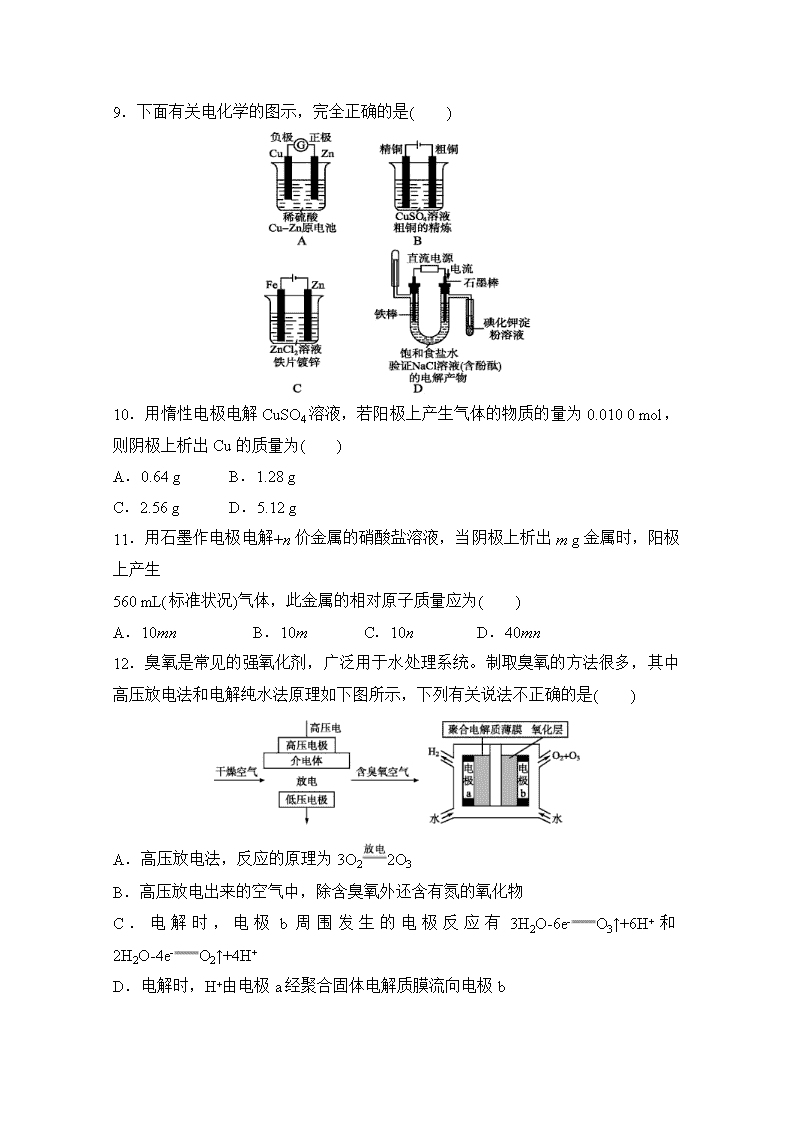
9.下面有关电化学的图示,完全正确的是( )
10.用惰性电极电解 CuSO4 溶液,若阳极上产生气体的物质的量为 0.010 0 mol,
则阴极上析出 Cu 的质量为( )
A.0.64 g B.1.28 g
C.2.56 g D.5.12 g
11.用石墨作电极电解+n 价金属的硝酸盐溶液,当阴极上析出 m g 金属时,阳极
上产生
560 mL(标准状况)气体,此金属的相对原子质量应为( )
A.10mn B.10m C.10n D.40mn
12.臭氧是常见的强氧化剂,广泛用于水处理系统。制取臭氧的方法很多,其中
高压放电法和电解纯水法原理如下图所示,下列有关说法不正确的是( )
A.高压放电法,反应的原理为 3O2 2O3
B.高压放电出来的空气中,除含臭氧外还含有氮的氧化物
C.电解时,电极 b 周围发生的电极反应有 3H2O-6e- O3↑+6H+和 2H2O-4e-
O2↑+4H+
D.电解时,H+由电极 a 经聚合固体电解质膜流向电极 b
二、非选择题
13.如图Ⅰ所示是用石墨和铁作电极电解饱和食盐水的装置,请填空:
(1)X 的电极名称是__________极,发生的电极反应式为______________,Y 极的
电 极 材 料 是 ____________ , 检 验 X 极 产 物 的 方 法 是
________________________________。
(2)某同学在实验时误将两种电极材料接反,导致 X 极上未收集到预期产物,一段
时间后又将两极的连接方式纠正过来,发现 X 极附近出现了白色沉淀,此沉淀是
________(填化学式),其形成原因是
________________________________________________________ __
______________________________________________________________________
_ ,
该沉淀在空气中放置,现象是______________________。
(3)
工业上电解饱和食盐水的方法之一是将两个电极室用离子交换膜隔开(如图Ⅱ所
示),其目的是________________,阳极室(A 处)加入____________,阴极室(B 处)
加入__________,离子交换膜只许__________离子通过。
14.工业上处理含 Cr2O72-的酸性工业废水常用以下方法:
①往工业废水里加入适量的 NaCl,搅拌均匀;②用 Fe 为电极进行电解,经过一段
时间有 Cr(OH)3 和 Fe(OH)3 沉淀产生;③过滤回收沉淀,废水达到排放标准。试回
答:
(1) 电 解 时 的 电 极 反 应 : 阳 极 _______________________ , 阴 极
______________________;
(2)Cr2O72 - 转 变 成 Cr3 + 的 离 子 反 应 方 程 式 :
__________________________________________;
(3)电解过程中 Cr(OH)3、Fe(OH)3 沉淀是怎样产生的?
_______________________________________________________ ;
(4) 能 否 用 Cu 电 极 来 代 替 Fe 电 极 ? ________( 填 “ 能 ” 或 “ 不 能 ”) , 理 由 是
__________________________________________。
15.按照下图接通线路,反应一段时间后,回答下列问题(假设所提供的电能可以
保证电解反应的顺利进行):
(1)U 形 管 内 可 观 察 到 ________ , 写 出 有 关 反 应 的 化 学 方 程 式
__________________________________________________________。
(2)在小烧杯 a、b 中分别产生什么现象?
_____________________________________________________ 。
(3)如果小烧杯中有 0.508 g 碘析出,那么烧杯 c 中负极的质量减轻________g。
16.蓄电池是一种可以反复充电、放电的装置,有一种蓄电池在充电和放电时发
生的反应是 NiO2+Fe+2H2O Fe(OH)2+Ni(OH)2,用该蓄电池电解(阴、
阳极均为惰性电极)M(NO3)x 溶液时,若此蓄电池工作一段时间后消耗 0.36 g 水。
(1)电解时,电解池的阳极应连接________(填序号)。
A.NiO2 B.Fe
C.Fe(OH)2 D.Ni(OH)2
(2)电解 M(NO3)x 溶液时某一极质量增加了 m g,金属 M 的相对原子质量的计算式
放电
充电
为________(用 m、x 表示)。
(3)此蓄电池电解含有 0.01 mol CuSO4 和 0.01 mol NaCl 的混合溶液 100 mL,转移
相同量的电子时,阳极产生气体________L(标准状况),电解后溶液加水稀释至 1
L,溶液的 pH 为________。
17.右图由莫菲滴管改装成的微型电解装置。
(1)若用该装置来电解含 3 mol NaCl 和 1 mol H2SO4 的混合溶液,已知 a、b 两极均
为石墨。当从导管口收集到 44.8 L(标准状况下)氢气时,阳极生成的气体及对应的
物质的量________。
(2)若 b 极是铜锌合金,a 极是纯铜,电解质溶液中含有足量的 Cu2+,通电一段时
间后,若 b 极恰好全部溶解,此时 a 极质量增加 7.68 g,溶液质量增加 0.03 g,则
合金中 Cu、Zn 的物质的量之比为________。
人教版·选修 4 第四章 第三节 第 25 课时 电解原理的应用
参考答案与解析
一、选择题
1.
【答案】B
【解析】用石墨作电极电解饱和氯化钠溶液,发生的反应是 2NaCl+2H2O
2NaOH+H2↑+Cl2↑,故电解一段时间后电解液呈碱性,A、D 项错误;电解时,阳
极发生氧化反应:2Cl--2e- Cl2↑,在阳极附近的溶液中滴入 KI 溶液时,发生反
应 2I-+Cl2 2Cl-+I2,故溶液呈黄色,B 项正确;阴极发生还原反应:2H++2e-
H2↑,因而阴极附近的溶液呈碱性,滴入酚酞溶液变红,C 项错误。
【题型】选择题
【难度】容易
2.
【答案】A
【解析】A 项中是阴极 H2O 电离出的 H+得电子,电极反应式为 2H2O+2e-
2OH-+H2↑。
【题型】选择题
【难度】容易
3.
【答案】A
【解析】粗铜上发生反应:Zn-2e-===Zn2+,Fe-2e-===Fe2+,Cu-2e-===Cu2
+;银以单质形式沉积于阳极底部形成阳极泥,纯铜上发生反应:Cu2- +2e -
===Cu,结合电子守恒可知,溶液中的铜离子浓度略有减小,粗铜极减小的质量不
等于纯铜极增加的质量。
【题型】选择题
【难度】容易
4.
【答案】B
【解析】电镀槽中,要求镀件作阴极,可用镀层金属作阳极,利用其阳极溶解提
供镀层金属,也可用惰性电极材料作阳极,镀层金属则由电镀液提供;电镀液通
常采用含有镀层金属离子的盐溶液,由于 A、C、D 中 AgCl、Ag 2CO3 和 Ag2SO4
均为沉淀,只有 B 符合要求。
【题型】选择题
【难度】容易
5.
【答案】D
【解析】解决有关电解问题首先应注意电极材料,在此基础上写出电极反应和总
的电解反应式,根据总的电解反应式来分析电解前后的物质变化和溶液浓度变化,
分析溶液的 pH 变化必须注意原溶液的 pH 情况。用惰性电极电解 AgNO3 溶液,总
的电极反应式为 4AgNO3+2H2O 4Ag+O2↑+4HNO3。可知:阴极上析出
Ag,阳极上放出 O2,故 A 项正确、D 项错误;由于生成 HNO3 溶液,pH 应不断
降低,B 项正确;要使溶液恢复电解前的状况,要看加入的物质在溶液中的反应:
2Ag2O+4HNO3===4AgNO3+2H2O;得到的物质恰好是反应掉的物质,可以使溶
液恢复电解前的状况,C 项正确。
【题型】选择题
【难度】容易
6.
【答案】B
【解析】本题考查离子放电顺序,溶液中的离子有 Cu2+、K+、H+及 Cl-、OH-
五种离子,得电子能力 Cu2+>H+>K+,失电子能力:Cl->OH-,所以电解初期:
阴极:Cu2++2e-===Cu,阳极:2Cl--2e-===Cl2↑,故选 B。
【题型】选择题
【难度】容易
7.
【答案】D
【解析】a 电极与试纸接触处出现一个双色同心圆,内圆为白色,外圆呈浅红色,
说明外圈有酸性物质产生根据题意可知:a 极附近产生了 Cl2,所以 a 极与电源的
正极相连,即 a 为阳极,电极反应式为 2Cl--2e- Cl2↑,b 为阴极,电极反应式为
2H2O-4e- H2↑+2OH-,所以 b 极附近的 pH 增大。答案选 D。
【题型】选择题
【难度】一般
8.
【答案】B
【解析】根据电解 Al2O3,每产生 1 mol Al,同时产生 1.5 mol O;再根据 C 守恒和
O 守恒列式可解出 CO 和 CO2 物质的量。答案选 B。
【题型】选择题
【难度】一般
9.
【答案】D
【解析】铜锌原电池中锌作负极,铜作正极,A 项错误;粗铜精炼时,精铜作阴
极,粗铜作阳极,B 项错误;铁片镀锌时,铁作阴极,锌作阳极,C 项错误;NaCl
的电解产物是 Cl2、NaOH、H2NaOH 用酚酞可以验证,Cl2 能使 KI 的淀粉溶液变
蓝,H2 用向下排空气法收集后点燃可以验证,D 项正确。
【题型】选择题
【难度】一般
10.
【答案】B
【解析】用惰性电极电解 CuSO4 溶液,在阳极产生的气体为 O2,由 4OH--4e-
2H2O+O2↑知,产生 0.010 0 mol 的 O2 转移 0.040 0 mol 电子,则根据 Cu2++2e- Cu
可推出应析出
0.020 0 mol 的铜,其质量为 1.28 g。
【题型】选择题
【难度】一般
11.
【答案】A
【解析】阳极反应:4OH--4e- O2↑+2H2O,当生成 560 mL O2 时转移 0.1 mol 电
子,阴极为 Mn+得电子,即 Mn++ne- M,根据反应中转移 0.1 mol 电子和生成 m g
金属,解得 Mr(M)=10mn。
【题型】选择题
【难度】一般
12.
【答案】D
【解析】高压放电法与闪电条件下氧气部分转化为臭氧类似,其反应的原理为:3O2
2O3,因空气中还含有氮气,放电条件下,氮气也能与氧气反应,故有氮氧化
物生成,A、B 两项均正确;观察题图电解法制臭氧,可发现有氢气放出,必由水
还原生成,发生还原反应,故 a 为阴极;同理,由水生成氧气和臭氧,发生氧化
反应,C 项正确;因 b 为阳极,电解质中的阳离子移向阴极,故 D 项错误。
【题型】选择题
【难度】较难
二、非选择题
13.
【答案】(1)阳 2Cl--2e-===Cl2↑ Fe 用湿润的淀粉碘化钾试纸放在 X 极
附近,若试纸变蓝,说明生成了 Cl2
(2)Fe(OH)2 铁作阳极时被氧化为 Fe2+,纠正错误后,这一端又变为阴极,2H++
2e-===H2↑,生成的 OH-与 Fe2+结合成 Fe(OH)2 先变灰绿色,后变红褐色
(3)防止 H2 与 Cl2 混合发生爆炸,防止 Cl2 与 NaOH 反应生成 NaClO,使 NaOH 不
纯 饱和食盐水 纯水(或 NaOH 稀溶液) 阳离子
【解析】与电源正极相接的为电解池的阳极,与电源负极相接的为电解池的阴极,
若接反则金属 Fe 失去电子而产生 Fe(OH)2 沉淀。
【题型】填空题
【难度】一般
14.
【答案】(1)Fe-2e-===Fe2+ 2H++2e-===H2↑
(2)6Fe2++Cr2O72-+14H+===6Fe3++2Cr3++7H2O
(3)在阴极反应及 Cr2O72-与 Fe2+反应过程中,将消耗大量的 H+,使溶液 pH 上升,
促使
Fe3+、Cr3+水解并最终转化为 Fe(OH)3、Cr(OH)3 沉淀
(4)不能 因为阴极产生的 Cu2+,不能使 Cr2O72-还原
【解析】首先应考虑溶液中阴阳离子在外电场作用下的定向迁移;然后再考虑阴
阳两极按放电顺序可能发生的电极反应。阴极:2H++2e-===H2↑,阳极:Fe-2e
-===Fe2+,产生的 Fe2+在向阴极迁移的过程中与向阳极移动的 Cr2O72-相遇,发
生氧化还原反应:6Fe2++Cr2O72-+14H+===6Fe3++2Cr3++7H2O,使 Cr2O72-转
化为 Cr3+,同时 Fe2+也转化为 Fe3+。在以上电解的阴极反应及 Fe2+与 Cr2O72-的
氧化还原反应中都消耗了大量的 H+,溶液的 pH 不断变大,有利于 Fe3+、Cr3+生
成相应的 Fe(OH)3、Cr(OH)3 沉淀。若将 Fe 电极改成为 Cu 电极,由于产生的 Cu2+
不具有还原性,不能将 Cr2O72-转化为毒性较低的 Cr3+,显然是不行的。
【题型】填空题
【难度】一般
15.
【答案】(1)两极上均有气泡产生,U 形管右边酚酞溶液变红 2KCl+2H2O
2KOH+H2↑+Cl2↑
(2)a 烧杯中溶液变为蓝色,b 烧杯中有无色气泡产生
(3)0.13
【解析】图中左图是原电池,锌为负极,铂为正极,所以 U 形管的左边电极为电
解池的阳极,右边电极为阴极,电解 KCl 溶液:2KCl+2H2O 2KOH+H2↑+
Cl2↑,左边产生氯气,使淀粉 KI 溶液变蓝,U 形管右边酚酞溶液变红,0.508 g 碘
的物质的量为 0.002 mol,所以烧杯中减少的锌的物质的量为 0.002 mol,质量为
0.13 g。
【题型】填空题
【难度】一般
16.
【答案】(1)A
(2)50mx
(3)0.168 2
放电
充电
【解析】(1)电解池的阳极应连原电池的正极,故连 NiO2。
(2)根据蓄电池的反应方程式可知:蓄电池工作时,消耗 0.36 g 水,通过 0.02 mol
电子,由电子守恒知 =0.02,M=50mx。
(3)通过电子 0.02 mol,首先产生 0.005 mol Cl2,转移电子的物质的量为 0.01 mol,
然后发生 4OH--4e-===2H2O+O2↑,产生 O2 为: =0.0025 mol,
V 气=(0.002 5 mol+0.005 mol)×22.4 L/mol=0.168 L。产生 n(H+)=0.0025 mol×4=
0.01 mol,c(H+)=0.01 mol/L,pH=2。
【题型】填空题
【难度】一般
17.
【答案】(1)1.5 mol Cl2,0.25 mol O2
(2)3∶1
【解析】(1)生成 44.8 L H2,转移 4 mol 电子,则阳极将生成 1.5 mol Cl2 和 0.25 mol
O2。
(2)a 极增加 7.68 g Cu,其物质的量为 0.12 mol,由得失电子守恒可知,b 极 Cu、Zn
的物质的量之和为 0.12 mol,溶液中部分 Cu2+变成 Zn2+,即:
Cu2+ ~ Zn2+ Δm
64 g 65 g 1 g
溶液质量增加 0.03 g,可知 Zn 的物质的量为 0.03 mol,所以 Cu、Zn 的物质的量
之比为 0.09∶0.03,即 3∶1。
【题型】填空题
【难度】较难
mx
M
0.02mol 0.01mol
4
−