- 158.57 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第2课时 过滤和蒸发
课后篇巩固提升
基础巩固
1.在生活、工农业生产中都会用到物质分离的方法,下列分离方法与过滤原理相同的是( )
A.含有泥沙的浑水,静置一会儿水沙分离,可取得上层的清水
B.农村“扬谷”分离饱满的谷粒和干瘪的谷壳
C.建筑工地上用铁筛把大小不同的沙粒分开
D.淘米除去米中混有的小沙粒
解析过滤是根据微粒大小不同进行物质分离的方法,只有C项符合,A、B、D项是根据密度大小不同分离的。
答案C
2.在粗盐的提纯实验中,下列说法正确的是( )
A.该实验得到的NaCl中无其他任何杂质
B.检验所得NaCl中是否混有BaCl2,可用AgNO3溶液
C.该实验分为溶解、过滤和蒸发三个步骤
D.除去杂质时,不必考虑所加试剂的顺序
解析该实验得到的NaCl中可能仍混有其他可溶性杂质,故A项错误;AgNO3溶液遇NaCl或BaCl2均产生白色沉淀,因此B项错误;除去杂质时,要考虑所加试剂的顺序,前面所加的试剂过量时,后面的步骤中必须能够除去,因此D项错误。
答案C
3.下列物质分离和提纯的方法属于化学分离提纯法的是( )
A.分离沙子和食盐水溶液
B.分离溶于水中的氯化钠
C.从氯化钠和硝酸钾的混合物中提纯硝酸钾
D.将O2和CO2的混合气体通入NaOH溶液中除去CO2
解析物理分离提纯法有过滤、结晶、蒸发、蒸馏、萃取、分液等,化学分离提纯法有沉淀、置换、加热、分解、洗气等。A项可用过滤法,B项可用蒸发法,C项可用结晶法,D项利用的是洗气法。
答案D
4.下列实验操作中一定要用到玻璃棒的是( )
①过滤 ②蒸发 ③溶解 ④取液体试剂 ⑤取固体试剂
A.①②③ B.④⑤ C.①④ D.①③⑤
解析过滤时要用玻璃棒引流;蒸发时要用玻璃棒不断搅拌溶液,防止液体受热飞溅;溶解时用玻璃棒不断搅拌促进物质的溶解;取液体试剂可用胶头滴管;取固体试剂可用药匙、纸槽或镊子。
答案A
5.可以用水、烧杯、玻璃棒、过滤器等在常温或加热下分离的物质是( )
A.CaO、CaCO3 B.BaSO4、NaCl
C.Fe、AgCl D.NH4NO3、K2SO4
解析CaO与水反应,Fe与AgCl都不溶于水,NH4NO3、K2SO4都易溶于水。
答案B
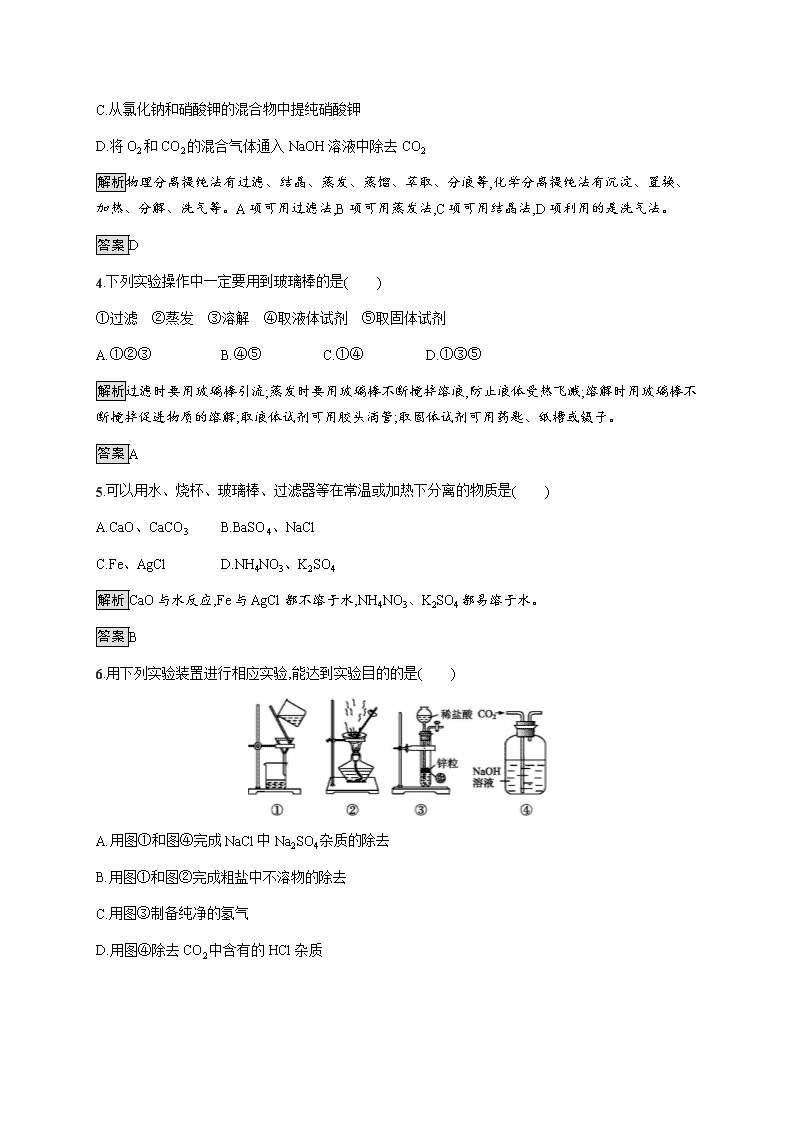
6.用下列实验装置进行相应实验,能达到实验目的的是( )
A.用图①和图④完成NaCl中Na2SO4杂质的除去
B.用图①和图②完成粗盐中不溶物的除去
C.用图③制备纯净的氢气
D.用图④除去CO2中含有的HCl杂质
解析除去NaCl中的Na2SO4杂质的第一步是加BaCl2溶液,该反应是在试管或烧杯中完成的,A项错误;粗盐中不溶物的除去过程是溶解→过滤(除杂质)→蒸发结晶,B项正确;用图③所示装置制备的氢气中含有HCl杂质,C项错误;CO2和HCl均能与NaOH溶液反应,D项错误。
答案B
7.关于粗盐提纯的下列说法中正确的是( )
A.溶解粗盐时,应尽量让溶液稀些,防止食盐不完全溶解
B.滤去不溶性杂质后,将滤液移至坩埚内加热浓缩
C.当蒸发到蒸发皿中出现较多固体时,应停止加热,利用余热将液体蒸干
D.将制得晶体转移到新制的过滤器中用大量水进行洗涤
解析氯化钠易溶于水,不需要用大量水进行溶解和洗涤,A、D项错误;滤液应转移至蒸发皿中加热蒸发,B项错误。
答案C
8.实验室制取氧气的反应为2KClO32KCl+3O2↑,反应后从剩余物中回收纯净的二氧化锰的操作顺序正确的是(已知MnO2为黑色、难溶于水的固体)( )
A.溶解、过滤、蒸发、洗涤
B.溶解、过滤、洗涤、干燥
C.溶解、蒸发、洗涤、过滤
D.溶解、洗涤、过滤、加热
解析实验室制取O2,反应后固体剩余物为KCl(易溶于水)和MnO2(难溶于水),因此可将混合物溶于水并过滤即可分离二者。而要求回收纯净的MnO2,所以对MnO2还需洗涤、干燥,故选B项。
答案B
9.提纯含有少量硝酸钡杂质的硝酸钾溶液,设计实验方案为溶液 KNO3溶液
则X为( )
A.Na2CO3 B.K2CO3 C.Na2SO4 D.K2SO4
解析除去硝酸钾溶液中的Ba(NO3)2应用碳酸盐而不可选用硫酸盐,因为碳酸盐过量才能保证Ba(NO3)2被除净,同时过量的碳酸盐还能用适量硝酸除去;而硫酸盐虽能保证Ba(NO3)2被除净,但过量的硫酸盐无法用硝酸除去;由于是提纯钾盐溶液,故不能用Na2CO3。
答案B
10.为除去某物质中所含的杂质,所选用的试剂或操作方法正确的是( )
序号
物质
杂质
除杂试剂或操作方法
①
NaCl溶液
Na2CO3
加入盐酸,蒸发
②
FeSO4溶液
CuSO4
加入过量铁粉并过滤
③
H2
CO2
依次通过盛有NaOH溶液和浓硫酸的洗气瓶
④
NaNO3
Na2CO3
加稀硫酸溶解、过滤、蒸发、结晶
A.①②③ B.②③④ C.①③④ D.①②④
解析NaNO3中的Na2CO3与稀硫酸反应生成CO2气体和H2O,同时生成了新的杂质Na2SO4,④错误。
答案A
11.除去下列物质中混有的少量杂质(杂质不要求回收),把适当的试剂、操作方法的序号写在相应的括号内。
a.加适量盐酸、过滤 b.加适量水、过滤、蒸发
c.加适量水、过滤、干燥 d.加热(高温或灼烧) e.加适量盐酸、蒸发 f.冷却热的饱和溶液、过滤
(1)碳酸钙中混有少量的碳酸钠( )
(2)氯化钾粉末中混有碳酸钾( )
(3)氧化钙中混有少量的碳酸钙( )
(4)二氧化锰中混有少量的炭粉( )
(5)硝酸钾中混有少量的食盐( )
解析(1)中利用CaCO3不溶于水,Na2CO3易溶于水,加适量水、过滤、干燥即可除杂。
(2)中KCl和K2CO3均易溶于水,故不能用过滤法分离;可加适量盐酸,完全反应后,再将溶液蒸发即得到氯化钾晶体。
(3)中利用高温分解法,使CaCO3分解除去并生成CaO。
(4)中二者均不溶于水,可利用炭粉易燃的方法,使炭粉与氧气反应生成CO2,从而与MnO2分离,选用d。
(5)中利用二者溶解度随温度变化的差异,采用结晶法分离除杂。
答案(1)c (2)e (3)d (4)d (5)f
12.根据图中所示的溶解度曲线,回答下列问题。
(1)氯化钠和Na2CO3晶体均属于 (填“易溶”“可溶”“微溶”或“难溶”)物质。
(2)我国某些盐湖里出产天然碱(主要成分为Na2CO3晶体,并含少量氯化钠杂质),在实验室里从天然碱中分离出较纯的Na2CO3晶体,应采用 的方法(杂质仅考虑氯化钠)。具体的实验操作步骤:①加热溶解,② ,③ ,④洗涤晾干。
(3)完成上述操作①~③必备的实验仪器有铁架台(附铁圈、石棉网等)、烧杯、玻璃棒和 、 等。
答案(1)易溶 (2)冷却热饱和溶液(或降温结晶) 降温结晶 过滤 (3)漏斗 酒精灯
能力提升
1.某溶液中含有较大量的Cl-、C、OH-三种阴离子,如果只取一次该溶液就能够分别将三种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加足量的Mg(NO3)2溶液 ②过滤 ③滴加适量的AgNO3溶液 ④滴加足量的Ba(NO3)2溶液
A.①②④②③ B.④②①②③
C.①②③②④ D.④②③②①
解析首先滴加足量的Ba(NO3)2溶液,如果出现白色沉淀,证明有C,同时除去C;过滤后,在滤液中滴加足量的Mg(NO3)2溶液,如果出现白色沉淀,证明有OH-,同时除去OH-;过滤后,滴加适量的AgNO3溶液,如果出现白色沉淀,证明有Cl-。
答案B
2.氯碱厂的原料工业食盐因含CaCl2、MgCl2等杂质,使用前必须精制,回答下列有关问题:
(1)精制过程中发生反应的化学方程式为(假设先除Mg2+,再除Ca2+) 。
(2)如果粗盐中S含量较高,必须添加含钡试剂除去S,该含钡试剂可以是 (填字母代号)。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(3)为有效除去CaCl2、MgCl2以及S,加入的试剂及合理的顺序为 (填字母代号)。
A.先加过量NaOH溶液,后加过量Na2CO3溶液,再加过量含钡试剂,过滤后加入稍过量的稀盐酸
B.先加过量NaOH溶液,后加过量BaCl2溶液,再加过量Na2CO3溶液,过滤后加入稍过量的稀盐酸
C.先加过量NaOH溶液,后加过量BaCl2溶液,再加过量Na2CO3溶液,过滤后加入稍过量的稀硝酸
解析除去食盐中的CaCl2、MgCl2等杂质,可根据物质的溶解度,把CaCl2、MgCl2分别转化为CaCO3、Mg(OH)2沉淀再除去;在除杂时不能引入新的杂质,并且尽量减少操作步骤,使用的药品要少而精。
答案(1)MgCl2+2NaOHMg(OH)2↓+2NaCl,CaCl2+Na2CO3CaCO3↓+2NaCl,NaOH+HClNaCl+H2O,Na2CO3+2HCl2NaCl+H2O+CO2↑
(2)AC (3)B
3.工业上用电解法生产烧碱的主要原料是饱和食盐水,饱和食盐水是将粗盐溶解在水中,通过分离和提纯制成的。由于粗盐中含有泥沙、CaCl2、MgCl2、Fe2(SO4)3等杂质,不符合电解的要求,因此必须进行精制。首先将粗盐水过滤除去泥沙,再用化学试剂进一步净化处理。
(1)如何运用最简方法检验过滤后的溶液中有无S? 。
(2)净化过程中下列化学药品中可以选用的是 (填写代号)。
A.Ba(NO3)2溶液 B.BaCl2溶液 C.NaOH溶液
D.K2CO3溶液 E.Na2CO3溶液 F.稀盐酸 G.稀硫酸
(3)你设计加入化学试剂的先后顺序是 。在加入某种化学试剂之前,还必须增加一种物理除杂方法,这种化学试剂的名称是 ,这种物理除杂方法的名称是 。要在实验室中实施这种除杂方法,所用到的玻璃仪器有 。
(4)经过科学论证,上述净化食盐水的方案合理,又通过更加精确的实验方法对净化后的食盐水进行成分分析,发现其中CaCl2、MgCl2的含量还是超标,必须进一步降低其含量。对此,下列说法中正确的是 。
A.对盐水进行过滤
B.再从上述(2)中选取化学试剂除杂
C.查找资料或访问专家,采用更加先进科学的方法除杂
解析(1)检验S是否存在,可取适量溶液置于试管中,向其中先加入稀盐酸,再加入BaCl2溶液,若产生白色沉淀即证明含有S。
(2)除去MgCl2、Fe2(SO4)3应选用NaOH溶液和BaCl2溶液,不能选用Ba(NO3)2溶液,否则会引入N;除去CaCl2和过量的BaCl2应选用Na2CO3溶液,不能选用K2CO3溶液,否则引入K+;除去过量的NaOH、Na2CO3用稀盐酸不能选用硫酸,否则会引入S;故选用的试剂为BCEF。
(3)用Na2CO3溶液除去CaCl2和过量的BaCl2,故Na2CO3溶液在BaCl2溶液后加入,用稀盐酸除去过量的NaOH、Na2CO3,故稀盐酸最后加入,则试剂加入顺序为BECF或CBEF或BCEF。在加入稀盐酸前需将产生的沉淀过滤,否则沉淀会再次溶解。
(4)因为题中净化食盐水的方案合理,但杂质含量还是超标,只能采用更加先进科学的方法除杂。
答案(1)取适量溶液于试管中,向其中先加入稀盐酸,无沉淀产生,再加入BaCl2溶液,若产生白色沉淀即证明含有S (2)BCEF
(3)BECF或CBEF或BCEF 稀盐酸 过滤 烧杯、玻璃棒、漏斗 (4)C
4.现有NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、S和N的相互分离,实验过程如下:
请回答下列问题:
(1)写出上述实验过程中所用试剂的名称:试剂1为 ,试剂2为 ,试剂4为 。
(2)加入过量试剂3的目的是 。
(3)在加入试剂4后,获得晶体D的实验操作④的名称是 。
解析首先根据阴离子确定沉淀某种阴离子所选用的阳离子,再根据题目要求,确定所选阳离子所对应的化合物,最后确定试剂加入的先后顺序。沉淀S选用Ba2+,沉淀Cl-用Ag+。由于Ag+与Cl-、S都可生成沉淀,所以应先用过量BaCl2或Ba(NO3)2溶液来沉淀S,所以试剂1为BaCl2溶液或Ba(NO3)2溶液;试剂2则为沉淀Cl-所用的AgNO3溶液;因加入的Ag+是过量的,所以应用过量试剂3即过量Na2CO3溶液来沉淀过量的Ba2+和Ag+;而过量的C则用适量试剂4(稀硝酸)来除去。
答案(1)BaCl2溶液或Ba(NO3)2溶液 AgNO3溶液 稀硝酸
(2)除去过量的Ba2+和Ag+
(3)蒸发、冷却、结晶、过滤
5.纯碱是重要的化工原料,在医药、冶金、化工、食品等领域被广泛使用。
某实验小组的同学模拟侯德榜制碱法制取纯碱,流程如下:
(1)工业生产纯碱的第一步是除去饱和食盐水中的S、Ca2+,依次加入的试剂是 、 、(过滤)、 。
(2)已知几种盐的溶解度如下表:
NaCl
NH4HCO3
NaHCO3
NH4Cl
溶解度(20 ℃时,100 g H2O中)/g
36.0
21.7
9.6
37.2
①写出装置Ⅰ中反应的化学方程式: 。
②写出装置Ⅱ中发生反应的化学方程式: 。
(3)该流程中可循环利用的物质是 。
(4)制备的纯碱中含有杂质只有NaCl。
①检验用该纯碱配制的溶液中含有Cl-的方法是 。
②测定该纯碱的纯度,下列方案可行的是 (填字母)。
a.向m g纯碱样品配成的溶液中加入足量CaCl2溶液,沉淀经过滤、洗涤、干燥,称其质量为b g
b.向m g纯碱样品中加入足量稀盐酸,用碱石灰(主要成分是CaO和NaOH)吸收产生的气体,碱石灰增重b g
c.向m g纯碱样品配成的溶液中加入足量AgNO3溶液,产生的沉淀经过滤、洗涤、干燥,称其质量为b g
解析侯德榜制碱法制取纯碱的相关化学方程式为NaCl+NH3+CO2+H2ONaHCO3↓+NH4Cl,2NaHCO3Na2CO3+H2O+CO2↑。
(1)除去饱和食盐水中的S、Ca2+可依次加入过量的BaCl2溶液和过量的Na2CO3溶液,过滤除去BaSO4、CaCO3、BaCO3,因Na2CO3溶液过量,可向滤液中加入适量稀盐酸将Na2CO3转化为NaCl。
(2)①装置Ⅰ中反应为制备NaHCO3的反应,其化学方程式为NaCl+NH3+CO2+H2ONaHCO3↓+NH4Cl;②装置Ⅱ中NaHCO3在加热条件下发生分解反应,化学方程式为2NaHCO3Na2CO3+H2O+CO2↑;
(3)由流程图可知,该流程中可循环利用的物质是CO2。
(4)①检验Na2CO3溶液中的Cl-选用硝酸酸化后再加AgNO3溶液,其操作为:取少量纯碱样品溶液,加入足量的稀硝酸,再加入硝酸银溶液,若生成白色沉淀,则说明其中含有Cl-。②a项,向m g纯碱样品配成的溶液中加入足量CaCl2溶液,Na2CO3与CaCl2反应生成CaCO3沉淀,沉淀经过滤、洗涤、干燥,称其质量为b g,可计算出纯碱的纯度为×100%=×100%,正确;b项,向m g纯碱样品中加入足量稀盐酸,Na2CO3和NaHCO3与过量的稀盐酸反应均能产生CO2气体,且气体中会混有挥发出的HCl和水蒸气,用碱石灰(主要成分是CaO和NaOH)吸收产生的气体,碱石灰增重b g,无法确定NaHCO3或Na2CO3的质量,故无法计算纯碱的纯度,错误;c项,向m g纯碱样品配成的溶液中加入足量AgNO3溶液,Na2CO3与AgNO3反应生成Ag2CO3沉淀,产生的沉淀经过滤、洗涤、干燥,称其质量为b g,可计算出纯碱的纯度为×100%=×100%,正确。
答案(1)足量BaCl2溶液 足量Na2CO3溶液 适量稀盐酸
(2)①NaCl+CO2+NH3+H2ONaHCO3↓+NH4Cl ②2NaHCO3Na2CO3+H2O+CO2↑
(3)CO2 (4)①取少量纯碱样品溶液,加入足量的稀硝酸,再加入硝酸银溶液,若生成白色沉淀,则说明其中含有氯离子 ②ac