- 3.43 MB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第
2
讲 物质结构与性质
(
选修
)
-
2
-
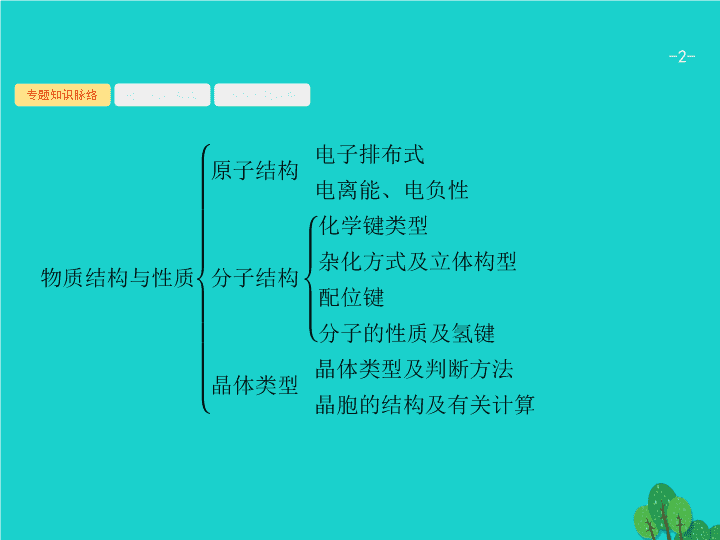
专题知识脉络
能力目标解读
热点考题诠释
-
3
-
专题知识脉络
能力目标解读
热点考题诠释
-
4
-
专题知识脉络
能力目标解读
热点考题诠释
-
5
-
专题知识脉络
能力目标解读
热点考题诠释
-
6
-
专题知识脉络
能力目标解读
热点考题诠释
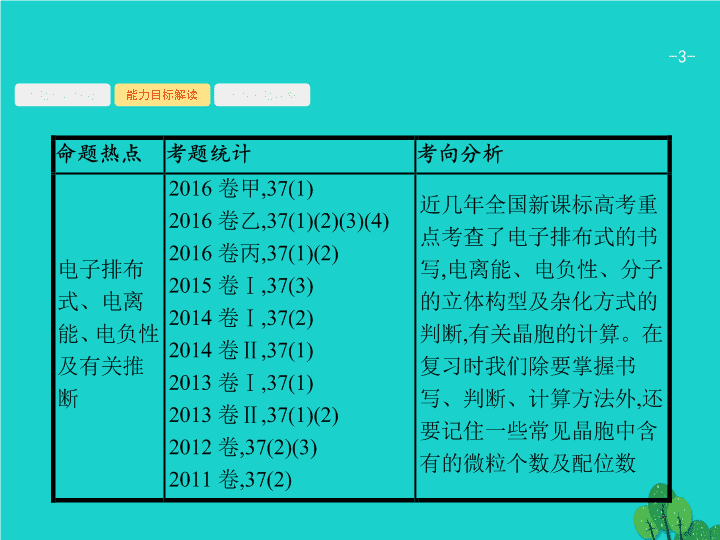
1
2
1
.(2016
全国甲
)
东晋《华阳国志
·
南中志》卷四中已有关于白铜的记载
,
云南镍白铜
(
铜镍合金
)
闻名中外
,
曾主要用于造币
,
亦可用于制作仿银饰品。回答下列问题
:
(1)
镍元素基态原子的电子排布式为
,3d
能级上的未成对电子数为
。
(2)
硫酸镍溶于氨水形成
[Ni(NH
3
)
6
]SO
4
蓝色溶液。
①
[Ni(NH
3
)
6
]SO
4
中阴离子的立体构型是
。
②
在
[Ni(NH
3
)
6
]
2+
中
Ni
2+
与
NH
3
之间形成的化学键称为
,
提供孤电子对的成键原子是
。
③
氨的沸点
(
填
“
高于
”
或
“
低于
”)
膦
(PH
3
),
原因是
;
氨是
分子
(
填
“
极性
”
或
“
非极性
”),
中心原子的轨道杂化类型为
。
-
7
-
专题知识脉络
能力目标解读
热点考题诠释
1
2
-
8
-
专题知识脉络
能力目标解读
热点考题诠释
1
2
-
9
-
专题知识脉络
能力目标解读
热点考题诠释
1
2
-
10
-
专题知识脉络
能力目标解读
热点考题诠释
1
2
2
.(2016
全国乙
)
锗
(
Ge
)
是典型的半导体元素
,
在电子、材料等领域应用广泛。回答下列问题
:
(1)
基态
Ge
原子的核外电子排布式为
[
Ar
]
,
有
个未成对电子。
(2)Ge
与
C
是同族元素
,C
原子之间可以形成双键、叁键
,
但
Ge
原子之间难以形成双键或叁键。从原子结构角度分析
,
原因是
。
(3)
比较下列锗卤化物的熔点和沸点
,
分析其变化规律及原因
-
11
-
专题知识脉络
能力目标解读
热点考题诠释
1
2
(4)
光催化还原
CO
2
制备
CH
4
反应中
,
带状纳米
Zn
2
GeO
4
是该反应的良好催化剂。
Zn
、
Ge
、
O
电负性由大至小的顺序是
。
(5)Ge
单晶具有金刚石型结构
,
其中
Ge
原子的杂化方式为
,
微粒之间存在的作用力是
。
(6)
晶胞有两个基本要素
:
则
D
原子的坐标参数为
。
-
12
-
专题知识脉络
能力目标解读
热点考题诠释
1
2
②
晶胞参数
,
描述晶胞的大小和形状。已知
Ge
单晶的晶胞参数
a
=565.76 pm,
其密度为
g·cm
-3
(
列出计算式即可
)
。
-
13
-
专题知识脉络
能力目标解读
热点考题诠释
1
2
解题要领
(1)Ge
是第四周期
Ⅳ
A
族元素
,
是
32
号元素
,
电子排布式为
[Ar]3d
10
4s
2
4p
2
,2
个
4p
电子分别位于
2
个不同轨道上
,
故有
2
个未成对电子。
(2)Ge
的原子半径比
C
大
,
原子间形成
σ
单键较长
,
p
-
p
轨道肩并肩重叠程度很小或几乎不能重叠
,
难以形成
“
肩并肩
”
重叠方式的
π
键。
(3)
锗卤化物均为分子晶体
,
对于组成和结构相似的分子晶体
,
相对分子质量越大
,
分子间作用力越大
,
熔沸点越高。
(4)
元素的非金属性越强
,
吸引电子能力就越强
,
则电负性越强
,
电负性由大到小的顺序为
O>
Ge
>Zn
。
(5)
金刚石中
C
为
sp
3
杂化
,C
与
C
之间为非极性共价键
,
Ge
单晶与金刚石结构相似
,
杂化方式与存在的作用力也与金刚石一样。
-
14
-
专题知识脉络
能力目标解读
热点考题诠释
1
2
-
15
-
热点一
热点二
热点三
热点四
原子结构
有关原子结构的思维路径
-
16
-
热点一
热点二
热点三
热点四
问题探究
1
.
核外电子排布的表示方法有哪些
?
(1)
电子排布式 如
Cr:1s
2
2s
2
2p
6
3s
2
3p
6
3d
5
4s
1
(2)
简化电子排布式 如
Cu:[Ar]3d
10
4s
1
(3)
价电子排布式 如
Fe:3d
6
4s
2
(4)
电子排布图
(
或轨道表示式
)
-
17
-
热点一
热点二
热点三
热点四
2
.
元素的第一电离能和电负性有怎样的递变规律
?
分别有什么应用
?
(1)
递变规律
:
在元素周期表中
,
元素的第一电离能从左到右呈增大趋势
(
注意第
Ⅱ
A
族、第
ⅤA
族元素的第一电离能大于同周期相邻元素
),
从上到下逐渐减小
;
元素的电负性从左到右逐渐增大
,
从上到下逐渐减小。
(2)
应用
:
元素的第一电离能可用于
:
①
判断元素金属性的强弱
:
电离能越小
,
金属越容易失去电子
,
金属性越强
;
反之越弱。
②
判断元素的化合价
(
I
1
、
I
2
……
表示各级电离能
):
如果某元素的
I
n+
1
≫
I
n
,
则该元素的常见化合价为
+
n
。如钠元素
I
2
≫
I
1
,
所以钠元素的化合价为
+1
价。
元素的电负性可用于
:
①
判断金属性与非金属性的强弱
;
②
判断元素在化合物中的化合价
(
正或负
);
③
判断化学键的类型。
-
18
-
热点一
热点二
热点三
热点四
例
1
(2015
湖北联考
)
铁和铜都是日常生活中常见的金属
,
有着广泛的用途。请回答下列问题
:
(1)
铁在元素周期表中的位置为
。
(2)K
3
[Fe(CN)
6
]
溶液可用于检验
(
填离子符号
),
该离子的核外电子排布为
;C
、
N
、
O
三元素的第一电离能由大到小的顺序为
(
用元素符号表示
)
。
(3)
基态铜原子的价层电子排布式为
。
(4)
已知某元素
M
与铜能形成化合物
,
且
M
和铜的电负性分别为
3.0
和
1.9,
则
M
与铜形成的化合物属于
(
填
“
离子
”
或
“
共价
”)
化合物。
-
19
-
热点一
热点二
热点三
热点四
分析推理
(1)
由原子序数怎样确定元素在周期表中的位置
?
原子序数
<18
时
,
直接根据原子结构示意图确定元素所在的周期和族
;
原子序数
>18
时
,
一般常用
“0
族定位法
”,
其关键在于
:
①
熟记各周期
0
族元素的原子序数
:2
、
10
、
18
、
36
、
54
、
86
等
;
②
掌握周期表中每纵行对应的族序数。如
26
Fe,26-18=8,
则
Fe
在第四周期第
Ⅷ
族
(
第
8
纵行对应第
Ⅷ
族
)
。
-
20
-
热点一
热点二
热点三
热点四
(2)
由原子序数怎样书写电子排布式
?
原子序数
<18
时
,
直接根据构造原理书写
,
如
16
S,1s
2
2s
2
2p
6
3s
2
3p
4
。原子序数
>18
时
,
如第四周期元素
,
用原子序数
-18
就是其外围电子数
,
然后将外围电子数依次填入能级即可。如
28
Ni,28-18=10,
则
Ni
的电子排布式为
[Ar]3d
8
4s
2
。注意
:
①
能级交错
(
先排
4s,
再排
3d);
②
24
Cr
及
29
Cu
的外围电子排布特殊
(
能量相同的原子轨道在全满、半满和全空状态时
,
体系的能量最低
),
分别为
3d
5
4s
1
、
3d
10
4s
1
。
③
电子填充时先排
4s
再排
3d;
书写时先写
3d
再写
4s;
失电子时
,
先失
4s
再失
3d
。
-
21
-
热点一
热点二
热点三
热点四
(3)
判断元素的第一电离能、电负性应注意哪些事项
?
均根据其在元素周期表中的递变规律判断。第一电离能递变规律
:
同周期从左至右呈增大趋势
,
但当原子轨道呈全满、半满、全空状态时
,
第一电离能反常
,
即第
Ⅱ
A
族、第
Ⅴ
A
族元素的第一电离能分别大于同周期相邻元素
;
同主族从上至下逐渐减小。电负性递变规律
:
从左到右逐渐增大
,
从上到下逐渐减小。
(4)
怎样根据电负性判断化学键类型
?
通常是根据电负性的差值来判断化学键的类型
,
进而判断化合物的类型
,
一般电负性差值较大的元素原子间形成的化学键主要是离子键
,
差值小的则主要形成共价键。如
Cu
、
Cl
两元素的电负性分别为
1.9
和
3.0,
则两元素原子间形成共价键
(
一般差值大于
1.7
时形成离子键
),
化合物类型为共价化合物。注意利用电负性的差值判断化学键类型只是一般规律
,
不是绝对的。
-
22
-
热点一
热点二
热点三
热点四
答案
(1)
第四周期第
Ⅷ
族
(2)Fe
2+
[Ar]3d
6
或
1s
2
2s
2
2p
6
3s
2
3p
6
3d
6
N>O>C
(3)3d
10
4s
1
(4)
共价
评分细则警示
(2)
写成
N
O
C
或
I
(N)>
I
(O)>
I
(C)
均给分。
-
23
-
热点一
热点二
热点三
热点四
对点训练
1
元素
A
的基态原子占据哑铃形原子轨道的电子总数为
2,
元素
B
与
A
同周期
,
其基态原子占据
s
轨道的电子数与
p
轨道相同
;C
是
A
的同族相邻元素
;D
是
B
的同族相邻元素。则
:
(1)D
原子核外
L
层电子的排布式为
;C
的核外电子排布式为
;B
的基态原子未成对电子数为
个。
(2)
已知
A
与
D
形成的化合物中
A
、
D
之间的共用电子对偏向
D,
则
A
、
B
、
C
、
D
元素的电负性由大到小的顺序为
;A
、
B
、
C
第一电离能由大到小的顺序为
。
-
24
-
热点一
热点二
热点三
热点四
答案
(1)2s
2
2p
6
1s
2
2s
2
2p
6
3s
2
3p
2
2
(2)O>S>C>Si
O>C>Si
解析
哑铃形是
p
轨道且电子总数为
2,A
原子的电子排布式为
1s
2
2s
2
2p
2
,
为碳元素
;B
原子的电子排布式为
1s
2
2s
2
2p
4
,
为氧元素
;C
、
D
分别为
Si
、
S;
由
C
、
S
之间的共用电子对偏向
S
可知
S
的电负性大于
C
。
-
25
-
热点一
热点二
热点三
热点四
两大理论与分子的立体构型
有关推测或解释分子立体构型的思维路径
-
26
-
热点一
热点二
热点三
热点四
问题探究
1
.
如何用价层电子对互斥理论推测分子的立体构型
?
(1)
判断分子中中心原子上的价层电子对数
:
其中
:
a
为中心原子的价电子数
(
阳离子要减去电荷数、阴离子要加上电荷数
),
x
是与中心原子结合的原子数
,
b
为与中心原子结合的原子最多能接受的电子数。如
,
中心原子为
S,
σ
键电子对数为
4,
孤电子对数
=(6+2-4×2)
÷
2=0,
则价层电子对数为
4+0=4
。
-
27
-
热点一
热点二
热点三
热点四
(2)
价层电子对互斥理论与分子构型
:
-
28
-
热点一
热点二
热点三
热点四
2
.
如何用杂化轨道理论解释分子的立体构型
?
-
29
-
热点一
热点二
热点三
热点四
3
.
如何判断中心原子的杂化类型
?
(1)
根据杂化轨道数判断
:
杂化轨道数
=
中心原子的孤电子对数
+
中心原子的
σ
键个数
-
30
-
热点一
热点二
热点三
热点四
(2)
根据分子的立体构型判断
:
(3)
根据中心原子的成键类型判断
:
如果中心原子形成一个三键
,
则为
sp
杂化
;
如果形成一个双键
,
则为
sp
2
杂化
;
如果全部是单键
,
则为
sp
3
杂化。
-
31
-
热点一
热点二
热点三
热点四
-
32
-
热点一
热点二
热点三
热点四
(3)NH
3
极易溶于水
,
其立体构型为
,
试判断
NH
3
溶于水后
,
形成
NH
3
·H
2
O
的合理结构
:
(
填字母代号
),
推理依据是
。
-
33
-
热点一
热点二
热点三
热点四
分析推理
(1)
怎样比较键角大小
?
当中心原子杂化类型相同时
,
与成键电子对间的排斥相比
,
孤对电子对成键电子对有更大的排斥作用
,
因此有孤对电子会使键角变小
,
孤对电子越多
,
键角越小。
-
34
-
热点一
热点二
热点三
热点四
(2)
怎样判断分子的极性
?
根据键的极性和分子立体构型共同判断
:a.
完全由非极性键结合而成的分子是非极性分子
(O
3
除外
);b.
由极性键结合而成的完全对称性分子为非极性分子
,
非对称性分子是极性分子。
根据经验规律判断
:
对于
AB
n
型分子
,
若中心原子
A
的化合价的绝对值等于该元素原子的最外层电子数
,
则为非极性分子
,
否则为极性分子。
-
35
-
热点一
热点二
热点三
热点四
答案
(1)
②③⑤
①④
非极性
(2)
①
sp
和
sp
2
三角锥形 大于
②
sp
3
杂化 极性
(3)
三角锥形
b
NH
3
·H
2
O
电离生成铵根离子和氢氧根离子
评分细则警示
(1)“
大于
”
写成
“>”
不得分
;(2)
②
极性分子也正确。
-
36
-
热点一
热点二
热点三
热点四
对点训练
2
(2015
潍坊一模
)
第二周期中碳、氮、氧是构成生命物质的三种主要元素
,
在生产生活中也有着重要的应用。
(1)
第二周期中
,
第一电离能处于
B
与
N
之间的元素有
种。
(2)BF
3
与一定量水形成
(H
2
O)
2
·BF
3
晶体
Q,Q
在一定条件下可转化为
R:
①
BF
3
属于
分子
(
填
“
极性
”
或
“
非极性
”);
②
R
中阳离子的立体构型为
,
阴离子的中心原子轨道采用
杂化
;
-
37
-
热点一
热点二
热点三
热点四
③
H
3
O
+
中
H—O—H
键角比
H
2
O
中
H—O—H
键角大
,
原因是
。
(3)
乙烯酮
( )
是一种重要的有机中间体
,
乙烯酮分子中碳原子杂化轨道类型有
。
答案
(1)3
(2)
①
非极性
②
三角锥形
sp
3
③
H
2
O
分子中氧原子有两对孤电子对
,H
3
O
+
中氧原子只有一对孤电子对
,
排斥力较小
(3)sp
2
和
sp
-
38
-
热点一
热点二
热点三
热点四
解析
(1)
根据电离能的变化规律
,2p
能级半充满的氮原子和
2s
能级全充满
2p
能级全空的铍原子第一电离能要比同周期相邻原子高
,
故第一电离能介于
B
、
N
之间的第二周期元素有
Be
、
C
、
O
三种元素。
(2)
①
BF
3
分子立体构型为平面正三角形
,
是由极性键结合而成的完全对称性分子
,
属于非极性分子
;
②
H
3
O
+
中氧原子杂化轨道类型为
sp
3
,
但氧原子上有一对孤对电子
,
所以立体构型为三角锥形
,
阴离子中
B
原子的价层电子对数为
4,
杂化轨道类型为
sp
3
;
③
H
2
O
和
H
3
O
+
中中心原子
O
的杂化类型均为
sp
3
,
但氧原子的孤电子对数不同
,H
2
O
中有两对孤电子对
,H
3
O
+
中只有一对
,
排斥力较小。
(3)
第一个
C
形成一个双键
,
杂化类型为
sp
2
,
第二个
C
形成两个双键
(
相当于一个三键
),
杂化类型为
sp
。
-
39
-
热点一
热点二
热点三
热点四
粒子间作用与分子的性质
有关分子性质的思维路径
-
40
-
热点一
热点二
热点三
热点四
问题探究
1
.
共价键、范德华力、氢键对物质性质有哪些影响
?
-
41
-
热点一
热点二
热点三
热点四
-
42
-
热点一
热点二
热点三
热点四
2
.
分子具有哪些性质
,
有怎样的规律
?
(1)
溶解性
:
依据
“
相似相溶
”
的规律
,
非极性溶质一般能溶于非极性溶剂
,
极性溶质一般能溶于极性溶剂。若存在氢键
,
则溶剂和溶质之间的氢键作用力越大
,
溶解性越好。
“
相似相溶
”
还适用于分子结构的相似性
,
如乙醇和水互溶
(C
2
H
5
OH
和
H
2
O
中的羟基相近
),
而戊醇在水中的溶解度明显减小。
(2)
手性
:
具有完全相同的组成和原子排列的一对分子
,
如同左手与右手一样
,
镜面对称
,
却在三维空间里不能重叠
,
互称手性异构体
,
具有手性异构体的分子叫手性分子。
(3)
无机含氧酸分子的酸性
:
无机含氧酸可写成
(HO)
m
RO
n
,
如果成酸元素
R
相同
,
则非羟基氧原子数
n
越大
,
酸性越强
,
如
HClO
离子晶体
>
分子晶体。
金属晶体的熔沸点差别很大
,
如钨、铂等熔沸点很高
,
汞、铯等熔沸点很低。
(2)
同种类型晶体
:
构成晶体质点间的作用力越大
,
则熔沸点越高
,
反之则越低。
①
离子晶体
:
一般阴阳离子所带的电荷数越多
,
离子半径越小
,
则晶格能越大
,
晶体的熔沸点就越高
,
如熔点
:
MgO
>
NaCl
。
-
55
-
热点一
热点二
热点三
热点四
②
分子晶体
:
组成和结构相似的分子晶体
,
相对分子质量越大
,
熔沸点越高
,
如熔沸点
:SnH
4
>GeH
4
>SiH
4
>CH
4
;
组成和结构不相似的物质
(
相对分子质量接近
),
分子的极性越大
,
其熔沸点越高
,
如熔沸点
CO>N
2
;
对于有机物的同分异构体
,
支链越多
,
熔沸点越低
;
具有氢键的分子晶体熔沸点反常地高
,
如熔沸点
H
2
O>H
2
Te>H
2
Se>H
2
S
。
③
原子晶体
:
原子半径越小
,
键长越短
,
键能越大
,
晶体的熔沸点越高。
如熔点
:
金刚石
>
碳化硅
>
硅。
④
金属晶体
:
金属离子半径越小
,
离子所带电荷越多
,
金属键越强
,
金属熔沸点越高。
如熔沸点
:Na”“<”
或
“=”)
图甲中
1
号
C
与相邻
C
形成的键角。
-
63
-
热点一
热点二
热点三
热点四
(3)
若将图乙所示的氧化石墨烯分散在
H
2
O
中
,
则氧化石墨烯中可与
H
2
O
形成氢键的原子有
(
填元素符号
)
。
(4)
石墨烯可转化为富勒烯
(C
60
),
某金属
M
与
C
60
可制备一种低温超导材料
,
晶胞如图丙所示
,M
原子位于晶胞的棱上与内部。该晶胞中
M
原子的个数为
,
该材料的化学式为
。
-
64
-
热点一
热点二
热点三
热点四
-
65
-
1
2
3
1
.(2016
陕西师范大学附中一模
)
原子序数依次递增且都小于
36
的
X
、
Y
、
Z
、
Q
、
W
五种元素
,
其中
X
是原子半径最小的元素
,Y
原子基态时最外层电子数是其内层电子数的
2
倍
,Q
原子基态时
2p
原子轨道上有
2
个未成对的电子
,W
元素的原子结构中
3d
能级有
4
个未成对电子。回答下列问题
:
(1)Y
2
X
2
分子中
Y
原子轨道的杂化类型为
,Y
2
X
2
分子中
σ
键和
π
键个数比为
。
(2)
化合物
ZX
3
的沸点比化合物
YX
4
的高
,
其主要原因是
。
(3)
元素
Y
的一种氧化物与元素
Z
的一种氧化物互为等电子体
,
元素
Z
的这种氧化物的分子式是
。
-
66
-
1
2
3
(4)
元素
W
能形成多种配合物
,
如
:W(CO)
5
等。
①
基态
W
3+
的
M
层电子排布式为
。
②
W(CO)
5
常温下呈液态
,
熔点为
-20.5
℃
,
沸点为
103
℃
,
易溶于非极性溶剂
,
据此可判断
W(CO)
x
晶体属于
(
填晶体类型
),
该晶体中
W
的化合价为
。
(5)
下列有关的说法正确的是
。
A.
分子晶体中
,
共价键的键能越大
,
该分子晶体的熔沸点越高
B.
电负性顺序
:X
(
用元素符号表示
)
。试解释其原因
:
。
(3)
任写一种与
AB
-
互为等电子体的微粒
。
(4)B
与
C
形成的四原子阴离子的立体构型为
,
其中
B
原子的杂化类型是
。
-
73
-
1
2
3
(5)D
和
E
形成的化合物的晶胞结构如图
,
其化学式为
;
已知晶体的密度为
ρ
g·cm
-3
,
阿伏加德罗常数为
N
A
,
则晶胞边长
a
=
cm
。
(
用含
ρ
、
N
A
的计算式表示
)
-
74
-
1
2
3
-
75
-
1
2
3
-
76
-
1
2
3
3
.(2014
四川理综
)X
、
Y
、
Z
、
R
为前四周期元素
,
且原子序数依次增大。
XY
2
是红棕色气体
;X
与氢元素可形成
XH
3
;Z
基态原子的
M
层与
K
层电子数相等
;R
2+
的
3d
能级中有
9
个电子。
请回答下列问题
:
(1)Y
基态原子的电子排布式是
;Z
所在周期中第一电离能最大的主族元素是
。
(2)
的立体构型是
;R
2+
的水合离子中
,
提供孤电子对的原子是
。
(3)Z
与某元素形成的化合物的晶胞如图所示
,
晶胞中阴离子与阳离子的个数比是
。
-
77
-
1
2
3
(4)
将
R
单质的粉末加入
XH
3
的浓溶液中
,
通入
Y
2
,
充分反应后溶液呈深蓝色
,
该反应的离子方程式是
。
-
78
-
1
2
3