- 309.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
含硫化合物的性质探究
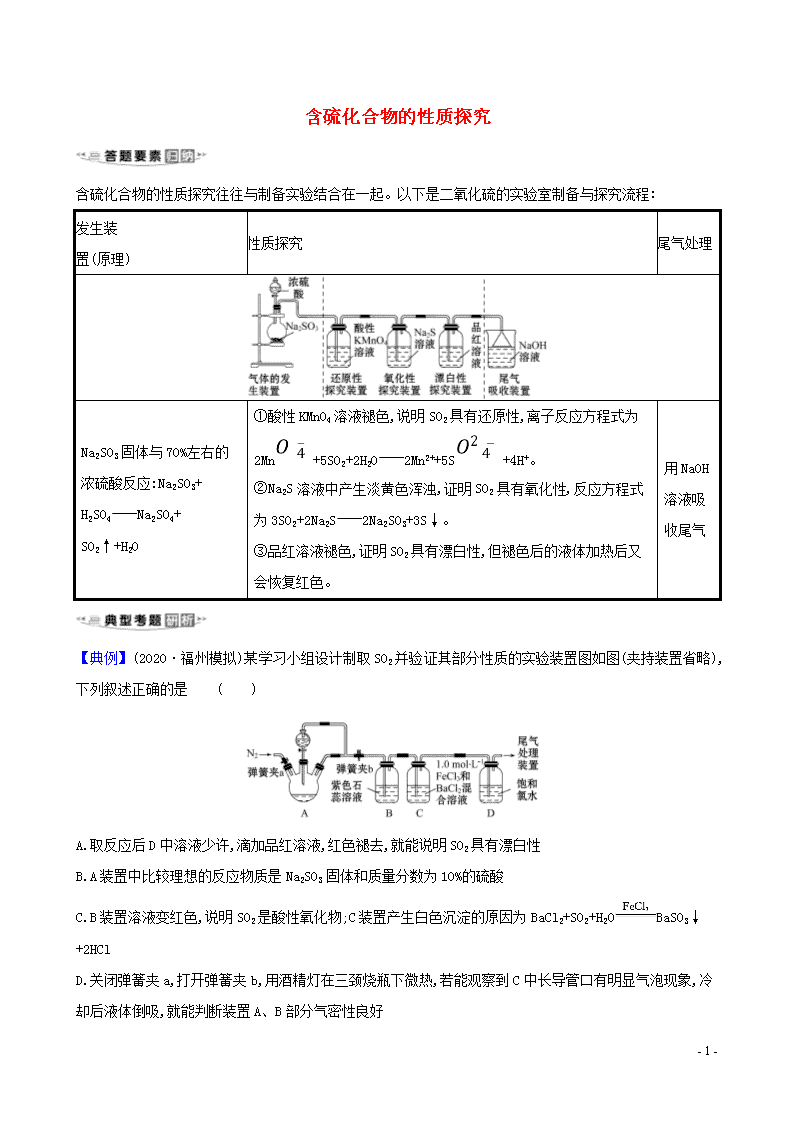
含硫化合物的性质探究往往与制备实验结合在一起。以下是二氧化硫的实验室制备与探究流程:
发生装
置(原理)
性质探究
尾气处理
Na2SO3固体与70%左右的浓硫酸反应:Na2SO3+
H2SO4Na2SO4+
SO2↑+H2O
①酸性KMnO4溶液褪色,说明SO2具有还原性,离子反应方程式为2Mn+5SO2+2H2O2Mn2++5S+4H+。
②Na2S溶液中产生淡黄色浑浊,证明SO2具有氧化性,反应方程式为3SO2+2Na2S2Na2SO3+3S↓。
③品红溶液褪色,证明SO2具有漂白性,但褪色后的液体加热后又会恢复红色。
用NaOH
溶液吸收尾气
【典例】(2020·福州模拟)某学习小组设计制取SO2并验证其部分性质的实验装置图如图(夹持装置省略),下列叙述正确的是 ( )
A.取反应后D中溶液少许,滴加品红溶液,红色褪去,就能说明SO2具有漂白性
B.A装置中比较理想的反应物质是Na2SO3固体和质量分数为10%的硫酸
C.B装置溶液变红色,说明SO2是酸性氧化物;C装置产生白色沉淀的原因为BaCl2+SO2+H2OBaSO3↓+2HCl
D.关闭弹簧夹a,打开弹簧夹b,用酒精灯在三颈烧瓶下微热,若能观察到C中长导管口有明显气泡现象,冷却后液体倒吸,就能判断装置A、B部分气密性良好
- 2 -
【思维建模】含硫化合物的性质探究一般包括以下几个流程装置,做题时根据物质的性质有效分割,思路清晰。
发生装置→净化装置→收集装置→性质验证装置→尾气处理装置
【解析】选D。A项,氯水中存在次氯酸具有漂白作用,也可以使品红溶液褪色,不能确定一定为二氧化硫的漂白性,故A错误;B项,二氧化硫易溶于水,比较理想的反应物质是亚硫酸钠固体和浓硫酸,故B错误;C项,C装置中产生的白色沉淀为BaSO4,错误;D项,检验装置中A、B两部分的气密性,进行的操作是关闭弹簧夹a,打开弹簧夹b,用酒精灯在三颈烧瓶下微热,观察到C中长导管口有明显气泡现象,冷却后长导管中出现一段水柱,说明该装置A、B部分气密性良好,故D正确。
【延伸探究】(1)本实验中FeCl3溶液的作用是什么?如何书写该反应的化学方程式?
提示:本实验中FeCl3溶液作氧化剂,SO2+2H2O+2FeCl3H2SO4+2HCl+2FeCl2。
(2)SO2通入BaCl2溶液中能发生化学反应吗?有哪些方法可以使SO2通入BaCl2溶液中时产生白色沉淀?
提示:SO2与BaCl2溶液不反应,若要产生沉淀,可以滴加氧化性(如硝酸)物质或碱性物质(NaOH溶液等),还可以通入氧化性(O2、Cl2等)气体或碱性气体(NH3)。
如图所示是研究二氧化硫性质的微型实验装置。现用60%的硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象明显,且不易污染空气。下列说法中错误的是( )
A.紫色石蕊溶液变蓝
B.品红溶液褪色
C.溴水褪色
D.含酚酞的NaOH溶液红色变浅或褪去
【解析】选A。SO2的水溶液显酸性,能使紫色石蕊溶液变红,A错误。SO2有漂白性,能使品红溶液褪色,B正确。SO2有还原性,与溴水发生反应:Br2+SO2+2H2OH2SO4+2HBr,使溴水褪色,C正确。SO2能与NaOH溶液反应生成Na2SO3,使红色变浅或褪去,D正确。
- 2 -