- 2.58 MB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
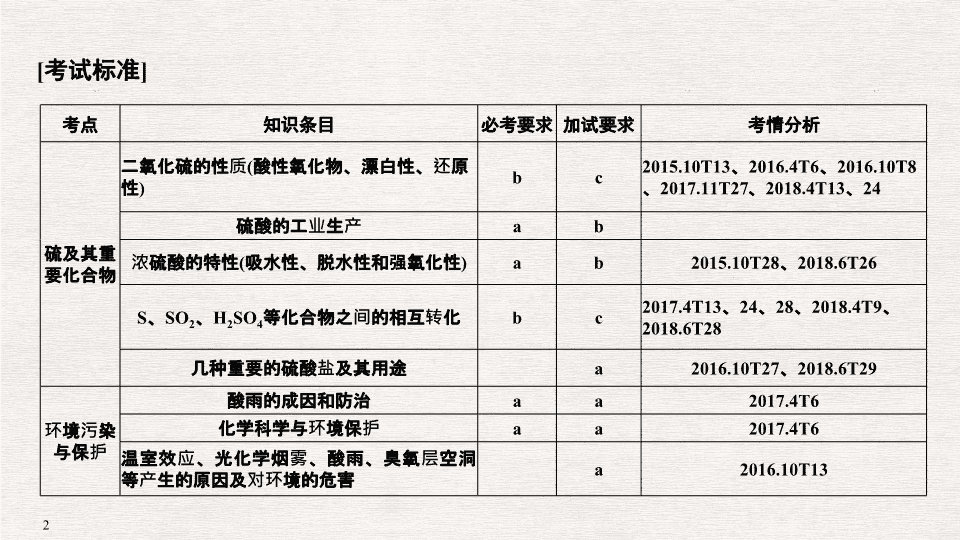
专题十三 硫及其化合物 环境保护
[
考试标准
]
考点
知识条目
必考要求
加试要求
考情分析
硫及其重要化合物
二氧化硫的性质
(
酸性氧化物、漂白性、还原性
)
b
c
2015.10T13
、
2016.4T6
、
2016.10T8
、
2017.11T27
、
2018.4T13
、
24
硫酸的工业生产
a
b
浓硫酸的特性
(
吸水性、脱水性和强氧化性
)
a
b
2015.10T28
、
2018.6T26
S
、
SO
2
、
H
2
SO
4
等化合物之间的相互转化
b
c
2017.4T13
、
24
、
28
、
2018.4T9
、
2018.6T28
几种重要的硫酸盐及其用途
a
2016.10T27
、
2018.6T29
环境污染与保护
酸雨的成因和防治
a
a
2017.4T6
化学科学与环境保护
a
a
2017.4T6
温室效应、光化学烟雾、酸雨、臭氧层空洞等产生的原因及对环境的危害
a
2016.10T13
考点一:硫的性质
1.
(2017·
浙江师大附中高一期中
)
下列有关说法正确的是
(
)
解析
硫单质的氧化性较弱,和变价金属反应一般生成低价金属盐,因此
A
错;
B
选项中考查了硫的燃烧,当硫在氧气中燃烧时,只能生成
SO
2
,不能得到
SO
3
,
SO
2
只有在催化剂、加热条件下才可以和
O
2
反应生成
SO
3
,所以
B
错误;
C
项考查了硫单质的溶解性,硫燃烧后试管内壁剩余的固体是硫单质,不溶于水,微溶于酒精,易溶于
CS
2
,所以应用
CS
2
除去,也可以用热的碱液清洗。
答案
D
考点二:
SO
2
的性质
2.
(2018·
金华十校
)
硫酸是当今世界最重要的化工产品之一。
Ⅱ
.
硫酸的性质。
(3)
下图中甲试管内发生反应的化学方程式
______________________________
___________________________________________________________
,
该反应体现了浓硫酸的性质为
________
。
(4)
当铜片与浓硫酸充分反应后,试管内并未出现蓝色溶液,而是看到白色固体,请写出检验白色固体的方法
_______________________________
___________________________________________________________
。
考点三:
SO
2
和
CO
2
的区别与联系
3.
(2018·
桐乡一中高一模拟
)
根据要求完成下列实验过程
(a
、
b
为弹簧夹,加热及固定装置已略去
)
。
(1)
验证碳、硅非金属性的相对强弱
(
已知酸性:亚硫酸
>
碳酸
)
。
①
连接仪器、
________
、加药品后,打开
a
、关闭
b
,然后滴入浓硫酸,加热。
②
装置
A
中试剂是
________
。
③
能说明碳的非金属性比硅强的实验现象是
______________________
___________________________________________________________
。
(2)
验证
SO
2
的氧化性、还原性和酸性氧化物的通性。
①
在
(1)
①
操作后打开
b
,关闭
a
。
②
H
2
S
溶液中有浅黄色浑浊出现,化学方程式是
_______________________
___________________________________________________________
。
③
BaCl
2
溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
写出其中
SO
2
显示还原性生成沉淀的离子方程式:
_______________________
___________________________________________________________
。
滴加的溶液
氯水
氨水
沉淀的化学式
答案
(1)
①
检验装置气密性
②
酸性
KMnO
4
溶液
③
A
中酸性
KMnO
4
溶液没有完全褪色,盛有
Na
2
SiO
3
溶液的试管中出现白色沉淀
(2)
②
2H
2
S
+
SO
2
===3S
↓
+
2H
2
O
③
BaSO
4
BaSO
3
Ba
2
+
+
SO
2
+
Cl
2
+
2H
2
O===BaSO
4
↓
+
4H
+
+
2Cl
-
考点四:
H
2
SO
4
的性质
4.
(2016·
第一学期浙江名校协作体试题,
28)
在烧瓶中放入
20
克蔗糖,依次加入少量水、
20 mL
浓硫酸,蔗糖逐渐变黑,体积膨胀,形成疏松多孔的
“
黑面包
”
,烧瓶发烫,品红溶液颜色变淡。
请回答:
(1)
仪器
a
的名称
________
。
(2)
小试管盛装试剂
_________________________________
。
(3)
下列说法不正确的是
________
。
A.
蔗糖变黑说明发生过程
C
12
H
22
O
11
―→
12C
+
11H
2
O
B.
品红颜色变淡说明
SO
2
有漂白性
C.
上述实验体现浓硫酸的脱水性、吸水性和强氧化性
D.
将气体依次通过饱和碳酸氢钠溶液、澄清石灰水,石灰水变浑浊证明含有
CO
2
解析
(1)
仪器
a
为分液漏斗。
(2)
蔗糖与浓
H
2
SO
4
作用过程中产生
SO
2
,所以品红溶液颜色变浅,产生的
SO
2
需用碱液吸收
(
如浓
NaOH
溶液,氨水等
)
,以保护环境。
(3)D
项不能证明有
CO
2
,气体通入饱和
NaHCO
3
溶液时
SO
2
会与
NaHCO
3
产生
CO
2
,并且
SO
2
若未全部被
NaHCO
3
吸收,也会使澄清石灰水变浑浊。
答案
(1)
分液漏斗
(2)
浓
NaOH
溶液或氨水
(3)D
A.
向甲溶液中加入
BaCl
2
溶液,产生白色沉淀
B.
向乙溶液中加入
BaCl
2
溶液,有白色沉淀,再加入盐酸,沉淀不溶解
C.
向丙溶液中加入盐酸使之酸化,再加入
BaCl
2
溶液,有白色沉淀产生
D.
向丁溶液中加入硝酸使之酸化,再加入硝酸钡溶液,有白色沉淀产生
答案
C
考点六:环境污染
6.
(2018·
浙江新高考联盟
)
某硫酸厂周围的空气含有较多二氧化硫,某化学兴趣小组设计了以下装置和方法测定空气
(
内含
N
2
、
O
2
、
SO
2
、
CO
2
等
)
中
SO
2
含量。
甲
.
用图
1
所示装置,通入
V
L
空气,测定生成沉淀的质量;
乙
.
用图
2
所示装置,当
KMnO
4
溶液刚好褪色时,测定通入空气的体积
V
;
丙
.
用图
3
所示装置,通入
V
L
空气,测定
U
形管增加的质量。
(1)
你认为可行的操作是
________
。
(
填
“
甲、乙、丙
”
)
(2)
某环保部门为了测定空气中
SO
2
含量,做了如下实验:取标准状况下的空气
V
L
,缓慢通过足量溴水,在所得的溶液中加入过量的氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为
m
g
。
①
若通入气体的速率过快,测定的
SO
2
的体积分数
________
。
(
选填
“
偏高
”
、
“
偏低
”
或
“
不受影响
”
)
。
②
如何判断氯化钡溶液已经加过量
________________________________________
。
解析
本题考查实验方案设计与评价,
(1)
根据题中信息,空气中含有
N
2
、
O
2
、
SO
2
、
CO
2
,甲装置:
CO
2
和
SO
2
都能与
Ba(OH)
2
溶液反应生成沉淀,即
CO
2
对
SO
2
的测定产生干扰,故甲装置不可行;乙装置:
SO
2
具有还原性,能使酸性高锰酸钾溶液褪色,其余气体不能使酸性高锰酸钾溶液褪色,故乙装置可行;丙装置:碱石灰能吸收
CO
2
和
SO
2
,
CO
2
对
SO
2
的测定产生干扰,故丙装置不可行;
(2)
①
通入气体速率过快,
SO
2
不能完全被吸收,测定的
SO
2
的体积分数偏低;
②
检验
BaCl
2
过量,操作是:静置,待溶液澄清后,再向上层清液中滴加氯化钡溶液,若无沉淀生成说明沉淀完全,氯化钡过量,或者静置,待溶液澄清后,取上层清液少许,置于试管,向试管中滴加
Na
2
SO
4
溶液,如果出现白色沉淀,说明
BaCl
2
过量。
答案
(1)
乙
(2)
①
偏低
②
静置,待溶液澄清后,再向上层清液中滴加氯化钡溶液,若无沉淀生成说明沉淀完全,氯化钡过量
易错点一 硫单质性质的常见误区
1.
除去附着在试管内壁上的硫,除了用热的
NaOH
溶液,还可以用
CS
2
,但不能用酒精。
2.
硫在空气中燃烧只能生成
SO
2
,而不能生成
SO
3
。
3.
硫与铁、铜变价金属反应,生成低价态金属硫化物。
[
易错训练
1]
(2018·
浙江省镇海中学高一月考
)
下列物质中,不能由单质直接化合生成的是
________
。
①
CuS
②
FeS
③
SO
3
④
H
2
S
⑤
FeCl
2
答案
①③⑤
易错点二 对
SO
2
气体的性质认识不清
1.SO
2
使含有酚酞的
NaOH
溶液褪色,表现
SO
2
酸性氧化物的性质;使品红溶液褪色,表现
SO
2
的漂白性;能使溴水、酸性
KMnO
4
溶液褪色,表现
SO
2
的还原性;
SO
2
与
H
2
S
反应,表现
SO
2
的氧化性;
SO
2
和
Cl
2
等体积混合通入溶液中,漂白性不但不增强,反而消失。
2.
把
SO
2
气体通入
BaCl
2
溶液中,没有沉淀生成,但若通入
NH
3
或加入
NaOH
溶液,或把
BaCl
2
改为
Ba(NO
3
)
2
均有白色沉淀生成,前两者生成
BaSO
3
沉淀,后者生成
BaSO
4
沉淀。
[
易错训练
2]
(2017·
杭州七县市
)
某同学设计了如图装置用于制取
SO
2
,并验证
SO
2
的部分性质,回答下列问题:
(1)
装置
A
中用于添加浓硫酸的仪器名称为
________
。
(2)
某同学为了检验装置中
A
、
B
两部分的气密性,进行的操作是:关闭弹簧夹
a
、打开弹簧夹
b
,用酒精灯在三颈烧瓶下微热,观察到
B
中长导管口有明显气泡现象,他判断气密性良好。你认为是否合理
________(
填
“
合理
”
或
“
不合理
”
)
。
(3)
实验前要在装置中鼓入
N
2
,目的是
____________________________
___________________________________________________________
。
(4)
为了验证
SO
2
是酸性氧化物,
B
中可选用的试剂是
________
。
A.
无色酚酞溶液
B.
蓝色石蕊试剂
C.
红色品红溶液
D.KI
淀粉混合溶液
(5)
装置
C
中可观察到白色沉淀现象,由此可验证
SO
2
具有
________
性,相关反应的总的离子方程式为
__________________________________
___________________________________________________________
。
解析
(1)
根据图示装置可知,盛放浓硫酸的仪器为分液漏斗;
(2)
检验装置中
A
、
B
两部分的气密性,进行的操作是:关闭弹簧夹
a
、打开弹簧夹
b
,用酒精灯在三颈烧瓶下微热,观察到
B
中长导管口有明显气泡现象,冷却后长导管中出现一段水柱,说明该装置气密性良好,否则无法判断该装置的气密性是否良好;
(3)
氧气、硝酸根离子都能将二氧化硫氧化,所以如果装置中含有氧气,会干扰实验,所以鼓入氮气的目的是排净空气,防止干扰实验;
(4)A.
二氧化硫溶液为酸性溶液,不能使无色酚酞溶液变色,无法检验二氧化硫为酸性氧化物,故
A
错误;
B.
二氧化硫溶液显示酸性,能够使蓝色石蕊试剂变红,可以证明二氧化硫为酸性氧化物,故
B
正确;
C.
二氧化硫能够使红色品红溶液褪色,证明了二氧化硫有漂白性,无法证明二氧化硫为酸性氧化物,故
C
错误;
D.KI
淀粉混合溶液与二氧化硫不发生反应,无法证明二氧化硫为酸性氧化物,故
D
错误;
(5)
氯化铁具有氧化性,能够将二氧化硫氧化为硫酸,同时证明二氧化硫具有还原性,反应的离子方程式为:
Ba
2
+
+
2Fe
3
+
+
SO
2
+
2H
2
O===2Fe
2
+
+
BaSO
4
↓
+
4H
+
。
答案
(1)
分液漏斗
(2)
不合理
(3)
排净装置中的空气,防止溶液中
SO
2
被空气中的
O
2
氧化而干扰实验
(4)B
(5)
还原
Ba
2
+
+
2Fe
3
+
+
SO
2
+
2H
2
O===2Fe
2
+
+
BaSO
4
↓
+
4H
+
易错点三 忽略反应过程中酸的浓度变化
浓
HNO
3
和
Cu(
足量
)
、浓
H
2
SO
4
和
Cu(
足量
)
、浓盐酸和
MnO
2
(
足量
)
在反应时,随反应进行,产物会发生变化或反应停止。注意区分
Zn
和浓
H
2
SO
4
的反应。
[
易错训练
3]
(2018·
宁波镇海中学
)
某研究性学习小组为研究
Cu
与浓
H
2
SO
4
的反应,设计如下实验探究方案
(
装置中的固定仪器和酒精灯均未画出
)
。
材料二:探究实验剪辑
实验
1
:将光亮的铜丝在酒精灯火焰上灼烧变黑,然后插入稀硫酸中,铜丝重新变得光亮,溶液呈蓝绿色;将光亮的铜丝置入加热的硫蒸气中变黑,然后插入稀硫酸中无变化。
实验
2
:截取浓硫酸液面上方变黑的铜丝,插入稀硫酸中无变化;将浓硫酸液面下方变黑的铜丝,插入稀硫酸,黑色明显变浅,溶液呈蓝绿色。
实验
3
:将溶液中的黑色颗粒状物质,经过滤、稀硫酸洗、蒸馏水洗、干燥后放入氧气流中加热,然后冷却,用电子天平称重发现质量减少
10%
左右。
根据上述材料回答下列问题
(1)A
试管上方的长导管的作用是
______________________________
;
D
、
E
两支试管中
CCl
4
的作用是
__________________________________
。
(2)
加热过程中,观察到
A
试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸
(
沸腾
)
时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式:
___________________________
___________________________________________________________
。
(3)
对
A
试管中的浓
H
2
SO
4
和铜丝进行加热,很快发现
C
试管中品红溶液褪色,但始终未见
D
试管中澄清石灰水出现浑浊或沉淀。你的猜想是:
___________________________________________________________
。
设计实验验证你的猜想
____________________________
。
(4)
根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是
___________________________________________________________
。
(
写化学式
)
易错点四 不能正确鉴别
SO
2
和
CO
2
C
与浓硫酸反应产物的确定应按以下流程进行:无水
CuSO
4
确定水
→
品红溶液确定
SO
2
→
酸性
KMnO
4
溶液除去
SO
2
→
品红溶液检验
SO
2
是否除净
→
澄清石灰水检验
CO
2
。
[
易错训练
4]
选用下图所示仪器中的两个或几个
(
内含物质
)
组装成实验装置,以验证木炭可被浓
H
2
SO
4
氧化成
CO
2
,下列说法正确的是
(
)
A.
按气流从左向右流向,连接装置的正确顺序是
A
→
F
→
E
→
C
→
D
→
B
B.
丁中溶液褪色,乙中溶液变浑浊说明甲中生成
CO
2
C.
丙中品红溶液褪色,乙中溶液变浑浊说明甲中生成
CO
2
D.
丁和丙中溶液都褪色,乙中溶液变浑浊,说明甲中有
CO
2
生成
解析
检验木炭与热浓硫酸反应的生成物中含有
CO
2
,需排除
SO
2
的干扰,再通入澄清的石灰水中,洗气装置中导管长进短出,
A
正确;用酸性
KMnO
4
溶液除去
SO
2
时还应再通入品红溶液不褪色,检验确认不含
SO
2
,否则结论不可靠,
B
、
C
、
D
均不正确。
答案
A