- 120.82 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
www.ks5u.com
2020年春四川省双流棠湖中学高一期中考试
化学试题
注意事项:1.答题前,考生先将自己的姓名、准考证号码填写清楚,将条形码准确粘贴在条形码区域内。
2.答题时请按要求用笔。 3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试卷上答题无效。4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。
5.保持卡面清洁,不要折叠、不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。
6.考试时间:150分钟;物理化学生物同堂分卷考试,每科100分,共300分
7.可能用到的相对原子质量:H 1 C 12 N 14 O 16 Mg 23 P 31 S 32 Fe 56 Cu 64
第I卷 选择题(50分)
一、单选题(每小题5分,共10个小题,共50分)
1.X、Y是元素周期表ⅠA族中的两种金属元素,下列叙述中能说明X的金属性比Y强的是
A.Y与水反应比X与水反应更剧烈 B.Y+离子的氧化性比X+离子强
C.YOH的碱性比XOH强 D.Y的原子半径比X大
2.已知R2+核内共有N个中子,R的质量数为A,确定m g R2+中含有电子的物质的量为
A.m(A-N)/A mol B.m(A-N+2)/Amol
C.m(A-N-2)/A mol D.m(A+N-2)/A mol
3.13C−NMR(核磁共振)、15N−NMR可用于测定蛋白质、核酸等生物大分子的空间结构,这项研究曾获诺贝尔化学奖。下面有关叙述正确的是
A.15N的核外电子数比中子数少1 B.14N与14C互为同位素
C.15N与14N 为同一种核素 D.13C与15N有相同的中子数
4.同一周期三种非金属元素X、Y、Z,其最高价氧化物的水化物的酸性由强到弱的顺序是:HXO4>H2YO4>H3ZO4。下列说法正确的是
A.元素的非金属性:XH2Y>ZH3
C.阴离子的还原性:X->Y2->Z3-
D.X、Y、Z依次位于ⅤA族、ⅥA族、ⅦA族。
5.取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气(如图),下列对于试管内发生的反应及现象的说法正确的是
A.此反应无光照也可发生
B.甲烷和Cl2反应后的产物只有CH3Cl和HCl
C.盛放饱和食盐水的水槽底部会有少量晶体析出
D.CH4和Cl2完全反应后液面上升,液体充满试管
6.X、Y、Z和W代表原子序数依次增大的四种短周期主族元素。它们满足以下条件:①在元素周期表中,Z与Y、W均相邻;②X、Y、W分别位于不同周期;③Y、Z、W三种元素的原子最外层电子数之和为17。下列说法错误的是
A.X、Y、Z能形成共价化合物
B.Y和Z元素的原子半径大小顺序为Y > Z
C.X与Y、Z之间形成的核外电子总数为10的微粒只有YX3和X2Z
D.Z、W元素的最简单氢化物的沸点和稳定性均为H2Z > H2W
7.有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A →B ;当A、D组成原电池时, A为正极;B与E构成原电池时,电极反应式为:E2-+2e-=E,B-2e-=B2+则A、B、D、E金属性由强到弱的顺序为
A.A﹥B﹥E﹥D B.A﹥B﹥D﹥E C.D﹥E﹥A﹥B D.D﹥A﹥B﹥E
8.一种新型燃料电池,用两根金属作电极插入KOH溶液中,然后向两极分别通入甲烷和氧气,其电极反应为X极:CH4+10OH--8e-===CO32-+7H2O;Y极:4H2O+2O2+8e-===8OH-。下列关于此燃料电池的说法中,错误的是
A.X为负极,Y为正极
B.工作一段时间后,KOH的物质的量减少
C.在标准状况下,通入5.6 L O2完全反应后,有1 mol电子发生转移
D.该电池工作时,X极附近溶液的碱性增强
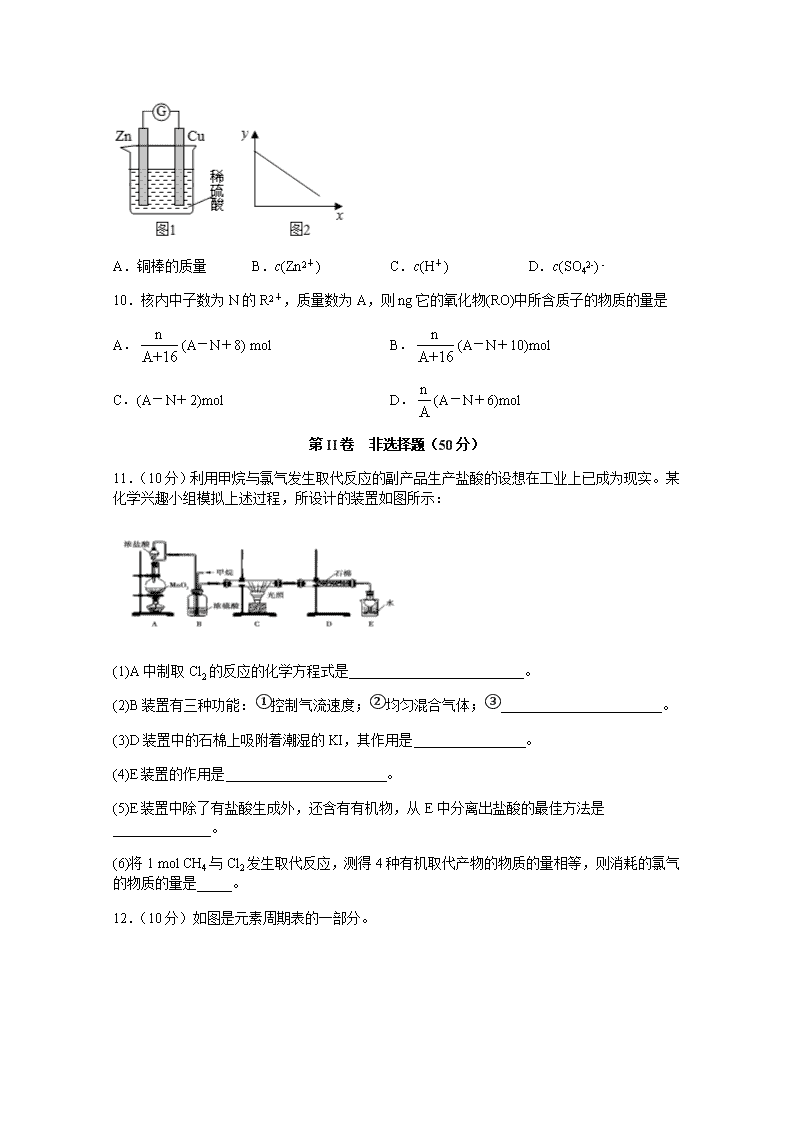
9.图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示
A.铜棒的质量 B.c(Zn2+) C.c(H+) D.c(SO42-) -
10.核内中子数为N的R2+,质量数为A,则ng它的氧化物(RO)中所含质子的物质的量是
A.(A-N+8) mol B.(A-N+10)mol
C.(A-N+2)mol D.(A-N+6)mol
第II卷 非选择题(50分)
11.(10分)利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实。某化学兴趣小组模拟上述过程,所设计的装置如图所示:
(1)A中制取Cl2的反应的化学方程式是_________________________。
(2)B装置有三种功能:①控制气流速度;②均匀混合气体;③_______________________。
(3)D装置中的石棉上吸附着潮湿的KI,其作用是________________。
(4)E装置的作用是_______________________。
(5)E装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法是______________。
(6)将1 mol CH4与Cl2发生取代反应,测得4种有机取代产物的物质的量相等,则消耗的氯气的物质的量是_____。
12.(10分)如图是元素周期表的一部分。
(1)②、⑥、⑧的离子半径由大到小的顺序为____________(用离子符号表示)。
(2)④、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是_____ (用化学式表示)。
(3)As的原子结构示意图为_________其氢化物的化学式为__________;
(4)Y由②、⑥、⑧三种元素组成,它的水溶液是生活中常见的消毒剂。As 可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为__________,当消耗l mol还原剂时,电子转移了_____mol。
13.(10分)某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成S、C、Si三种元素的非金属性强弱比较的实验研究。乙同学设计了如图装置来验证卤族元素的性质递变规律,A、B、C三处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
(1)如图中仪器A的名称是____。甲同学实验步骤:连接仪器、______、加药品、滴入试剂。
(2)①如图中仪器A中盛放试剂稀硫酸,烧瓶B中的盛放试剂为___溶液,C中的盛放试剂为______溶液。
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是_________。
(3)如图中A处反应的离子方程式为__________。
(4)乙同学发现如图中B处试纸变蓝,C处红纸褪色,据此____(填“能”或“不能”)得出溴的非金属性强于碘,理由是______。
14.(10分)有A、B、C、D、E五种短周期主族元素,原子序数由A到E逐渐增大。①A元素最外层电子数是次外层电子数的2倍。②B的阴离子和C的阳离子与氖原子的电子层结构相同。③在通常状况下,B的单质是气体,0.1 mol B的气体与足量的氢气完全反应共有0.4 mol电子转移。④C的单质在点燃时与B的单质充分反应,生成淡黄色的固体,此淡黄色固体能与AB2反应可生成B的单质。⑤D的气态氢化物与其最高价含氧酸间能发生氧化还原反应。请回答下列问题:
(1)写出A元素的最高价氧化物的电子式_____________。
(2)B元素在周期表中的位置为_____________。
(3)B单质与C单质在点燃时反应的生成物中所含化学键类型有______________。
(4)D元素的低价氧化物与E的单质的水溶液反应的化学方程式为______________。
(5)C与D能形成2∶1的化合物,用电子式表示该化合物的形成过程______________。
15.(10分)现有A、B、C、D四种短周期主族元素,A分别与B、C、D结合生成甲、乙、丙三种化合物,且甲、乙、丙三分子均为10电子粒子,C、D结合生成化合物丁。有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如图所示。
(1)根据以上条件可以确定A、B、C、D四种元素中的三种元素。不能被确定的第四种元素是____(填A、B、C、D中的一种)。
(2)依据下列条件可以进一步确定上述第四种元素:①甲与丙以及乙与丙均能够发生反应;②甲、丙都是无色、有刺激性气味的物质。据此,写出C+丙=乙+丁的化学方程式:___________。
(3)NH3•H2O的电离方程式为NH3•H2ONH4++OH-,试判断NH3溶于水后形成的NH3•H2O的合理结构 ________(填字母代号)。
2020年春四川省双流棠湖中学高一期中考试
化学试题参考答案
1.B 2.C 3.A 4.B 5.C 6.C 7.D 8.D 9.C 10.A
11.MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O 干燥气体 除去过量的Cl2 吸收氯化氢 分液 2.5mol
12.Cl->O2->Na+ HClO4>H3PO4>H2CO3 AsH3 5NaClO+2As+3H2O=2H3AsO4+5NaCl 5
13.分液漏斗 检查装置气密性 碳酸钠 硅酸钠 一段时间后产生白色胶状沉淀 Cl2+2Br-=Br2+2Cl- 不能 红纸褪色,说明有氯气剩余,不能判断B处溴蒸气是否参加反应,使试纸变蓝
14. 第二周期第ⅥA族 离子键、非极性共价键(或共价键) SO2+Cl2+2H2O=H2SO4+2HCl
15.D 4NH3+5O24NO+6H2O (b)