- 392.00 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
一、选择题:每小题只有一个选项符合题意。
1.下列叙述与氮元素的循环无关的是( )
A.工业合成氨的过程是固氮的过程
B.自然界中,氨是动物体特别是蛋白质腐败后的产物
C.为防止粮食、罐头、水果等食品腐烂,常用氮气做保护气
D.电闪雷鸣的雨天,N2与O2会发生反应并最终转化为硝酸盐被植物吸收
解析:选C。C项中由于N2很不活泼,故做保护气,不参与化学反应,也就不参与氮的循环。
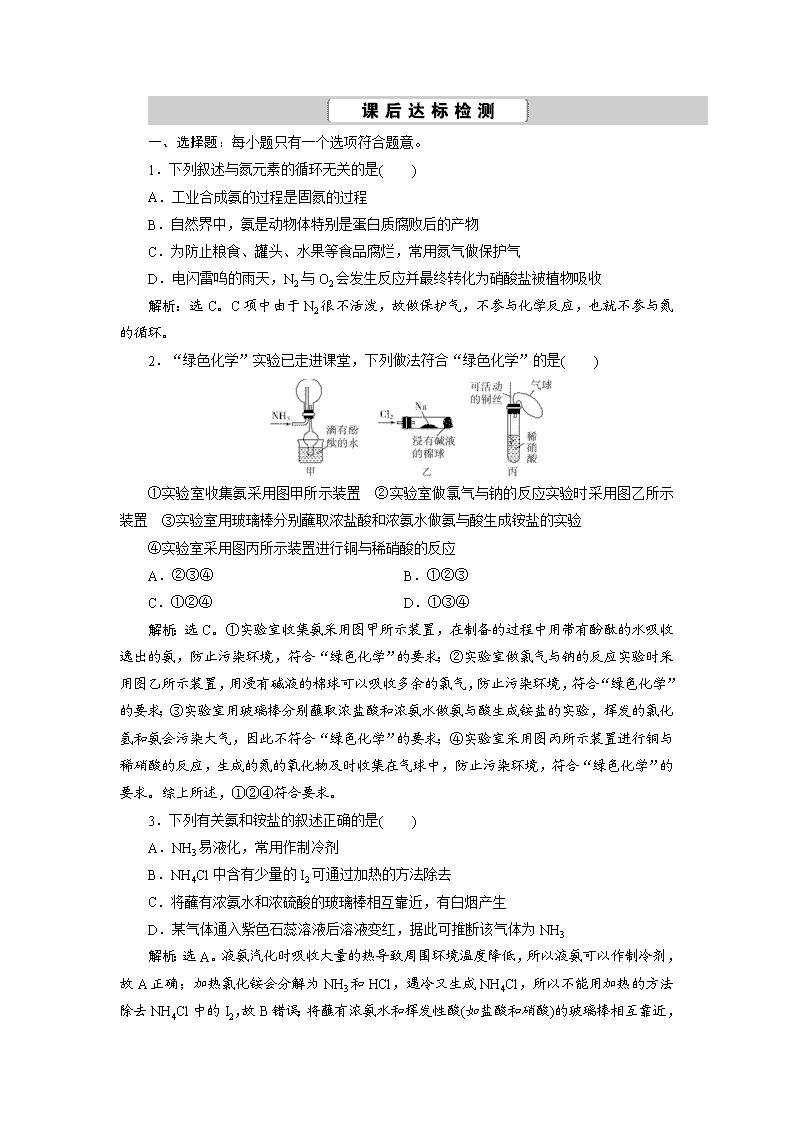
2.“绿色化学”实验已走进课堂,下列做法符合“绿色化学”的是( )
①实验室收集氨采用图甲所示装置 ②实验室做氯气与钠的反应实验时采用图乙所示装置 ③实验室用玻璃棒分别蘸取浓盐酸和浓氨水做氨与酸生成铵盐的实验
④实验室采用图丙所示装置进行铜与稀硝酸的反应
A.②③④ B.①②③
C.①②④ D.①③④
解析:选C。①实验室收集氨采用图甲所示装置,在制备的过程中用带有酚酞的水吸收逸出的氨,防止污染环境,符合“绿色化学”的要求;②实验室做氯气与钠的反应实验时采用图乙所示装置,用浸有碱液的棉球可以吸收多余的氯气,防止污染环境,符合“绿色化学”的要求;③实验室用玻璃棒分别蘸取浓盐酸和浓氨水做氨与酸生成铵盐的实验,挥发的氯化氢和氨会污染大气,因此不符合“绿色化学”的要求;④实验室采用图丙所示装置进行铜与稀硝酸的反应,生成的氮的氧化物及时收集在气球中,防止污染环境,符合“绿色化学”的要求。综上所述,①②④符合要求。
3.下列有关氨和铵盐的叙述正确的是( )
A.NH3易液化,常用作制冷剂
B.NH4Cl中含有少量的I2可通过加热的方法除去
C.将蘸有浓氨水和浓硫酸的玻璃棒相互靠近,有白烟产生
D.某气体通入紫色石蕊溶液后溶液变红,据此可推断该气体为NH3
解析:选A。液氨汽化时吸收大量的热导致周围环境温度降低,所以液氨可以作制冷剂,故A正确;加热氯化铵会分解为NH3和HCl,遇冷又生成NH4Cl,所以不能用加热的方法除去NH4Cl中的I2,故B错误;将蘸有浓氨水和挥发性酸(如盐酸和硝酸)的玻璃棒相互靠近,
有白烟产生,而硫酸不是挥发性的酸,故C错误;氨通入紫色石蕊溶液后溶液应变蓝,而不是变红,故D错误。
4.用下列实验装置和方法进行相应实验,能达到实验目的的是( )
A.用甲装置制干燥的氨
B.用乙装置收集并测量Cu与浓硝酸反应产生的气体及体积
C.用丙装置除去CO2中含有的少量HCl
D.用丁装置吸收NH3,并防止倒吸
解析:选A。B项,Cu与浓HNO3反应生成NO2,NO2会与H2O反应,错误;C项,CO2也可与Na2CO3溶液反应,错误;D项,应将苯换成CCl4,将气体通入CCl4中以防止倒吸,错误。
5.下列与碳、氮、硫、硅等非金属元素及其化合物有关的说法不正确的是( )
A.工业上,用焦炭在电炉中还原二氧化硅可得到含杂质的粗硅
B.氮的氧化物是形成光化学烟雾的主要物质,硫的氧化物是形成酸雨的主要物质
C.NO2、CO2和SO2溶于水均可导电,它们都是电解质
D.将SO2通入酸化的 Ba(NO3)2溶液中会出现白色沉淀
解析:选C。NO2、CO2、SO2均为非电解质。
6.(2020·全国名校第二次大联考)下列由相关实验现象推出的结论正确的是( )
A.NH4Cl和NH4HCO3受热都能分解,说明可以用加热NH4Cl和NH4HCO3固体的方法制氨
B.向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定含有SO
C.Fe与稀硝酸、稀硫酸反应均有气泡产生,说明Fe与两种酸均发生置换反应
D.NH3遇到浓盐酸产生白烟,说明二者发生反应生成白色固体
解析:选D。NH4Cl受热分解生成氨和氯化氢,冷却后二者又重新结合生成NH4Cl,不能制备氨,A项错误;向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,在酸性条件下NO具有强氧化性,会把SO氧化成SO,故不能说明原溶液中一定含有SO,也可能含有SO,B项错误;Fe与稀硝酸、稀硫酸反应均有气泡产生,前者是由于稀硝酸的强氧化性,后者是由于Fe与稀硫酸发生置换反应,C项错误;NH3遇到浓盐酸产生白烟,说明二者发生反应生成白色固体氯化铵,D项正确。
7.铜和铁的合金7.2 g完全溶于稀硝酸,若反应中硝酸被还原只产生NO气体,在反应后的溶液中加入足量的氢氧化钠溶液,最终生成12.3
g沉淀。则在标准状况下产生的NO气体的体积为( )
A.1.12 L B.2.24 L
C.3.36 L D.1.68 L
解析:选B。两种金属单质最终生成氢氧化物时增加的质量实际上是OH-的质量,OH-的物质的量与金属跟硝酸反应时失去的电子的物质的量相等,即n(e-)=n(OH-)=(12.3 g-7.2 g)÷17 g/mol=0.3 mol,根据HNO3NO可知,n(NO)=0.1 mol,在标准状况下的体积为2.24 L。
二、选择题:每小题有一个或两个选项符合题意。
8.(2020·临沂高三统考)下列制取NH3并验证其还原性、收集并进行尾气处理的装置和原理均正确的是( )
解析:选B。氯化铵受热分解生成氨和氯化氢,但在试管口又重新化合生成氯化铵,得不到氨,A项错误;氨具有还原性,氯气具有强氧化性,二者能发生氧化还原反应,又因为氨的密度小于空气的,氯气的密度大于空气的,所以长管通入NH3,短管通入Cl2,可以使其充分反应,装置和原理均正确,B项正确;氨的密度小于空气的,采用向下排空气法收集,即收集时应该是短管进、长管出,C项错误;氨极易溶于水,倒置的漏斗插入水中,不能防倒吸,D项错误。
9.下列关于浓硝酸和浓硫酸的叙述中,正确的是( )
A.常温下都用铜制容器贮存
B.露置在空气中,容器内酸液的质量都减轻
C.常温下都能与铜较快地反应
D.露置在空气中,容器内酸液的浓度都降低
解析:选D。Cu与浓HNO3可在常温下反应,Cu与浓H2SO4需加热才反应,故浓HNO3不能用铜制容器贮存;将二者都露置在空气中,硝酸挥发,浓H2SO4吸收空气中的水分,故酸液的浓度都降低,但酸液的质量变化不同,浓HNO3减轻,浓H2SO4增重。
10.(2020·济宁高三模拟)合成氨及其相关工业中,部分物质间的转化关系如图所示。下列说法不正确的是( )
A.甲、乙、丙三种物质中都含有氮元素
B.反应Ⅱ、Ⅲ和Ⅳ的氧化剂相同
C.Ⅵ的产物可在上述流程中被再次利用
D.Ⅴ中发生反应:NH3+CO2+H2O+NaCl===NaHCO3↓+NH4Cl
解析:选B。甲是N2,N2与H2化合生成NH3。反应Ⅴ是侯氏制碱法原理,丁是NaHCO3,NaHCO3受热分解生成Na2CO3。NH3发生催化氧化生成NO,NO与O2反应生成NO2,NO2溶于水生成HNO3,HNO3和NH3反应生成NH4NO3,即乙是NO,丙是NO2。甲、乙、丙三种物质中都含有氮元素,A正确;反应Ⅳ中的氧化剂和还原剂均是NO2,B错误;NaHCO3分解生成的CO2可以循环利用,C正确。
11.某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示:
实验1
实验2
①③中溶液呈蓝色,试管口有红棕色气体产生
⑥中溶液呈蓝色,试管口有红棕色气体产生
下列说法正确的是( )
A.稀硝酸一定被还原为NO2
B.②中溶液存在:2c(Cu2+)+c(H+)=c(NO)+c(OH-)
C.由上述实验得出结论:常温下,Cu既可与稀硝酸反应,也可与稀硫酸反应
D.③⑥中反应的离子方程式:3Cu+2NO+8H+===3Cu2++2NO↑+4H2O
解析:选BD。A项,稀硝酸与铜发生3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O反应,生成硝酸铜溶液为蓝色,试管口NO被空气中的O2氧化生成红棕色的二氧化氮,但硝酸被还原生成NO,故A错误;B项,②中溶液存在电荷守恒:2c(Cu2+)+c(H+)=c(NO)+c(OH-),故B正确;C项,由实验可得出结论:常温下Cu可以和稀硝酸反应,但不能与稀硫酸反应,故C错误;D项,③⑥中反应的离子方程式:3Cu+2NO+8H+===3Cu2++2NO↑+4H2O,故D正确。
三、非选择题
12.(教材改编题)如图是氮元素的几种价态与物质类别的对应关系,回答下列问题:
(1)写出N2的一种用途:_____________________________________________。
(2)从N元素的化合价分析,N2具有氧化性和还原性,各举一例说明(用化学方程式表示)。
氧化性:_____________________________________________________________;
还原性:______________________________________________________________。
(3)HNO3与物质C常用于检验Cl-的存在,则物质C的化学式为________。
(4)实验室制取物质B的化学方程式为_____________________________________。
(5)NO2与水反应生成物质A的化学方程式为_______________________________。
(6)浓硝酸与木炭在加热条件下反应的化学方程式为_________________________。
答案:(1)做保护气、保存粮食(写出一种即可)
(2)N2+3H22NH3(或N2+3MgMg3N2) N2+O22NO
(3)AgNO3
(4)Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O
(5)3NO2+H2O===2HNO3+NO
(6)4HNO3(浓)+CCO2↑+4NO2↑+2H2O
13.甲、乙两同学用下图所示装置进行实验,探究硝酸与铁反应的产物。
已知:ⅰ.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、-3价等氮的化合物。
ⅱ.FeSO4+NOFe(NO)SO4(棕色)(ΔH<0)。
ⅲ.NO2和NO都能被KMnO4氧化吸收。
甲的实验操作和现象记录如下:
实验操作
实验现象
打开弹簧夹,通入一段时间CO2,关闭弹簧夹
-
打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞
无明显现象
加热烧瓶,反应开始后停止加热
①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅;B中溶液呈棕色;C中溶液紫色变浅;
②反应停止后,A中无固体剩余
请回答下列问题:
(1)滴入浓硝酸加热前没有明显现象的原因是_________________________________。
(2)检验是否生成-3价氮的化合物,应进行的实验操作是_____________________。
(3)甲取少量B中溶液,加热,实验现象是__________________________________。
请用平衡移动原理解释原因:_____________________________________________。
甲依据该现象得出的结论是A中有NO生成。
(4)乙认为甲得出A中有NO生成的证据不足。为获取充足的证据,乙仍采用该装置和操作进行对照实验,乙做出的改变是________________________,证明有NO生成的实验现象是_______________________________________________________________________。
解析:(1)常温下,铁遇浓硝酸发生钝化。(2)-3价氮的化合物是NH3或铵盐,而此反应的环境呈酸性,故-3价氮的化合物应是硝酸铵,可利用NH与OH-共热产生NH3的性质检验。(3)B中发生反应FeSO4+NOFe(NO)SO4(棕色),加热后,上述平衡逆向移动,无色气体NO逸出,在空气中变为红棕色,而溶液颜色变浅或变为浅绿色。(4)NO2与水反应生成NO,故可把浓硝酸换成稀硝酸,若A中无红棕色气体生成,但B中溶液变为棕色,可证明A中有NO生成。
答案:(1)常温时,铁遇浓硝酸形成致密氧化膜,阻止反应进一步发生(答钝化也可)
(2)取少量反应后A中溶液于试管中,向其中加入足量浓NaOH溶液,加热,用湿润的红色石蕊试纸靠近试管口,若试纸变蓝,则A中生成NH
(3)棕色溶液颜色变浅(或变为浅绿色),有无色气体逸出,且在空气中变为红棕色 FeSO4+NOFe(NO)SO4(棕色) ΔH<0,正反应为放热反应,加热后,平衡向逆反应方向移动
(4)将浓硝酸换成稀硝酸 A中没有红棕色气体生成,B中溶液变为棕色
14.(2020·衡水中学模拟)利用如图装置进行NH3与金属氧化物MxOy反应生成M、N2和H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。
(1)仪器a的名称为______,仪器b中装入的试剂可以是__________。
(2)按气流方向正确的装置连接顺序为____________(填字母,装置可重复使用)。
(3)装置C的作用:______________________________。
(4)实验结束时,应首先______(填“Ⅰ”或“Ⅱ”);这样做的原因是_____________。
Ⅰ.熄灭A装置的酒精灯
Ⅱ.停止从a中滴加液体
(5)若金属氧化物为CuO,反应的化学方程式为______________________________。
(6)若实验中准确称取金属氧化物的质量为m g,完全反应后,测得生成水的质量为n g,则M的相对原子质量为________(用含x、y、m、n的式子表示)。
(7)某同学仔细分析上述装置后认为仍存在缺陷,你认为该如何改进?
________________________________________________________________________。
答案:(1)分液漏斗 NaOH固体(或生石灰或碱石灰)
(2)BDADC (3)尾气处理,吸收未反应的NH3,同时防止空气中的水蒸气进入装置D产生干扰 (4)Ⅰ 使反应产生的水蒸气全部被碱石灰吸收 (5)2NH3+3CuO3Cu+N2+3H2O (6) (7)在吸收尾气的浓硫酸前加安全瓶防倒吸