- 1.52 MB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
山东省青岛市2020届高三下学期统一质量检测
可能用到的相对原子质量:H 1 C 12 O 16 59 64
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.化学与生产和生活密切相关。下列过程中没有发生化学变化的是( )
A.液态植物油制成人造奶油 B.无定形硅应用于光伏发电
C.“84”消毒液用于杀灭新型冠状病毒 D.煤经过汽化、液化得到清洁燃料
2.代表阿伏加德罗常数的值,下列叙述正确的是( )
A.1mol 中含有个
B.4.6g分子式为的有机物中碳氢键数目一定是
C.电解精炼铜中转移1mol电子,阳极质量减少32g
D.将含0.1mol的饱和溶液滴入沸水中,形成的胶体粒子的数目少于
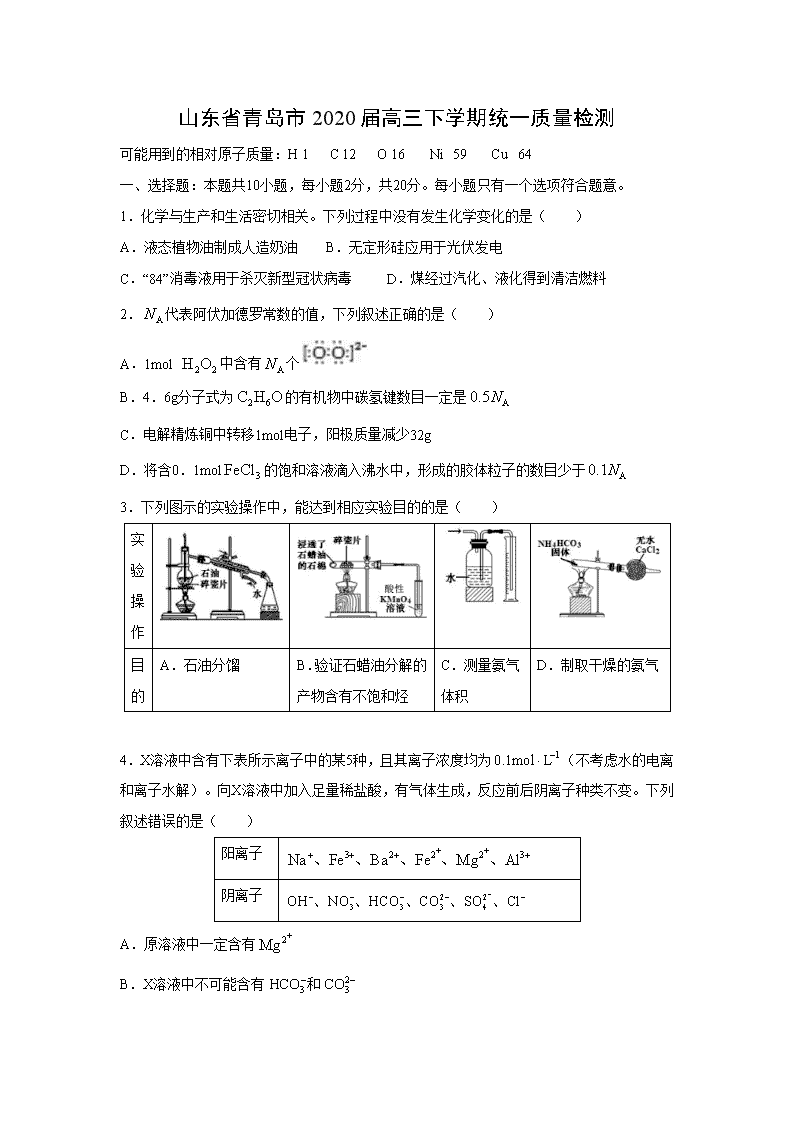
3.下列图示的实验操作中,能达到相应实验目的的是( )
实验操作
目的
A.石油分馏
B.验证石蜡油分解的产物含有不饱和烃
C.测量氨气体积
D.制取干燥的氨气
4.X溶液中含有下表所示离子中的某5种,且其离子浓度均为(不考虑水的电离和离子水解)。向X溶液中加入足量稀盐酸,有气体生成,反应前后阴离子种类不变。下列叙述错误的是( )
阳离子
阴离子
A.原溶液中一定含有
B.X溶液中不可能含有和
C.X溶液中含有3种阳离子、2种阴离子
D.生成气体的离子反应方程式为
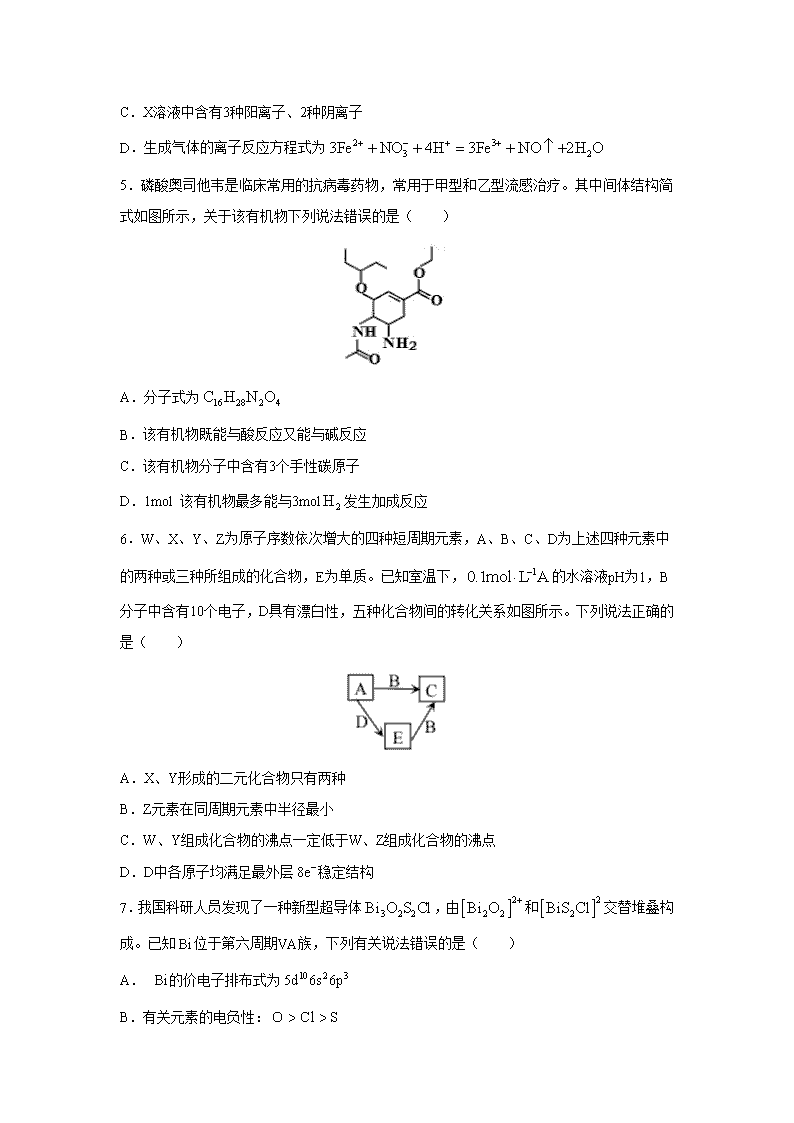
5.磷酸奥司他韦是临床常用的抗病毒药物,常用于甲型和乙型流感治疗。其中间体结构简式如图所示,关于该有机物下列说法错误的是( )
A.分子式为
B.该有机物既能与酸反应又能与碱反应
C.该有机物分子中含有3个手性碳原子
D.1mol 该有机物最多能与3mol发生加成反应
6.W、X、Y、Z为原子序数依次增大的四种短周期元素,A、B、C、D为上述四种元素中的两种或三种所组成的化合物,E为单质。已知室温下,的水溶液pH为1,B分子中含有10个电子,D具有漂白性,五种化合物间的转化关系如图所示。下列说法正确的是( )
A.X、Y形成的二元化合物只有两种
B.Z元素在同周期元素中半径最小
C.W、Y组成化合物的沸点一定低于W、Z组成化合物的沸点
D.D中各原子均满足最外层稳定结构
7.我国科研人员发现了一种新型超导体,由和交替堆叠构成。已知位于第六周期VA族,下列有关说法错误的是( )
A. 的价电子排布式为
B.有关元素的电负性:
C. 属于含共价键的离子化合物
D.该新型超导体的组成元素全部位于元素周期表p区
8.某二元醇的结构简式为,关于该有机物的说法错误的是( )
A.用系统命名法命名:5-甲基-2,5-庚二醇
B.该有机物通过消去反应能得到6种不同结构的二烯烃
C.该有机物可通过催化氧化得到醛类物质
D.1mol 该有机物能与足量金属反应产生
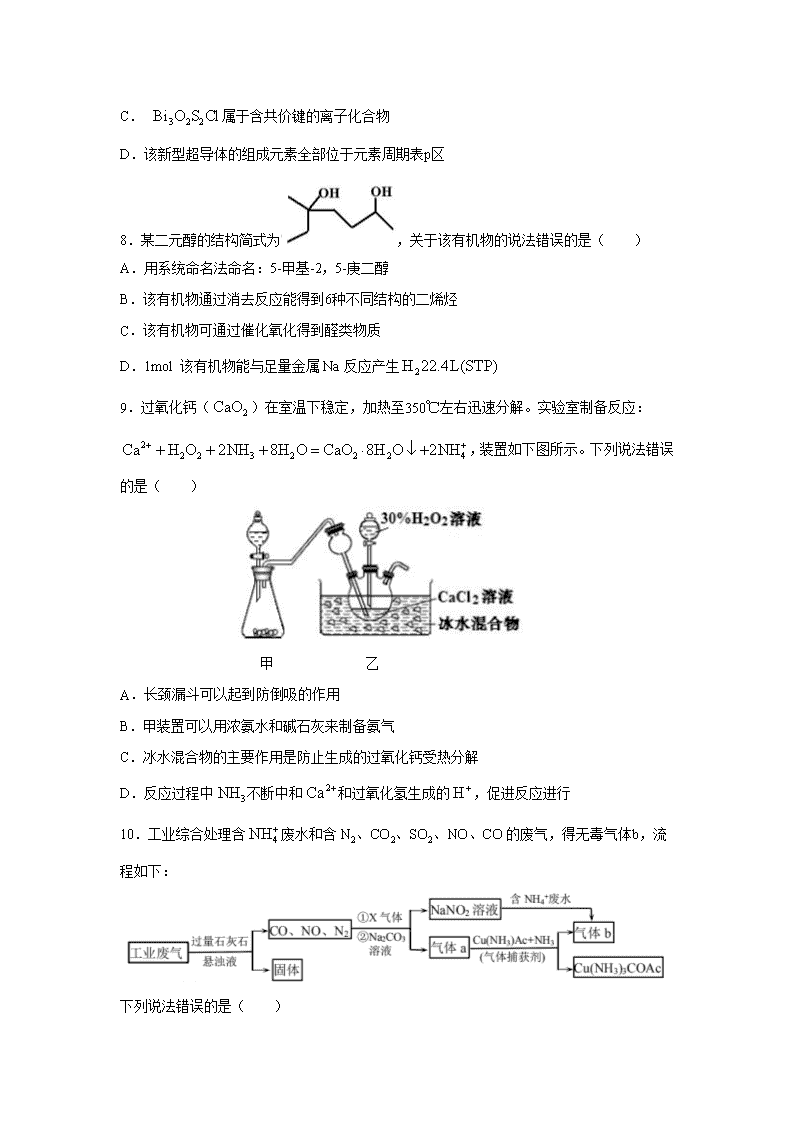
9.过氧化钙()在室温下稳定,加热至350℃左右迅速分解。实验室制备反应:,装置如下图所示。下列说法错误的是( )
甲 乙
A.长颈漏斗可以起到防倒吸的作用
B.甲装置可以用浓氨水和碱石灰来制备氨气
C.冰水混合物的主要作用是防止生成的过氧化钙受热分解
D.反应过程中不断中和和过氧化氢生成的,促进反应进行
10.工业综合处理含废水和含的废气,得无毒气体b,流程如下:
下列说法错误的是( )
A.“固体”中主要含有、
B.X气体、与溶液的离子反应:
C.处理含废水时,离子反应:
D.捕获剂捕获气体a中发生了氧化还原反应
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全都选对得4分,选对但不全的得1分,有选错的得0分。
11.以为原料,采用电解法制备电源TMAH[化学式]是一种高效、绿色工艺技术。原理如图,M、N是离子交换膜。下列说法错误的是( )
A.a是电源正极
B.M为阴离子交换膜
C. 中C、N原子均为杂化
D.通过1mol电子时,电解池中可产生16.8L(STP)气体
12.氯化亚铜为白色粉末状固体,难溶于水和乙醇,潮湿时易被氧化,可用作催化剂、杀菌剂、媒染剂等。工业以硫化铜精矿为原料,制备氯化亚铜的流程如下:
下列说法正确的是( )
A.步骤①焙烧产生的有毒气体可用碱液吸收
B.步骤②所用硫酸浓度越大浸出速率越快
C.步骤③离子方程式:
D.步骤④用乙醇洗涤的目的是使尽快干燥,防止被空气氧化
13.配制银氨溶液操作如图所示,下列说法错误的是( )
已知:
A.制得的银氨溶液可用于还原性糖的检验
B. 中含有个键
C.银氨溶液不能长期存放,需要现用现配
D.固体可溶于氨水得到银氨溶液
14.室温,将10mL浓度为的、两种一元碱溶液分别加水稀释,曲线如图,V是溶液体积(mL),。已知:;。下列说法正确的是( )
A.该温度下,的数量级为
B.当时,水的电离程度:
C.用等浓度盐酸分别滴定两种碱溶液至,消耗盐酸的体积:
D.等浓度的和两种盐溶液中离子总浓度相等
15.Zewail创立的飞秒()化学研究了极短时间内的反应历程,巧妙地解决了如何确定反应起点问题。例如与的反应过程片段为:。下列有关说法正确的是( )
A.中间产物属于有机化合物
B.反应起点为离解为H和I自由基,终点为自由基与I自由基结合
C. 经1000fs离解为自由基和,说明与的反应速率极快
D.飞秒化学展现的反应历程为“化学反应实质是旧键断裂和新键形成”提供有力证据
三、非选择题:本题共5小题,共60分。
16.(12分)医用酒精在抗击“新型冠状病毒”战役中发挥着杀菌消毒的作用,其主要成分是乙醇。回答下列问题:
I.工业上主要采用乙烯直接水合法制乙醇。
(1)在磷酸/硅藻土催化剂作用下,乙烯进行气相水合的反应机理大致如下:
i.
ii.
iii.
随着反应进程,该过程能量变化如图16-1所示。
下列有关说法正确的是_______(填字母标号,下同)。
a.该反应过程中i~iii步均释放能量
b.第i步反应的活化能最大,决定总反应速率
c. 和是反应的中间产物
(2)已知:的反应速率表达式为,,其中、为速率常数。若其他条件不变时,降低温度,则下列推断合理的是_______。
a. 增大,减小 b. 减小,增大
c. 减小的倍数大于 d. 减小的倍数小于
Ⅱ.工业用二氧化碳加氢可合成乙醇:
保持压强为5MPa,向密闭容器中投入一定量和发生上述反应,的平衡转化率与温度、投料比的关系如图所示。
(1)投料比由大到小的顺序为_________________________。
(2)若投料比,一定温度下发生反应,下列说法不能作为反应是否达平衡判据的是_______(填标号。
a.容器内气体密度不再变化
b.容器内气体平均相对分子质量不再变化
c. 的体积分数不再变化
d.容器内不再变化
e.断裂个H—H键的同时生成个水分子
(3)若,则A点温度下,该反应的平衡常数的数值为_______(是以分压表示的平衡常数);若其他条件不变,A点对应起始反应物置于某刚性密闭容器,则平衡时的转化率___________50%(填“>”、“=”或“<”)。
17.(12分)化学小组为探究在酸性溶液中的反应,利用如图装置进行实验:
甲 乙 丙 丁 戊
I.排出装置内的空气。减缓的流速,向丁装置中通入和的混合气体。
Ⅱ.一段时间后,溶液变黄并出现浑浊。摇动锥形瓶、静置,苯与溶液边缘呈紫红色。
Ⅲ.持续向丁装置中通入和混合气体,溶液变为无色。
Ⅳ.再静置一段时间,取锥形瓶中水溶液,滴加溶液,产生白色沉淀。
回答下列问题:
(1)苯的作用为_________________________________________。排出装置内空气的具体操作为__________________________________________。
(2)向装置丁中缓慢通入的作用是_________________________________________。
(3)步骤Ⅱ反应的离子方程式为_________________________________________;步骤Ⅲ反应的离子方程式为____________________________________。
(4)实验的总反应为___________________,和在反应中的作用为___________。
18.(13分)第Ⅷ族元素、、性质相似,称为铁系元素,主要用于制造合金。
回答下列问题:
(1)基态原子核外能量最高的电子位于_______能级,同周期元素中,基态原子未成对电子数与相同的元素名称为______________。
(2)与酚类物质的显色反应常用于其离子检验,已知遇邻苯二酚()和对苯二酚()均显绿色。邻苯二酚的熔沸点比对苯二酚__________(填“高”或“低”),原因是__________________________________________________。
(3)有历史记载的第一个配合物是(普鲁士蓝),该配合物的内界为__________。
右表为、不同配位数时对应的晶体场稳定化能(可衡量形成配合物时,总能量的降低)。由表可知,比较稳定的配离子配位数是__________(填“4”或“6”,性质活泼,易被还原,但很稳定,可能的原因是________________。
离子
配位数
晶体场稳定化能(Dq)
6
-8Dq+2p
4
-5.34Dq+2p
6
-12Dq+3p
4
-3.56Dq+3p
(4)晶体结构中阴阳离子的配位数均为6,则晶胞的俯视图可能是_______(填选项字母)。若晶胞参数为apm,阿伏加德罗常数的值为,晶体的密度是________。
A B C D
19.(11分)废旧锂离子电池正极材料的主要成分为碳棒和,另含少量、杂质。某厂按如下流程对废旧锂离子电池的正极进行回收再生。回答有关问题:
已知:①草酸电离常数:,;草酸的酸式盐以及草酸锂均可溶。
②常温时,有关物质Ksp如下表(单位略):
(1)通入空气,800℃焙烧目的是___________________________。
(2)已知中、、化合价相同,则它们的化合价为_________。
(3)加入草酸加热时,、、元素部分转化为、、沉淀,而另一部分以草酸的酸式盐形式进入溶液。写出与草酸反应生成沉淀的化学方程式_______________________________________。
(4)焙烧后黑色粉的平均粒度(颗粒直径表示)与的浸出率关系如图所示,原因是________________________________________________。
(5)滤液1加调pH为4~5目的是_____________________。
(6)滤液2调时,溶液中___________。
20.(12分)高分子化合物G()是一种重要的合成聚酯纤维,其合成路线如下:
已知:
1.
2.
(1)F的结构简式为_______________,①的反应类型为______________,E中官能团名称为______________,⑤的反应方程式为__________________________________。
(2)写出符合下列条件E的同分异构体______________(填结构简式,不考虑立体异构)。
①含有苯环,遇溶液不变色
②能发生银镜反应
③核磁共振氢光谱图峰面积之比为1:3:6:6
(3)判断化合物E中有无手性碳原子,若有,用“*”标出。
(4)写出以1,3-丙二醇和甲醇为原料制备的合成路线(其它试剂任选)。
_______________________________________________________________________________
【参考答案】
1
2
3
4
5
6
7
8
B
D
B
C
D
B
A
C
9
10
11
12
13
14
15
C
D
CD
AD
D
AB
BD
16.(12分)
I.(1)bc(2分) 2)d(2分)
Ⅱ.(1) (2分)(2)ce(2分) (3)(或)(2分);小于(2分)
17.(12分)
(1)萃取碘单质,隔绝空气防止被氧化(2分);
关闭,打开,打开(或打开,关闭,打开)(1分)
(2)防止倒吸(1分)
(3)(2分);(2分)
(4)(2分);催化剂(2分)
18.(13分)
(1)3d(1分);钛、锗、硒(2分)
(2)低(1分),邻苯二酚形成分子内氢键,比对苯二酚易形成的分子间氢键作用力小,熔沸点低。(1分)
(3)(1分);6(1分);形成配位键后,三价钻的氧化性减弱,性质变得稳定。(2分)
(4)CD(2分);(2分)
19.(11分)
(1)除去正极材料中的碳(2分)(2)+3(1分)
(3)(2分)
(或)
(4)粒度越大,表面积(比表面积)越小,反应物接触面积就越小,反应速率越慢,且反应不充分。(2分)
(5)使和转化为氢氧化物沉淀除去(2分) (6)(2分)
20.(12分)
(1)(2分)加成反应(1分)酯基、羧基(1分)
(2分)
(2)(2分)
(3)(1分)
(4)
(3分)