- 182.00 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2017-2018学年山东省枣庄市第三中学高二第六学段学情调查(1月)化学试题
相对原子质量:C-12 N-14 O-16 Na-23 Mg-24 Al-27 S-32 Cl-35.5 K-39 Fe-56
第Ⅰ卷选择题(共44 分)
一、选择题(每小题只有一个选项符合题意,每题2分)
1.下列与化学反应能量变化相关的叙述正确的是( )
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2 (g) +Cl2(g)=2HCl(g) 在光照和点燃条件下的△H 不同
2.能促进水的电离,并使溶液中C(H+)> C(OH-)的操作是( )
(1) 将水加热煮沸 (2) 向水中投入一小块金属钠 (3) 向水中通HCl (4) 向水中通NH3
(5) 向水中加入明矾晶体 (6) 向水中加入NaHCO3固体 (7) 向水中加KHSO4固体
A.(1) (3) (6) (7) B.(1) (3) (6) C.(5) (7) D.(5)
3.下列物质加入水中,能使水的电离程度增大,溶液的PH减小的是( )
A.CH3COOH B.AlCl3 C.NaHS D.NH3·H2O
4.常温下,对下列电解质溶液的有关说法正确的是( )
A.相同浓度和体积的强碱和强酸溶液混合后,溶液的PH一定等于7
B.在NaHCO3 溶液中,c(CO32-)>c(HCO3-)
C.在有AgCl沉淀的溶液中加入NaCl 固体,c(Ag+)减小
D.将pH 相等的CH3COONa和NaOH 溶液稀释相同倍数,CH3COONa溶液的pH较小
5.下列有关金属腐蚀与防护的叙述错误的是( )
A.生铁的抗腐蚀能力比纯铁弱
B.用锡焊接的铁质器件,焊接处易生锈
C.将钢闸门与直流电源的正极相连可防止其被腐蚀
D.轮船外壳在海水中锈蚀的主要原因是发生吸氧腐蚀
6.25℃时,将氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是( )
A.[NH4+]=[SO42-] B.[NH4+]>[SO42-] C.[NH4+]<[SO42-] D.[OH-]+[SO42-]=[H+]+[NH4+]
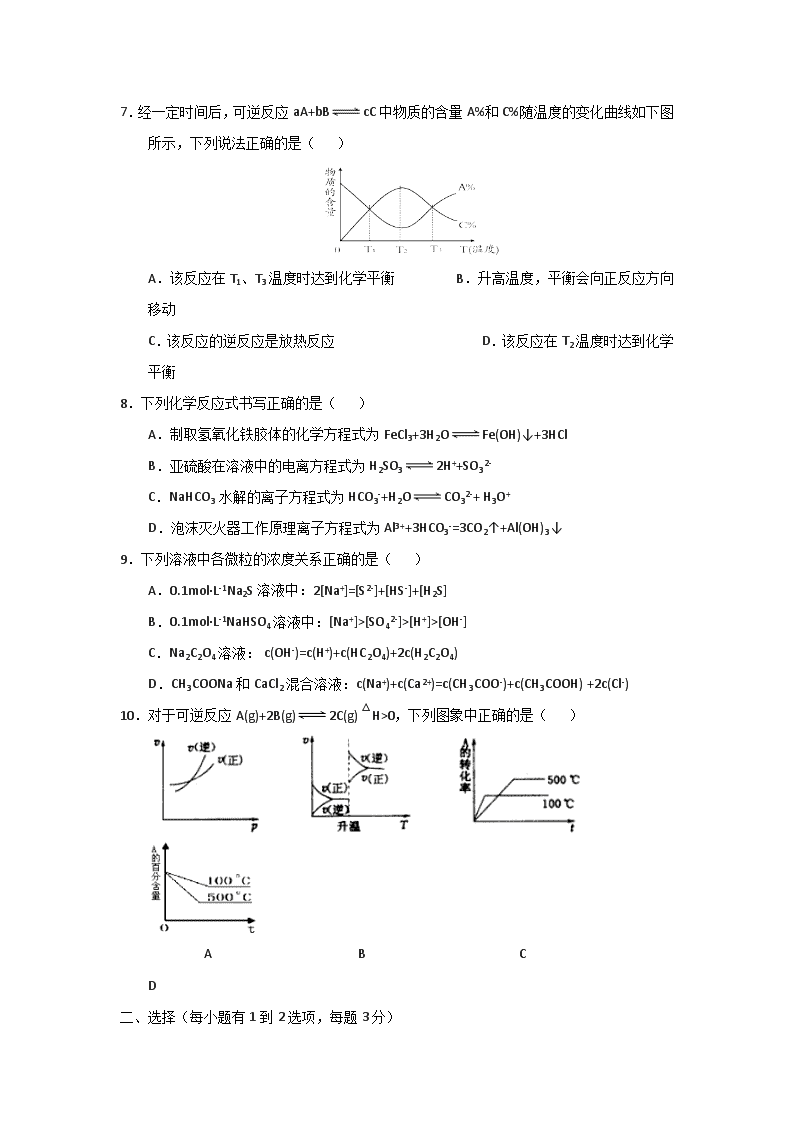
7.经一定时间后,可逆反应aA+bBcC 中物质的含量A%和C%随温度的变化曲线如下图所示,下列说法正确的是( )
A.该反应在T1、T3温度时达到化学平衡 B.升高温度,平衡会向正反应方向移动
C.该反应的逆反应是放热反应 D.该反应在T2温度时达到化学平衡
8.下列化学反应式书写正确的是( )
A.制取氢氧化铁胶体的化学方程式为FeCl3+3H2OFe(OH)↓+3HCl
B.亚硫酸在溶液中的电离方程式为H2SO32H++SO32-
C.NaHCO3 水解的离子方程式为HCO3-+H2OCO32-+ H3O+
D.泡沫灭火器工作原理离子方程式为Al3++3HCO3-=3CO2↑+Al(OH)3↓
9.下列溶液中各微粒的浓度关系正确的是( )
A.0.1mol·L-1Na2S 溶液中:2[Na+]=[S2-]+[HS-]+[H2S]
B.0.1mol·L-1NaHSO4溶液中:[Na+]>[SO42-]>[H+]>[OH-]
C.Na2C2O4溶液: c(OH-)=c(H+)+c(HC2O4)+2c(H2C2O4)
D.CH3COONa 和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH) +2c(Cl-)
10.对于可逆反应A(g)+2B(g)2C(g) △H>0,下列图象中正确的是( )
A B C D
二、选择(每小题有1到2选项,每题3分)
11.爱迪生电池在充电和放电时发生反应:Fe+NiO2+2H2OFe(OH)2+Ni(OH)2 ,下列该蓄电池推断错误的是( )
①放电时,电解质溶波中的阴离子向正极方向移动
②放电时,Fe 参与负极反应,NiO2参与正极反应
③放电时,负极上的电极反应式为: Fe+2H2O-2e-=Fe(OH)2+2H+
④充屯时,阴极上的电极反应式为: Fe(OH)2+2e-=Fe+2OH-
⑤蓄电池的电极必须浸入某种碱性电解质济液中
A.③⑤ B.③④ C.①③ D.①⑤
12.常温下,0.1mol·L-1的HA 溶液中c(OH-)/c(H+)=1×10-8,下列叙述中正确的是( )
A.0.1mol·L-1HA的溶液中c(H+)= 1×10-3mol·L-1
B.pH=3 的HA溶液与pH=11的NaOH溶液等体积混合后所得溶液中c(Na+)>C(A-)>c(OH-)>c(H+)
C.pH=3 的HA溶液与pH=11的NaOH溶液按体积比1∶10混合后所得溶液中c(OH-)+c(A-)= c(H+)+c(Na+)
D.浓度均为0.1mol·L-1的HA 溶液和NaA 溶液等体积混合后所得溶液显酸性,则c(OH-)-c(H+) 0,则金刚石比石墨稳定
B.已知C(s)+O2(g)=CO2(g) △H1 C(s)+ 1/2O2(g)=CO(g); △H2,则△H2>△H1
C.已知2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol
D.已知NaOH(aq) +HCl(aq)=NaCl(aq)+H2O(1)△H=-57.3 kJ/mol,则含20 g NaOH 的稀溶液与稀盐酸完全中和,中和热为28.65 kJ/mol
l5.某度下的密闭容器中发生如下反应:2M(g)+N(g)2E (g),若开始时只充入2 mol E(g),达平衡时,混合气体的压强比起始时增大了20%; 若开始时只充入2 molM 和1mol N 的混合气体,则达平衡时M 的转化率为( )
A.20% B.40% C.60% D.80%
16.下列叙述正确的是( )
A.AlCl3溶液和Al2(SO4)3 溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同
B.配制FeCl3 溶液时,将FeCl3 固体溶解在硫酸中,然后再用水稀释到所需的浓度
C.铁锅生锈的正极反应为: O2+2H2O+4e-=4OH-
D.工业上电解饱和食盐水的阳极反应为: 2H++2e-=H2↑
17.已知室温下,Al(OH)3 的Ksp 远远大于Fe(OH)3 的Ksp。向浓度均为0.1mol·L-1 的Fe(NO3)3 和Al(NO3)3 混合溶液中,逐滴加入NaOH 溶液。下列示意图中表示生成Al(OH)3 的物质的量与加入NaOH 溶液的体积的关系,合理的是( )
A B C D
18.室温下,用相同浓度的NaOH 溶液,分别滴定100mL浓度均为0.1mol·L-1 的三种酸(HM、HN和HR) 溶液,滴定的曲线如图所示,下列判断错误的是( )
A.三种酸的电离常数关系: KHR>KHN>KHM
B.pH=7时,三种溶液中:c (M-) >c (N-)>c (R-)
C.滴定至P点时,溶液中:c (Na+) >c (N-) >c (HN) >c (H+) >c (OH-)
D.当中和百分数达100%时,将三种溶液混合后:c(HM)+c(HN)+c(HR) =C(OH-)-c(H+)
第Ⅱ卷(非选择题共56分)
19.(20 分) 按要求完成下列各小题
(1)25℃时,0.1mol·L-1NH4Cl溶液的pH 7(填“<”、“=”或“ >");
其原因是 (用离子方程式表示);
(2)下列物质能导电且属于电解质的是 (填序号)。
A.铁 B.盐酸 C.氯化钠晶体 D.熔融氢氧化钠
(3) 已知常温下部分弱电解质的电离平衡常数如下表:
化学式
HF
HClO
H2CO3
NH3·H2O
电离常数
6.8×10-4
4.7×10-8
K 1=4.3×10-7
K2=5.6×10-11
Kb=1.7×10-5
常温下,pH 相同的三种溶液①NaF 溶液②NaClO 溶液③Na2CO3 溶液
其物质的量浓度由大到小的顺序是 (填序号)
(4) 25℃时,pH=4 的NH4Cl溶液由水电离的c(OH-)=
(5)0.1mo/L 的NaClO 溶液和0.1mo/L 的NaHCO3 溶液中,c(ClO-) c(HCO3-)( 填“>,<,=”)
可使上述两种溶液pH 相等的方法是 (填代号)
a.向NaClO 溶液中加适量的水
b.向NaClO 溶液中加适量的NaOH
c.向NaHCO3溶液中加适量的水
d.向NaHCO3溶液中加适量的NaOH
(6) 向NaClO 溶液中通入少量的CO2,所发生的离子方程式为 。
(7)常温下,0.1mol/L 的氨水和0.1mo/L 的NH4Cl溶液等体积混合,通过计算判断混合溶液的酸碱性 。
(8)不能证明HA 是弱电解质的方法是( )
A.测得0.1mol/L HA 溶液的pH > 1
B.测得NaA 溶液的pH>7
C.pH=1的HA 溶液与盐酸,稀释100 倍后,盐酸的PH 变化大
D.用足量锌分别和相同pH、相同体积的盐酸和HA 溶液反应,产生的氢气一样多
20.(12 分) 金属铝在现代生产和日常生活中应用广泛。
工业上用电解熔融氧化铝的方法来制取金属铝,纯净氧化铝的熔点很高(约2045℃),在实际生产中,通过加入助熔剂冰晶石(Na3AlF6)在1000℃左右就可以得到熔融体。
反应方程式为2Al2O34Al+3O2↑。
(1) 在电解时阴极的电极反应式 ,阳极的电极反应式 。
(2)对金属制品进行抗腐蚀处理,可延长其使用寿命,以铝材为阳极,在H2SO4溶液中电解,可使铝材表面形成氧化膜,阳极电极反应式为 。在电解过程中,阴极附近溶液的pH (填“增大,减小或不变”)
(3) “863”计划和中科院“百人计划”支持的环境友好型铝碘电池已研制成功,电解质为AlI3溶液,已知电池总反应为2Al+3I2=2AlI3,该电池负极的电极反应为: ,当负极质量减少27g时,在导线有 个电子通过。
21.(12 分) 某研究性学习小组向一定量的NaHSO3溶液(加入少量淀粉) 中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色。为进一步研究有关因素对反应速率的影响,探究如下。
(1) 查阅资料知NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由第一步反应决定。已知第一步反应的离子方程式为IO3-+3HSO3-= 3SO42-+ I-+ 3H+,则第二步反应的离子方程式为 。
(2)通过测定溶液变蓝所用时间来探究外界条作对该反应速率的影响,记录如下。
编号
0.01mol/LNaHSO3溶液/mL
0.01mol/L KIO3溶液/mL
H2O/mL
反应温度/℃
溶液变蓝所用时间t/s
①
6.0
10.0
4.0
15
t1
②
6.0
14.0
0
15
t2
③
6.0
a
b
25
t3
实验①②是探究 对反应速率的影响,表中t1 t2(填“>”、“=”或“<”);实验①③是探究温度对反应速率的影响,表中a= ,b= 。
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率逐渐增大。该小组对其原因提出如下假设,请你完成假设二。
假设一: 生成的SO42-对反应起催化作用;
假设二: ;
……
请你设计实验验证上述假设一,完成下表中内容。
实验步骤(不要求写出具体操作过程)
预期实验现象和结论
在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定起始
时的反应速率v(甲)
在烧杯乙中先加入少量① ,
其他条件与甲完全相同,用速率检测仪
测定起始时的反应速率v(乙)
②若v(甲) v(乙),则假设一不成立
③若v(甲) v(Z),则假设一成立
(填“>”“=”或“<”)
22.(12 分) 接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO2(g)+O2(g) 2SO3(g); △H=-190KJ·mol-1
(1)在一个固定容积为5L 的密闭容器中充入0.20 mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO3 8g,则V(O2)= mol·L-1·min-1,计 算 此 时 化 学平 衡 常 数K1= 。
(2)若温度不变,继续通入0.20molSO2和0.10molSO3,则平衡移动方向及原因是 ,达平衡后,化学平衡常数为K2,则K1、K2间的关系为 (填“>”、“<”或“=”)。
(3)有两只密闭容器A 和B,A能保持恒容,B能保持恒压。起始时向容积相等的A、B 中分别通入体积比为2∶1的等量的SO2和O2,使之发生反应。则(填>、=、<; 左、右; 增大、减小、不变)。
①达到平衡所需要的时间: t(A) t(B)
②平衡时,SO2的转化率: a(A) a(B)
③到平衡时,在两容器中分别通入等量的Ar气。B 中的化学平衡向 反应方向移动,A 中的化学反应速率 。
1-5 CDBCC 6-10 BDDCD 11-15 C AC AB B C 16-18 C D AC
19.(共12 分,每空2 分)(1)pH<7,其原因是NH4++H2O=NH3·H2O+H+
(2)D (3)①>②>③ (4)10-4mo/L (5) <; a,d
(6)ClO-+CO2+H2O=HClO+HCO3-
(7)由NH3·H2O的电离常数Kb=1.7×10-5,可得NH4+ 的水解常数Kh=Kw/Kb=5.9×10-10,因为Kh(1分) 10.0 (1分) 4.0 (1分)
(3) 生成的I-或H+对反应起催化作用(2分)
①Na2SO4粉末(1分)
②= (1分)
③< (1分)
22.(共12 分)
(1)0.02 ; 100 (mol/L)-l (每空2分)
(2)向正反应方向移动,因为此时的浓度商为44.4,小于平衡常数;
=(每空2分)
(3) D>; 2<; 3左;不变(每空1分)