- 658.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
一、选择题:每小题只有一个选项符合题意。
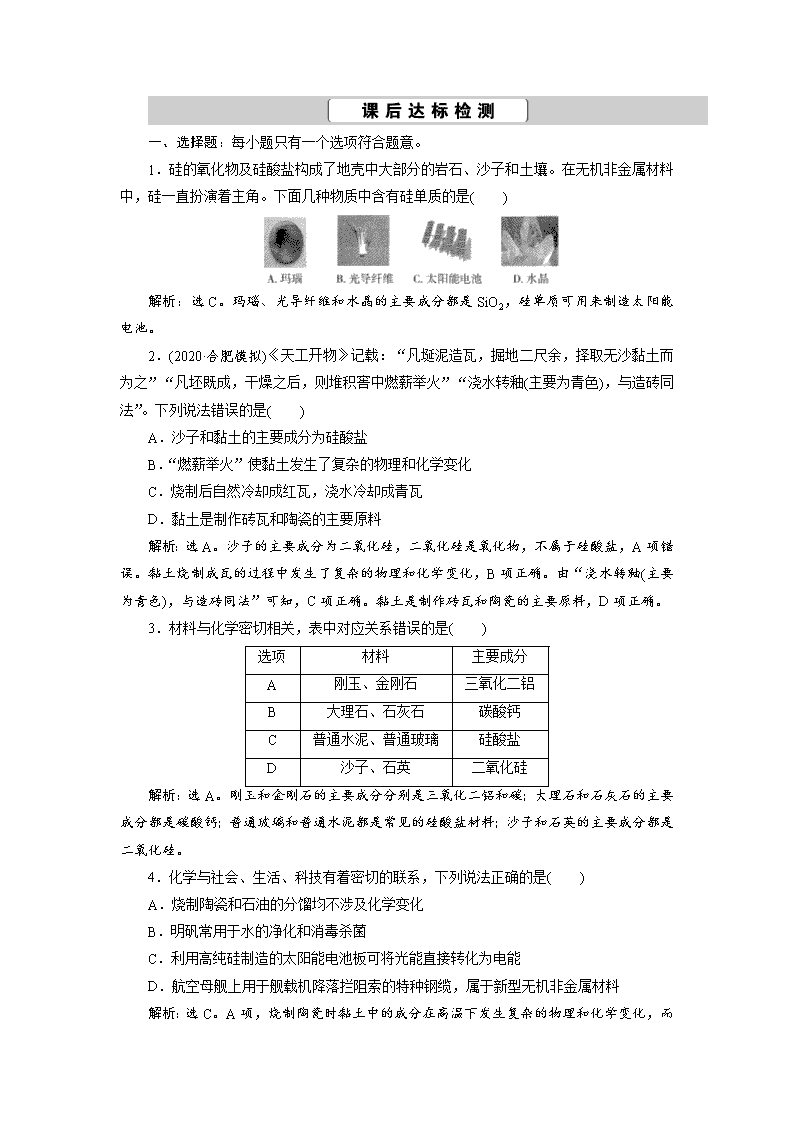
1.硅的氧化物及硅酸盐构成了地壳中大部分的岩石、沙子和土壤。在无机非金属材料中,硅一直扮演着主角。下面几种物质中含有硅单质的是( )
解析:选C。玛瑙、光导纤维和水晶的主要成分都是SiO2,硅单质可用来制造太阳能电池。
2.(2020·合肥模拟)《天工开物》记载:“凡埏泥造瓦,掘地二尺余,择取无沙黏土而为之”“凡坯既成,干燥之后,则堆积窖中燃薪举火”“浇水转釉(主要为青色),与造砖同法”。下列说法错误的是( )
A.沙子和黏土的主要成分为硅酸盐
B.“燃薪举火”使黏土发生了复杂的物理和化学变化
C.烧制后自然冷却成红瓦,浇水冷却成青瓦
D.黏土是制作砖瓦和陶瓷的主要原料
解析:选A。沙子的主要成分为二氧化硅,二氧化硅是氧化物,不属于硅酸盐,A项错误。黏土烧制成瓦的过程中发生了复杂的物理和化学变化,B项正确。由“浇水转釉(主要为青色),与造砖同法”可知,C项正确。黏土是制作砖瓦和陶瓷的主要原料,D项正确。
3.材料与化学密切相关,表中对应关系错误的是( )
选项
材料
主要成分
A
刚玉、金刚石
三氧化二铝
B
大理石、石灰石
碳酸钙
C
普通水泥、普通玻璃
硅酸盐
D
沙子、石英
二氧化硅
解析:选A。刚玉和金刚石的主要成分分别是三氧化二铝和碳;大理石和石灰石的主要成分都是碳酸钙;普通玻璃和普通水泥都是常见的硅酸盐材料;沙子和石英的主要成分都是二氧化硅。
4.化学与社会、生活、科技有着密切的联系,下列说法正确的是( )
A.烧制陶瓷和石油的分馏均不涉及化学变化
B.明矾常用于水的净化和消毒杀菌
C.利用高纯硅制造的太阳能电池板可将光能直接转化为电能
D.航空母舰上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料
解析:选C。A项,烧制陶瓷时黏土中的成分在高温下发生复杂的物理和化学变化,
而石油的分馏是利用物质的沸点不同进行分离的一种实验操作,不涉及化学变化,错误;B项,明矾中的Al3+发生水解生成Al(OH)3胶体,能够吸附水中的颗粒状杂质,达到净化水的目的,但没有消毒杀菌作用,错误;C项,利用高纯硅制造的太阳能电池板可将光能直接转化为电能,正确;D项,航空母舰上用于舰载机降落拦阻索的特种钢缆需要有特别强的韧性和强度,耐高温、抗腐蚀,是一种金属材料,错误。
5.“碳捕捉技术”指的是通过一定的方法将工业生产中产生的CO2分离出来并利用。例如,可利用NaOH溶液来“捕捉”CO2,其基本过程如图所示(部分条件及物质未标出)。
下列有关该方法的叙述中正确的是( )
①能耗大是该方法的一大缺点
②整个过程中,只有一种物质可以循环利用
③“反应分离”环节中,分离物质的基本操作是蒸发结晶、过滤
④该方法可减少碳排放,捕捉到的CO2还可用来制备甲醇等产品
A.①② B.②③
C.③④ D.①④
解析:选D。该方法中高温反应炉分离出CO2,需要消耗较多能量,①正确;整个过程中NaOH和CaO均可循环利用,②错误;从捕捉室中得到的溶液是NaHCO3溶液,加入CaO后生成CaCO3和NaOH,通过过滤的方法即可分离,③错误;捕捉到的CO2可与H2反应制备甲醇:CO2+3H2CH3OH+H2O,④正确。
6.(2020·甘谷第一中学第二次检测)碳循环(如图)对人类生存、发展有着重要的意义。下列说法错误的是( )
A.碳是构成有机物的主要元素
B.光合作用是将太阳能转化为化学能的过程
C.化石燃料的大量燃烧是产生温室效应的原因之一
D.石油的年产量是衡量一个国家石油化工发展水平的标志
解析:选D。有机物一定含有碳元素,所以碳是构成有机物的主要元素,A正确;光合作用是绿色植物将二氧化碳和水合成葡萄糖和氧气的过程,是把太阳能转化为化学能的过程,
B正确;化石燃料中含碳元素,化石燃料的大量燃烧产生的二氧化碳气体是产生温室效应的原因之一,C正确;乙烯的年产量是衡量一个国家石油化工发展水平的标志,D错误。
7.新材料的新秀——石墨烯、氧化石墨烯已成为物理、化学、材料科学研究的国际热点课题。其结构模型如图所示。
下列有关说法正确的是( )
A.石墨烯是一种新型化合物
B.氧化石墨烯即石墨烯的氧化物
C.二者和石墨都是碳的同素异形体
D.氧化石墨烯具有一定的亲水性
解析:选D。石墨烯是碳的单质,不是化合物,A错误;氧化石墨烯因为还含有氢元素,故不是石墨烯的氧化物,也不是碳的同素异形体,B、C错误;由于氧化石墨烯结构中含有羟基和羧基等亲水基团,所以具有一定的亲水性,D正确。
二、选择题:每小题有一个或两个选项符合题意。
8.(2020·济南考试大纲调研卷)工业上制备高纯硅有多种方法,其中的一种工艺流程如下:
已知:流化床反应的产物中,除SiCl4 外,还有SiHCl3、SiH2Cl2、SiH3Cl、FeCl3 等。下列说法正确的是( )
A.电弧炉中发生的反应为C+SiO2CO2↑+Si
B.SiCl4 进入还原炉之前需要经过蒸馏提纯
C.每生产1 mol高纯硅,需要44.8 L(标准状况)Cl2
D.该工艺Si的产率高,符合绿色化学要求
解析:选B。A项,二氧化碳与焦炭在高温下反应生成粗硅和一氧化碳,则电弧炉中发生的反应为2C+SiO22CO↑+Si,选项A错误;B项,在流化床反应器中除SiCl4 外,还有SiHCl3、SiH2Cl2、SiH3Cl、FeCl3 等,故SiCl4在进入还原炉之前需要经过蒸馏提纯,选项B正确;C项,根据转化关系Si→SiCl4→Si,每生产1 mol高纯硅,需要44.8 L(标准状况)Cl2,由于含有其他副反应,消耗Cl2 大于44.8 L,选项C错误;D项,该工艺中产生氯化氢气体且有氯气的参与,容易引起空气污染,不符合绿色化学要求,选项D错误。
9.实验室用H2还原SiHCl3(沸点:31.85 ℃)制备高纯硅的装置如图所示(夹持装置和尾气处理装置略去),下列说法正确的是( )
A.装置Ⅱ、Ⅲ中依次盛装的是浓硫酸、冰水
B.实验时,应先加热管式炉,再打开活塞K
C.为鉴定制得的硅中是否含有微量铁单质,需要用到的试剂为盐酸、双氧水、KSCN溶液
D.该实验中制备氢气的装置也可用于饱和食盐水与电石反应制备乙炔
解析:选C。制备高纯硅的反应为H2+SiHCl3Si+3HCl,此反应应在装置 Ⅳ 中进行。装置 Ⅰ 的目的是制取氢气,氢气中含有水蒸气,对后续实验产生干扰,必须除去,因此装置 Ⅱ 的目的是除去氢气中的水蒸气,即装置 Ⅱ 中盛放浓硫酸;装置 Ⅲ 的目的是使SiHCl3汽化,与氢气充分混合,因此应在热水浴中加热,A项错误;实验时应先打开活塞K,通入氢气,排尽装置中的空气,防止加热时发生爆炸,B项错误;硅不能与盐酸反应,铁与盐酸反应生成Fe2+,Fe2+被H2O2氧化成Fe3+,遇KSCN溶液变红,可以鉴定制得的硅中是否含有铁单质,C项正确;饱和食盐水与电石反应制备乙炔,反应迅速放出大量热且生成微溶的氢氧化钙,因此不能用启普发生器进行实验,D项错误。
10.水玻璃(Na2SiO3溶液)广泛应用于耐火材料、洗涤剂生产等领域,是一种重要的工业原料。如图是用稻壳灰(SiO2:65%~70%、C:30%~35%)制取水玻璃的工艺流程:
下列说法正确的是( )
A.原材料稻壳灰价格低廉,且副产品活性炭有较高的经济价值
B.操作A与操作B完全相同
C.该流程中硅元素的化合价未发生改变
D.反应器中发生的反应为氧化还原反应
解析:选AC。A项,稻壳灰来源广泛价格低廉,活性炭具有吸附性,有较高的经济价值,正确;B项,操作A为过滤,操作B为蒸发浓缩,是两种不同的操作,错误;C项,二氧化硅中硅元素的化合价是+4价,硅酸钠中硅元素的化合价也是+4价,所以该流程中硅元素的化合价没有发生改变,正确;D项,反应器中发生的反应为SiO2+2NaOH===Na2SiO3+H2O,此反应没有化合价的变化,属于非氧化还原反应,错误。
三、非选择题
11.为检验二氧化碳气体中是否混有一氧化碳,某课外兴趣小组的同学设计了如图所示的实验装置。
回答下列问题:
(1)A装置的作用是_______________________________________。
(2)实验后处理尾气的方法为________,发生反应的化学方程式为_______________。
(3)若实验时观察到_____________________________________,则证明原气体中一定含有一氧化碳。
解析:(1)A装置的作用是吸收CO2,以排除对后续实验的干扰。(2)CO有毒,故将CO点燃生成CO2后才能排放到空气中。(3)CO还原CuO的实验现象是黑色粉末变成红色,且生成的气体(CO2)能使澄清石灰水变浑浊。
答案:(1)吸收CO2 (2)点燃 2CO+O22CO2
(3)B中无明显现象,C装置中黑色粉末变成光亮的红色,D中澄清石灰水变浑浊
12.氮化硅可用作高温陶瓷复合材料,在航空航天、汽车发动机、机械等领域有着广泛的应用。由石英砂合成氮化硅粉末的路线如图所示:
其中—NH2中各元素的化合价与NH3相同。请回答下列问题:
(1)石英砂不能与碱性物质共同存放,以NaOH为例,用化学方程式表示其原因:________________________________________________________________________。
(2)图示①~⑤的变化中,属于氧化还原反应的是________。
(3)在反应⑤中,3 mol Si(NH2)4在高温下加热可得1 mol 氮化硅粉末和8 mol A气体,则氮化硅的化学式为________。
(4)在高温下将SiCl4在B和C两种气体的气氛中,也能反应生成氮化硅,B和C两种气体在一定条件下化合生成A。写出SiCl4与B和C两种气体反应的化学方程式:________________________________________________________________________。
解析:(1)石英砂不能与碱性物质共同存放的实质是SiO2与碱性物质可以发生反应。(2)反应①是石英砂与焦炭发生氧化还原反应;反应②是硅单质与Cl2发生氧化还原反应。(3)氮化硅的化学式可通过题目信息运用质量守恒求得:3Si(NH2)4Si3N4+8NH3↑。(4)结合题给信息,SiCl4与N2、H2反应可得到Si3N4和HCl。
答案:(1)SiO2+2NaOH===Na2SiO3+H2O
(2)①② (3)Si3N4
(4)3SiCl4+2N2+6H2Si3N4+12HCl
13.单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度为450~500 ℃),四氯化硅经提纯后用氢气还原可得到高纯硅。以下是实验室制备四氯化硅的装置图:
相关信息如下:
①四氯化硅遇水极易水解。
②硼、铝、铁在高温下均能与氯气直接反应生成相应的氯化物。
③有关物质的物理常数见下表:
物质
SiCl4
BCl3
AlCl3
FeCl3
沸点/℃
57.7
12.8
—
315
熔点/℃
-70.0
-107.2
—
—
升华温度/℃
—
—
180
300
请回答下列问题:
(1)装置A中g管的作用是_____________________________________;装置C中的试剂是________。
(2)甲方案:f接装置Ⅰ;乙方案:f接装置Ⅱ。但是装置Ⅰ、Ⅱ都有不足之处,请你评价后填写下表。
方案
优点
缺点
甲
乙
(3)在上述(2)的评价基础上,请你设计一个合理方案并用文字表述:_____________。
(4)SiCl4与H2反应的化学方程式为_________________________________________。
答案:(1)平衡压强,使分液漏斗中的浓盐酸顺利流下 浓硫酸
(2)
方案
优点
缺点
甲
①收集产品的导管粗,不会堵塞导管
②冷凝产品,减少了产品损失
①空气中的水蒸气进入产品收集装置,使SiCl4水解
②没有尾气处理装置,污染环境
乙
①有尾气处理装置,注重环保
②避免了空气中的水蒸气进入收集装置
①产品易堵塞导管
②没有冷凝装置,产品易损失
(3)在装置Ⅰ的i处接盛有碱石灰的干燥管j
(4)SiCl4+2H2Si+4HCl