- 459.00 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时作业(四十) 化学实验仪器的组合应用
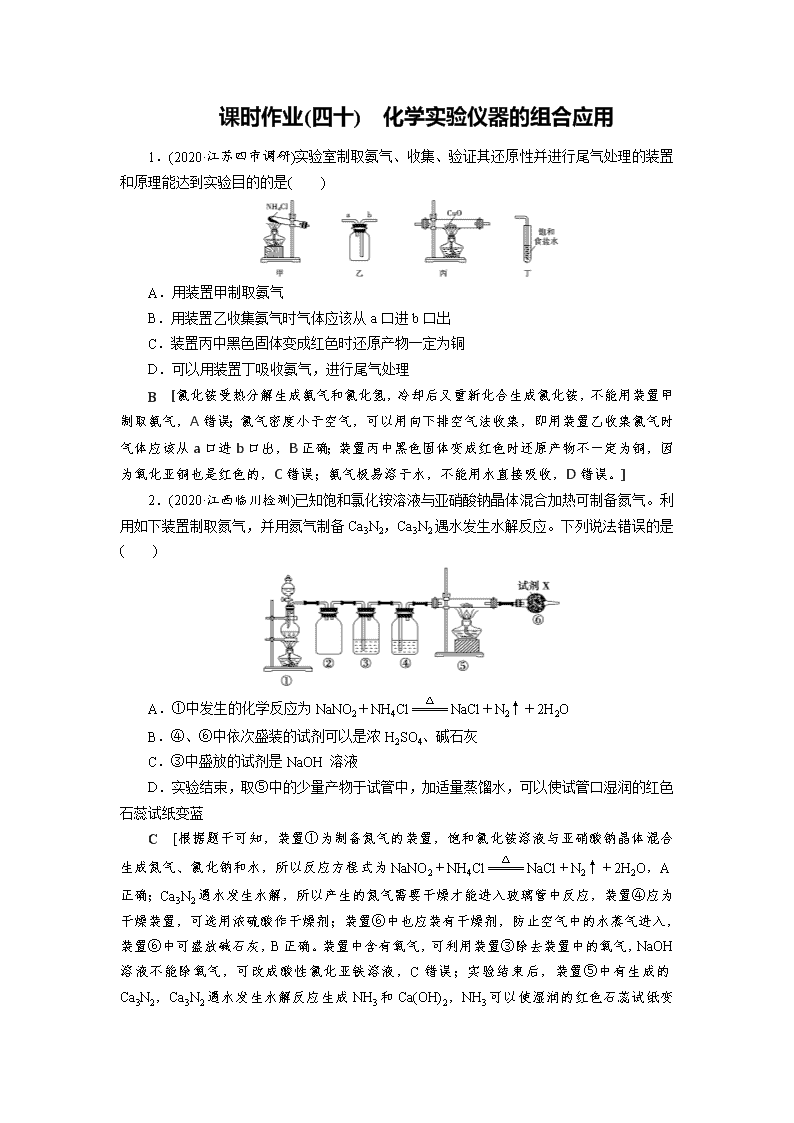
1.(2020·江苏四市调研)实验室制取氨气、收集、验证其还原性并进行尾气处理的装置和原理能达到实验目的的是( )
A.用装置甲制取氨气
B.用装置乙收集氨气时气体应该从a口进b口出
C.装置丙中黑色固体变成红色时还原产物一定为铜
D.可以用装置丁吸收氨气,进行尾气处理
B [氯化铵受热分解生成氨气和氯化氢,冷却后又重新化合生成氯化铵,不能用装置甲制取氨气,A错误;氯气密度小于空气,可以用向下排空气法收集,即用装置乙收集氯气时气体应该从a口进b口出,B正确;装置丙中黑色固体变成红色时还原产物不一定为铜,因为氧化亚铜也是红色的,C错误;氨气极易溶于水,不能用水直接吸收,D错误。]
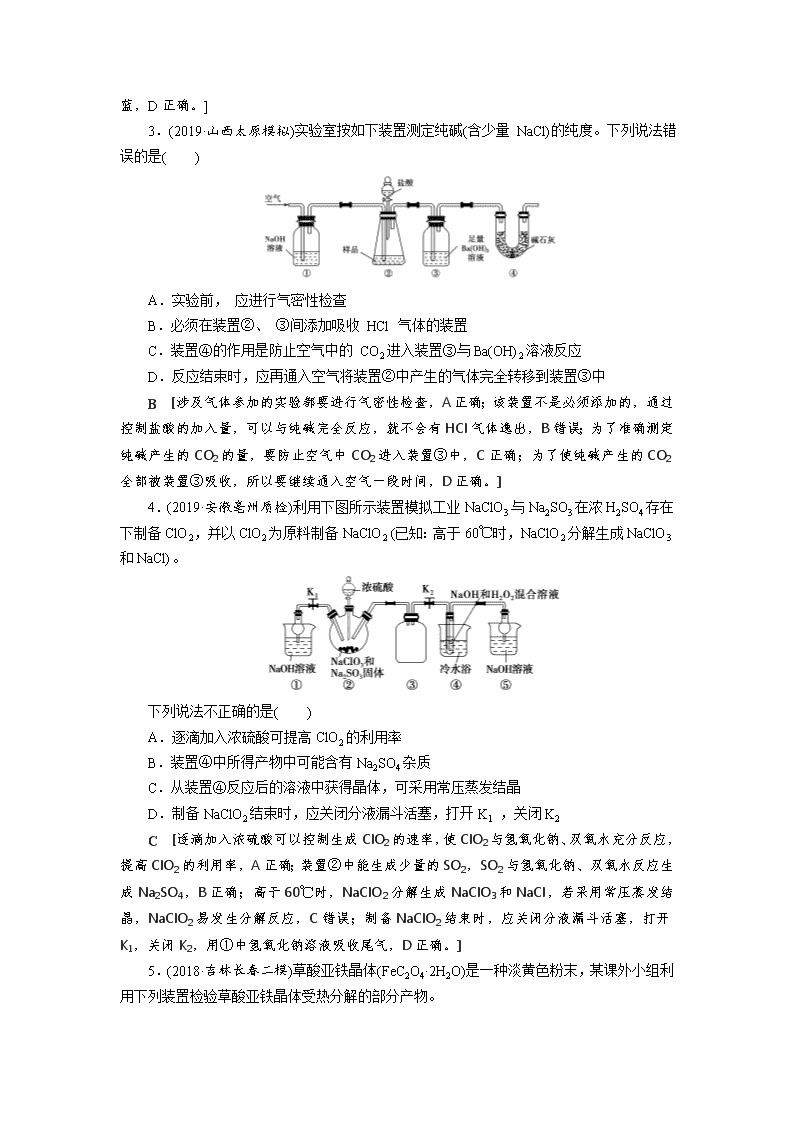
2.(2020·江西临川检测)已知饱和氯化铵溶液与亚硝酸钠晶体混合加热可制备氮气。利用如下装置制取氮气,并用氮气制备Ca3N2,Ca3N2遇水发生水解反应。下列说法错误的是( )
A.①中发生的化学反应为NaNO2+NH4ClNaCl+N2↑+2H2O
B.④、⑥中依次盛装的试剂可以是浓H2SO4、碱石灰
C.③中盛放的试剂是NaOH 溶液
D.实验结束,取⑤中的少量产物于试管中,加适量蒸馏水,可以使试管口湿润的红色石蕊试纸变蓝
C [根据题干可知,装置①为制备氮气的装置,饱和氯化铵溶液与亚硝酸钠晶体混合生成氮气、氯化钠和水,所以反应方程式为NaNO2+NH4ClNaCl+N2↑+2H2O,A正确;Ca3N2遇水发生水解,所以产生的氮气需要干燥才能进入玻璃管中反应,装置④应为干燥装置,可选用浓硫酸作干燥剂;装置⑥中也应装有干燥剂,防止空气中的水蒸气进入,装置⑥中可盛放碱石灰,B正确。装置中含有氧气,可利用装置③除去装置中的氧气,NaOH溶液不能除氧气,可改成酸性氯化亚铁溶液,C错误;实验结束后,装置⑤中有生成的Ca3N2,Ca3N2遇水发生水解反应生成NH3和Ca(OH)2,NH3可以使湿润的红色石蕊试纸变蓝,D正确。]
3.(2019·山西太原模拟)实验室按如下装置测定纯碱(含少量 NaCl)的纯度。下列说法错误的是( )
A.实验前, 应进行气密性检查
B.必须在装置②、 ③间添加吸收 HCl 气体的装置
C.装置④的作用是防止空气中的 CO2进入装置③与Ba(OH)2溶液反应
D.反应结束时,应再通入空气将装置②中产生的气体完全转移到装置③中
B [涉及气体参加的实验都要进行气密性检查,A正确;该装置不是必须添加的,通过控制盐酸的加入量,可以与纯碱完全反应,就不会有HCl气体逸出,B错误;为了准确测定纯碱产生的CO2的量,要防止空气中CO2进入装置③中,C正确;为了使纯碱产生的CO2全部被装置③吸收,所以要继续通入空气一段时间,D正确。]
4.(2019·安徽亳州质检)利用下图所示装置模拟工业NaClO3与Na2SO3在浓H2SO4存在下制备ClO2,并以ClO2为原料制备NaClO2 (已知:高于60℃时,NaClO2分解生成NaClO3和NaCl)。
下列说法不正确的是( )
A.逐滴加入浓硫酸可提高ClO2的利用率
B.装置④中所得产物中可能含有Na2SO4杂质
C.从装置④反应后的溶液中获得晶体,可采用常压蒸发结晶
D.制备NaClO2结束时,应关闭分液漏斗活塞,打开K1 ,关闭K2
C [逐滴加入浓硫酸可以控制生成ClO2的速率,使ClO2与氢氧化钠、双氧水充分反应,提高ClO2的利用率,A正确;装置②中能生成少量的SO2,SO2与氢氧化钠、双氧水反应生成Na2SO4,B正确;高于60℃时,NaClO2分解生成NaClO3和NaCl,若采用常压蒸发结晶,NaClO2易发生分解反应,C错误;制备NaClO2结束时,应关闭分液漏斗活塞,打开K1,关闭K2,用①中氢氧化钠溶液吸收尾气,D正确。]
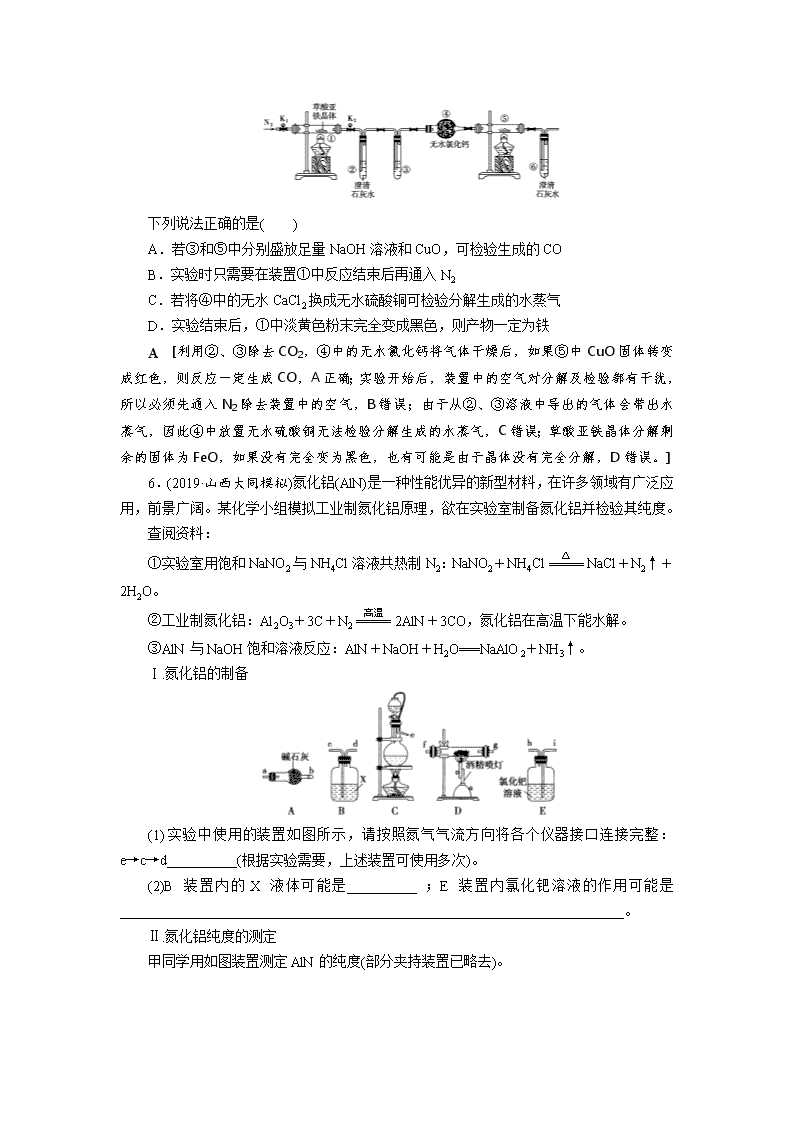
5.(2018·吉林长春二模)草酸亚铁晶体(FeC2O4·2H2O)是一种淡黄色粉末,某课外小组利用下列装置检验草酸亚铁晶体受热分解的部分产物。
下列说法正确的是( )
A.若③和⑤中分别盛放足量NaOH溶液和CuO,可检验生成的CO
B.实验时只需要在装置①中反应结束后再通入N2
C.若将④中的无水CaCl2换成无水硫酸铜可检验分解生成的水蒸气
D.实验结束后,①中淡黄色粉末完全变成黑色,则产物一定为铁
A [利用②、③除去CO2,④中的无水氯化钙将气体干燥后,如果⑤中CuO固体转变成红色,则反应一定生成CO,A正确;实验开始后,装置中的空气对分解及检验都有干扰,所以必须先通入N2除去装置中的空气,B错误;由于从②、③溶液中导出的气体会带出水蒸气,因此④中放置无水硫酸铜无法检验分解生成的水蒸气,C错误;草酸亚铁晶体分解剩余的固体为FeO,如果没有完全变为黑色,也有可能是由于晶体没有完全分解,D错误。]
6.(2019·山西大同模拟)氮化铝(AlN)是一种性能优异的新型材料,在许多领域有广泛应用,前景广阔。某化学小组模拟工业制氮化铝原理,欲在实验室制备氮化铝并检验其纯度。
查阅资料:
①实验室用饱和NaNO2与NH4Cl溶液共热制N2:NaNO2+NH4ClNaCl+N2↑+2H2O。
②工业制氮化铝:Al2O3+3C+N22AlN+3CO,氮化铝在高温下能水解。
③AlN与NaOH饱和溶液反应:AlN+NaOH+H2O===NaAlO2+NH3↑。
Ⅰ.氮化铝的制备
(1)实验中使用的装置如图所示,请按照氮气气流方向将各个仪器接口连接完整:e→c→d__________(根据实验需要,上述装置可使用多次)。
(2)B装置内的X液体可能是__________;E装置内氯化钯溶液的作用可能是________________________________________________________________________。
Ⅱ.氮化铝纯度的测定
甲同学用如图装置测定AlN的纯度(部分夹持装置已略去)。
(3)为准确测定生成气体的体积,量气装置(虚线框内)中的X液体可以是________(填序号,下同)
a.CCl4 b.H2O c.NH4Cl饱和溶液 d.植物油
(4)若装置中分液漏斗与导气管之间没有导管A连通,对所测AlN纯度的影响是________(填“偏大”“偏小”或“不变”)。
(5)用下列仪器也能组装一套量气装置,其中必选的仪器有________。
a.单孔塞 b.双孔塞 c.广口瓶 d.容量瓶 e.量筒 f.烧杯
解析 (1)根据资料①②和C装置、D装置的结构特点可知,C装置是制取氮气的装置,D装置是制取氮化铝的装置,由于氯化铵溶液在加热过程中会逸出氨气和氯化氢,氧化铝可与盐酸反应,再由资料②可知,氮化铝在高温下能水解,所以B装置中的溶液为浓硫酸,可除去氮气中的氨气和水蒸气,A装置可除去氮气中的氯化氢,所以氮气在进入D装置之前要先依次通过B、A装置,为防止E装置中的水蒸气进入D装置,所以在D和E之间加装B(或A)装置,由于D装置中产生了一氧化碳气体,所以E装置是尾气吸收装置,故按照氮气的气流方向各装置的连接顺序为e→c→d→a→b→f(g)→g(f)→a(c)→b(d)→i。
(2)由上述分析可知,A装置是为了除去氮气中的氯化氢气体,B装置是为了除去氮气中的氨气和水蒸气;D装置中反应产生了一氧化碳气体,一氧化碳会污染环境,所以E装置中氯化钯溶液的作用为吸收CO,防止污染。
(3)由资料③可知,氮化铝与氢氧化钠饱和溶液反应生成氨气,要准确测定氨气的体积,则氨气不能溶于量气装置中的液体,氨气极易溶于水,氯化铵饱和溶液中也含有水,所以X溶液不能是水和氯化铵饱和溶液,氨气不溶于四氯化碳和植物油,所以X可以是四氯化碳或植物油,a、d符合题意。
(4)若装置中分液漏斗与导气管之间没有导管A相通,则滴入的氢氧化钠溶液的体积会导致反应装置内的压强增大,从而使排出的气体体积增大,使所测氨气的体积增大,所测氮化铝的纯度偏大。
(5)根据题中的量气装置,可用广口瓶、双孔塞和量筒组装一套量气装置,如图所示。
答案 (1)a→b→f(g)→g(f)→a(c)→b(d)→i (2)浓硫酸
吸收CO,防止污染 (3)ad (4)偏大 (5)bce
7.(2018·东北育才三模)POCl3常用作半导体掺杂剂及光导纤维原料,实验室制备POCl3并测定产品含量的实验过程如下:
I.实验室制备POCl3。采用氧气氧化液态PCl3法制取POCl3,实验装置(加热及夹持仪器略)如图:
资料:①Ag+SCN-===AgSCN↓:Ksp(AgCl)>Ksp(AgSCN);
②PCl3和POCl3的相关信息如下表:
物质
熔点/℃
沸点/℃
相对分
子质量
其他
PCl3
-112.0
76.0
137.5
两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢
POCl3
2.0
106.0
153.5
(1)B中所盛的试剂是________,装置B的作用除干燥氧气外,还有________________________________________________________________________。
(2)POCl3遇水反应的化学方程式为________________________________________。
(3)干燥管的作用是___________________________________________________。
(4)反应温度要控制在60~65℃,原因是:_________________________________________。
(5)POCl3也可以用PCl3、氯气和水为原料,采用氯化水解法制备,写出该制备过程的方程式____________________________________________________,与氯化水解法比较,题中所给方法的优点是______________________________________________________。
Ⅱ.测定POCl3产品的含量。实验步骤:
制备POCl3实验结束后,待三颈瓶中的液体冷却至室温,准确称取30.7g产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00 mL溶液。
②取10.00 mL溶液于锥形瓶中,加入10.00 mL 3.2mol/L AgNO3标准溶液。
③加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
④以X为指示剂,用0.20 mol/L KSCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00 mL KSCN溶液。
(6)步骤③若不加入硝基苯,还可能发生的反应的离子方程式为________________________________________________________________________;
导致测量结果________。(填偏高,偏低,或无影响)
(7)步骤④中X可以选择________。
(8)反应产物中POCl3的质量百分含量为________,通过________(填操作)
可以提高产品的纯度。
解析 (1)由于POCl3遇水剧烈反应生成含氧酸和氯化氢,故参与反应的氧气必须是干燥的,因此B中所盛的试剂是浓硫酸,用来干燥氧气B装置导管和大气相连,则B的作用还有平衡压强、观察O2的流速;
(2)POCl3遇水会发生反应,根据原子守恒可知反应的方程式为POCl3+3H2O===3HCl+H3PO4;
(3)干燥管中碱石灰的作用是吸收多余的未发生反应的氯气,同时防止空气中的水蒸气进入烧瓶而使PCl3水解;
(4)由于温度过低,反应速度太慢;温度过高,PCl3易挥发,利用率低,所以反应温度要控制在60~65℃;
(5)用PCl3、氯气和水为原料采用氯化水解法制备POCl3的化学方程式为PCl3+Cl2+H2O===POCl3+2HCl;实验室采用氧气氧化液态PCl3法制取POCl3的化学方程式为2PCl3+O22POCl3,由此可知该方法制备POCl3的优点是反应物无毒,反应物原子利用率高;
(6)实验过程中加入硝基苯的目的是覆盖氯化银,防止沉淀转化生成AgSCN而导致数据不准确。如无此操作,部分AgCl沉淀会转化为Ag+,使所测Cl元素含量将会偏低;
(7)由于是用KSCN溶液滴定溶液中过量的Ag+,而Fe(SCN)3呈血红色,所以可用含有Fe3+的溶液(为了防止引入氯离子,不能用氯化铁)作指示剂,当溶液中Ag+反应完全后,再滴加的KSCN溶液就会与溶液中的Fe3+作用,使溶液变为血红色,则滴定终点的现象为溶液由无色变为血红色,且30 s不褪色;
(8)根据物质的元素组成及关系式可知POCl3~3HCl~3Ag+,n(Ag+)=0.032 mol-0.002 mol=0.03 mol,n(POCl3)=0.01mol,所以三氯氧磷的含量为×100%=50%;由于POCl3能溶于PCl3,二者在室温下都是液体,而且二者的沸点不同,因此可以通过蒸馏的方法提高产品的纯度。
答案 (1)浓硫酸 平衡压强、观察O2的流速
(2)POCl3+3H2O===H3PO4+3HCl
(3)吸收多余的未发生反应的氯气,同时防止空气中的水蒸气进入三颈烧瓶
(4)温度过低,反应速度太慢;温度过高,PCl3易挥发,利用率低
(5)PCl3+Cl2+H2O===POCl3+2HCl 反应物无毒,反应物原子利用率高
(6)AgCl+SCN-===AgSCN+Cl- 偏低
(7)Fe2(SO4)3 (含三价铁离子的溶液均可)
(8)50% 蒸馏
8.(2019·安徽合肥检测)无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点231.9℃)与Cl2反应制备SnCl4,装置如下图所示。
已知:①SnCl2、SnCl4有关物理性质如下表
物质
颜色、状态
熔点/℃
沸点/℃
SnCl2
无色晶体
246
652
SnCl4
无色液体
-33
114
②SnCl4在空气中极易水解生成SnO2·xH2O。
回答下列问题:
(1)导管a的作用是______________________,装置A中发生反应的离子方程式为__________________________________________。
(2)当观察到装置F液面上方出现____________现象时才开始点燃酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的是________________、_____________。
(3)若上述装置中缺少装置C(其它均相同),则D处具支试管中发生的主要副反应化学方程式为________________________________________________。
(4)可用碘量法测定最后产品的纯度,发生如下反应:Sn2++I2===Sn4++2Iˉ。准确称取该样品m g放于锥形瓶中,用少量浓盐酸溶解,再加水稀释,淀粉溶液作指示剂,用0.1 mol·L-1碘标准溶液滴定至终点,消耗标准液20.00 mL,则产品中SnCl2的含量为________(用含m的代数式表示);即使此法测定的操作均正确,但测得的SnCl4含量仍高于实际含量,其原因可能是_____________________________________________________________ (用离子方程式表示)。
解析 本题考查SnCl4的制备,侧重Cl2的实验室制法,产品的提纯,滴定实验和误差分析。
(1)导管a将分液漏斗与蒸馏烧瓶连接,作用是:平衡压强,使分液漏斗内的液体顺利流下。装置A中KMnO4晶体与浓盐酸反应生成KCl、MnCl2、Cl2和H2O,反应的离子方程 式为:2MnO+10Cl-+16H+===2Mn2++5Cl2↑+8H2O。
(2)由于Sn与空气中的O2反应、SnCl4在空气中极易水解生成SnO2·xH2O,所以制备SnCl4之前用Cl2排尽装置中的空气,观察到装置F液面上方出现黄绿色气体时,表明装置中空气已排尽,开始点燃D处的酒精灯。待Sn熔化后适当增大Cl2流量,继续加热,可加快Cl2与Sn反应的速率,同时使SnCl4气化,利于从混合物中分离出来(根据表中提供的SnCl4、SnCl2的熔沸点分析),在收集器中收集SnCl4。
(3)装置A制得的Cl2中混有HCl和H2O(g),装置B中饱和食盐水的作用是:除去Cl2中的HCl,装置C中浓硫酸的作用是:干燥Cl2;若上述装置中缺少装置C,Cl2中混有H2O(g)
,根据题给已知②“SnCl4在空气中极易水解生成SnO2·xH2O”,D处具支试管中发生的主要副反应为SnCl4+(x+2)H2O===SnO2·xH2O+4HCl。
(4)根据Sn2++I2===Sn4++2I-,n(SnCl2)=n(I2)=0.1 mol/L×0.02 L=0.002 mol,m(SnCl2)=0.002 mol×190 g/mol=0.38 g,产品中SnCl2的含量为×100%=38/m%。即使此法测定的操作均正确,但测得的SnCl4含量高于实际含量,其可能原因是I-被空气中O2氧化成I2,使消耗的碘标准溶液体积偏小,产品中SnCl2含量偏小,SnCl4含量偏高,反应的离子方程式为4I-+4H++O2===2I2+2H2O。
答案 (1)使分液漏斗内的液体顺利流下 2MnO+16H++10Cl-===2Mn2++5Cl2↑+8H2O
(2)黄绿色气体时 加快氯气与锡反应 使SnCl4气化,有利于从混合物中分离出来
(3)SnCl4+(x+2)H2O===SnO2·xH2O+4HCl
(4)38/m% 4I-+O2+4H+===2I2+2H2O