- 216.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
学校:__________姓名:__________班级:__________考号:__________
1、Mg﹣AgCl电池是一种用海水激活的一次电池,在军事上用作电动鱼雷的电源.电池的总反应可表示为:Mg+2AgCl═MgCl2+2Ag下列关于该电池的说法错误的是( )
A.该电池工作时,正极反应为:2AgCl+2e﹣═2C1﹣+2Ag
B.该电池的负极材料可以用金属铝代替
C.有24gMg被氧化时,可还原得到108gAg
D.装备该电池的鱼雷在水中行进时,海水作为电解质溶液
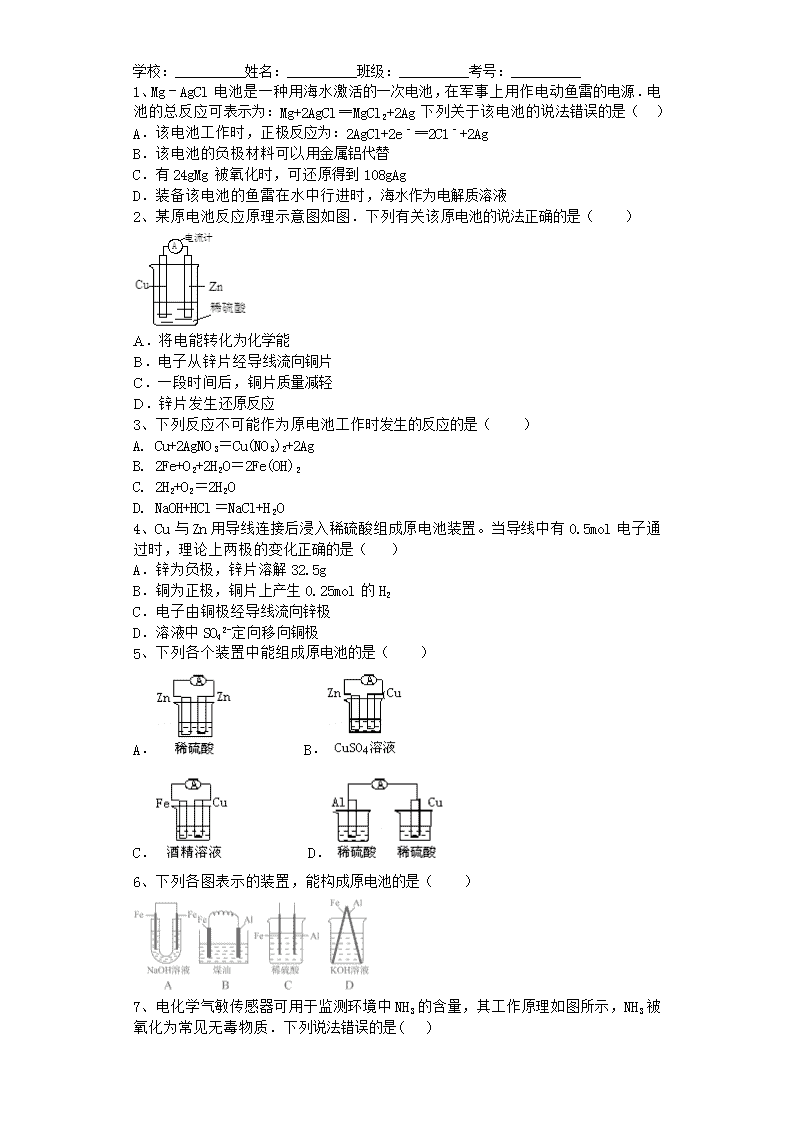
2、某原电池反应原理示意图如图.下列有关该原电池的说法正确的是( )
A.将电能转化为化学能
B.电子从锌片经导线流向铜片
C.一段时间后,铜片质量减轻
D.锌片发生还原反应
3、下列反应不可能作为原电池工作时发生的反应的是( )
A. Cu+2AgNO3=Cu(NO3)2+2Ag
B. 2Fe+O2+2H2O=2Fe(OH)2
C. 2H2+O2=2H2O
D. NaOH+HCl=NaCl+H2O
4、Cu与Zn用导线连接后浸入稀硫酸组成原电池装置。当导线中有0.5mol电子通过时,理论上两极的变化正确的是( )
A.锌为负极,锌片溶解32.5g
B.铜为正极,铜片上产生0.25mol的H2
C.电子由铜极经导线流向锌极
D.溶液中SO42-定向移向铜极
5、下列各个装置中能组成原电池的是( )
A. B.
C. D.
6、下列各图表示的装置,能构成原电池的是( )
7、电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )
A.溶液中K+向电极b移动
B.反应消耗的NH3与O2的物质的量之比为4:5
C.氨气在电极a上发生氧化反应
D.正极的电极反应式为:O2+4e﹣+2H20=4OH﹣
8、有A、B、C、D四种金属.将A与B用导线连接起来浸入电解质溶液中,B不易腐蚀.将A、D分别投入等浓度盐酸溶液中,D比A反应剧烈.将铜浸入B的盐溶液中,无明显变化.如果把铜浸入C的盐溶液中,有金属C析出.据此判断它们的活动性由强到弱的顺序是( )
A.D>C>A>B B.D>A>B>C
C.D>B>A>C D.B>A>D>C
9、有A、B、C、D四块金属片,进行如下实验:
①A、B用导线相连后,同时浸入稀硫酸中,A极为负极;
②C、D用导线相连后,同时浸入稀硫酸中,电流由D→导线→C;
③B、C相连后,同时浸入稀硫酸中,C极产生大量气泡;
④B、D相连后,同时浸入稀硫酸中,D极产生大量气泡.
据此,判断四种金属的活动性顺序是( )
A.A>B>C>D B.A>C>D>B
C.C>A>B>D D.B>D>C>A
10、如图是干电池构造示意图,下列说法错误的是( )
A.最早使用的化学电池是锌锰电池,它是一次性电池
B.电池使用过程中,锌会逐渐溶解:Zn=Zn2++2e﹣
C.锌锰电池即使不用,放置过久,也会失效
D.锌锰干电池内的电解质NH4Cl可以换成HCl溶液
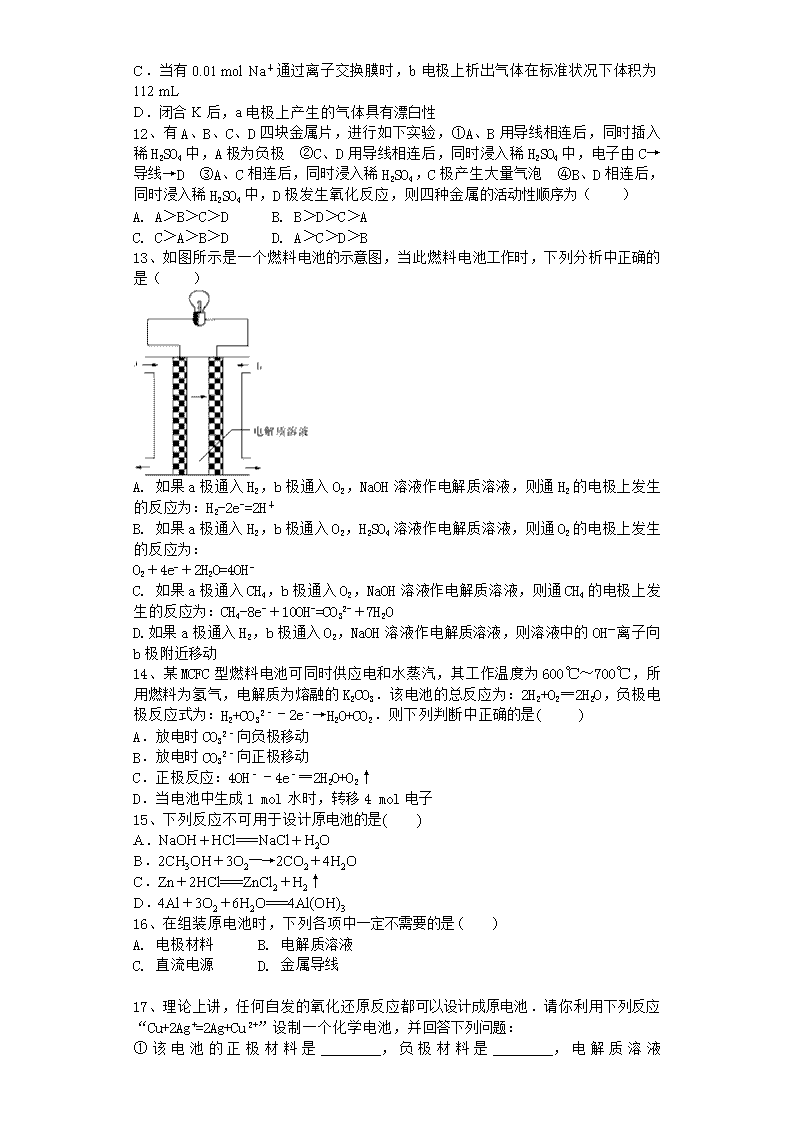
11、如图所示装置Ⅰ是一种可充电电池,装置Ⅱ为电解池。离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3Na2S4+3NaBr。闭合开关K时,b极附近先变红色。下列说法正确的是( )
A.负极反应为4Na-4e-===4Na+
B.闭合K后,b电极附近的pH变小
C.当有0.01 mol Na+通过离子交换膜时,b电极上析出气体在标准状况下体积为112 mL
D.闭合K后,a电极上产生的气体具有漂白性
12、有A、B、C、D四块金属片,进行如下实验,①A、B用导线相连后,同时插入稀H2SO4中,A极为负极 ②C、D用导线相连后,同时浸入稀H2SO4中,电子由C→导线→D ③A、C相连后,同时浸入稀H2SO4,C极产生大量气泡 ④B、D相连后,同时浸入稀H2SO4中,D极发生氧化反应,则四种金属的活动性顺序为( )
A. A>B>C>D B. B>D>C>A
C. C>A>B>D D. A>C>D>B
13、如图所示是一个燃料电池的示意图,当此燃料电池工作时,下列分析中正确的是( )
A. 如果a极通入H2,b极通入O2,NaOH溶液作电解质溶液,则通H2的电极上发生的反应为:H2-2e-=2H+
B. 如果a极通入H2,b极通入O2,H2SO4溶液作电解质溶液,则通O2的电极上发生的反应为:
O2+4e-+2H2O=4OH-
C. 如果a极通入CH4,b极通入O2,NaOH溶液作电解质溶液,则通CH4的电极上发生的反应为:CH4-8e-+10OH-=CO32-+7H2O
D. 如果a极通入H2,b极通入O2,NaOH溶液作电解质溶液,则溶液中的OH-离子向b极附近移动
14、某MCFC型燃料电池可同时供应电和水蒸汽,其工作温度为600℃~700℃,所用燃料为氢气,电解质为熔融的K2CO3.该电池的总反应为:2H2+O2═2H2O,负极电极反应式为:H2+CO32﹣﹣2e﹣→H2O+CO2.则下列判断中正确的是( )
A.放电时CO32﹣向负极移动
B.放电时CO32﹣向正极移动
C.正极反应:4OH﹣﹣4e﹣═2H2O+O2↑
D.当电池中生成1 mol水时,转移4 mol电子
15、下列反应不可用于设计原电池的是( )
A.NaOH+HCl===NaCl+H2O
B.2CH3OH+3O2―→2CO2+4H2O
C.Zn+2HCl===ZnCl2+H2↑
D.4Al+3O2+6H2O===4Al(OH)3
16、在组装原电池时,下列各项中一定不需要的是( )
A. 电极材料 B. 电解质溶液
C. 直流电源 D. 金属导线
17、理论上讲,任何自发的氧化还原反应都可以设计成原电池.请你利用下列反应“Cu+2Ag+=2Ag+Cu2+”设制一个化学电池,并回答下列问题:
①该电池的正极材料是 ,负极材料是
,电解质溶液是 .
②在外电路中,电流方向是从 极到 极.
③正极上出现的现象是 .负极上出现的现象是 .
18、铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸.
工作时该电池总反应式为:PbO2+Pb+2H2SO4═2PbSO4+2H2O,据此判断:
(1)铅蓄电池的负极材料是 .
(2)工作时正极反应为 .
(3)工作时,电解质溶液的pH .(填“增大”、“减小”或“不变”)
(4)工作时,电解质溶液中阴离子移向 极.(填Pb或PbO2)
(5)电流方向从 极流向 .(填Pb或PbO2)
19、某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
编号
电极材料
电解质溶液
电流指针偏转方向
1
Mg Al
稀盐酸
偏向Al
2
Al Cu
稀盐酸
偏向Cu
3
Al 石墨
稀盐酸
偏向石墨
4
Mg Al
NaOH溶液
偏向Mg
5
Al Zn
浓硝酸
偏向Al
试根据上表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极是否相同? .
(2)写出实验3中的电极反应式.
铝为 , ;
石墨为 , ;
(3)实验4中的铝作正极还是负极?写出电池总反应方程式 .
(4)解释实验5中电流指针偏向铝的原因 .
(5)根据实验结果总结:在原电池中金属铝作正极还是作负极受哪些因素的影响?
20、(10分)(2013·烟台高一检测)氢气是未来最理想的能源,科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:2H2O2H2↑+O2↑。制得的氢气可用于燃料电池。
试回答下列问题:
(1)分解海水时,实现了从________能转变为________能,二氧化钛作________。生成的氢气用于燃料电池时,实现________能转变为________能。水分解时,断裂的化学键为________键,分解海水的反应属于________反应(填“放热”或“吸热”)。
(2)某种氢氧燃料电池是用固体金属化物陶瓷作电解质,两极上发生的电极反应分别为:
A极:2H2+2O2--4e-===2H2O;B极:O2+4e-===2O2-,则A极是电池的________极;电子从该极________(填“流入”或“流出”)。
(3)有人以化学反应:2Zn+O2+4H+===2Zn2++2H2O为基础设计出一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作。则原电池的负极材料是________,发生的电极反应为_______________________________________________________。
参考答案
1、答案:C
该原电池中Mg易失电子作负极、AgCl是正极,负极反应式为Mg﹣2e﹣=Mg2+,正极反应式为2AgCl+2e﹣═2C1﹣+2Ag,
A.通过以上分析知,正极反应式为2AgCl+2e﹣═2C1﹣+2Ag,故A正确;
B.Al的活泼性大于Ag,所以铝和氯化银、海水也能构成原电池,则该电池的负极材料可以用金属铝代替,故B正确;
C.有24gMg被氧化时,被氧化Mg的物质的量是1mol,转移电子的物质的量是2mol,当转移2mol电子时可还原得到216gAg,故C错误;
D.Mg﹣AgCl能用海水激活,所以能构成原电池,则海水作为电解质溶液,故D正确;
故选C.
2、答案:B
A.该装置中锌易失电子作负极,铜作正极,为原电池装置,是将化学能转变成电能,故A错误;
B.电子从负极锌沿导线流向正极铜,故B正确;
C.锌失电子生成锌离子进入溶液,导致锌的质量逐渐减小,铜片质量不变,故C错误;
D.锌失电子发生氧化反应而作负极,故D错误;
故选B.
3、答案:D
解:本题考查原电池的设计。
4、答案:B
解:A、铜和锌与硫酸形成原电池,锌做负极,当有0.5摩尔电子转移时,反应0.25摩尔锌,即65*0.25=16.25克,不选A;B、铜做正极,溶液中的氢离子反应,当有0.5摩尔电子转移时,有0.25摩尔氢气生成,选B;C、电子从锌流向铜,不选C;D、溶液中的硫酸根离子向负极锌移动,不选D。
5、答案:B
A、两电极的活泼性相同,故A错误;
B、符合原电池的构成条件,故B正确;
C、不能自发的进行氧化还原反应,故C错误;
D、不能形成闭合回路,故D错误;
故选B.
6、答案:D
7、答案:B
解:A.因为a极为负极,b为正极,则溶钙离子向正极移动,故A正确;
B.反应中N元素化合价升高3价,O元素化合价降低4价,根据得失电子守恒,消耗NH3与O2的物质的量之比为4:3,故B错误;
C.氨气在反应中失去电子在负极a极上发生氧化反应,故C正确;
D.正极得到电子发生还原反应,电极反应式为O2+4e﹣+2H20=4OH﹣,故D正确.
故选B.
8、答案:B
解:两种活动性不同的金属和电解质溶液构成原电池,较活泼的金属作负极,负极上金属失电子发生氧化反应被腐蚀,较不活泼的金属作正极,将A与B用导线连接起来浸入电解质溶液中,B不易腐蚀,所以A的活动性大于B.
金属和相同的酸反应时,活动性强的金属反应剧烈,将A、D分别投入等浓度盐酸溶液中,D比A反应剧烈,所以D的活动性大于A;
金属的置换反应中,较活泼金属能置换出较不活泼的金属,将铜浸入B的盐溶液中,无明显变化,说明B的活动性大于铜.如果把铜浸入C的盐溶液中,有金属C析出,说明铜的活动性大于C.
所以金属的活动性顺序为:D>A>B>C,故选B.
9、答案:A
①A、B用导线相连后,同时浸入稀硫酸中,A极为负极,所以活泼性:A>B;
②原电池中,电流从正极流向负极,C、D用导线相连后,同时浸入稀硫酸溶液中,电流由D→导线→C,所以金属活泼性:C>D;
③B、C相连后,同时浸入稀硫酸中,C极产生大量气泡,说明C是正极,所以金属活泼性:B>C;
④B、D相连后,同时浸入稀硫酸中,D极产生大量气泡,说明D极是正极,所以金属活泼性:B>D;
综上可知金属活泼性顺序是:A>B>C>D.
故选A.
10、答案:D
A.锌锰电池不能反复充电放电,是一次性电池,故A正确;
B.Zn在负极失电子,逐渐溶解,则电池使用过程中,锌会逐渐溶解:Zn=Zn2++2e﹣,故B正确;
C.干电池中的电解质溶液易与锌反应减小电解质的量和电极材料的量,所以锌锰干电池即使不用,长久放置也会失效,故C正确;
D.HCl溶液的酸性较强,能与Zn反应,把电解质NH4Cl可以换成HCl溶液会使锌桶被腐蚀,故D错误.
故选D.
11、答案:C
当闭合开关K时,b附近溶液先变红,即b附近有OH-生成,在b极析出氢气,b极是阴极,a极是阳极,与阴极连接的是原电池的负极,所以B极是负极,A极是正极。闭合K时,负极发生氧化反应,电极反应为2Na2S2-2e-===2Na++Na2S4,A错误;闭合开关K时,b极附近先变红色,该极上生成H2和OH-,pH增大,B错误;闭合K时,有0.01 mol Na+通过离子交换膜,说明有0.01 mol电子转移,阴极上生成0.005 mol H2,标准状况下体积为0.005 mol×22.4 L·mol-1=0.112 L=112 mL,C正确;闭合开关K时,a极是阳极,该极上金属铜被氧化,电极反应为Cu-2e-===Cu2+,没有气体产生,D错误。
12、答案:D
解:本题考查
原电池的工作原理。①A、B用导线相连后,同时浸入稀硫酸溶液中,A极为负极,所以活泼性:A>B;②原电池中,电子从负极流向正极,C、D用导线相连后,同时浸入稀硫酸溶液中,电子由C→导线→D,所以金属活泼性:C>D;③A、C相连后,同时浸入稀硫酸溶液中,C极产生大量气泡,说明C极是正极,所以金属活泼性:A>C;④B、D相连后,同时浸入稀硫酸溶液中,D极发生氧化反应,说明D极是负极,所以金属活泼性:D>B;综上可知金属活泼性顺序是:A>C>D>B,答案选D。
13、答案:C
解:本题考查燃料电池的有关判断的知识。A.如果a极通入H2,b极通入O2,NaOH溶液作电解质溶液,则通H2的电极是负极,氢气失去电子,发生的反应为:H2-2e-+2OH-=2H2O,A错误;B.如果a极通入H2,b极通入O2,H2SO4溶液作电解质溶液,则通 O2的电极是正极,氧气得到电子,发生的反应为:O2+4e-+4H+=2H2O,B错误;C.如果a极通入CH4,b极通入O2,NaOH作电解质溶液,则通CH4的电极是负极,甲烷失去电子,发生的反应为:CH4-8e-+10 OH-=CO32-+7H2O,C正确;D.如果a极通入H2,b极通入O2,NaOH溶液作电解质溶液,则溶液中的OH-离子向正电荷较多的负极a极附近移动,D错误,答案选C。
14、答案:A
解:A、燃料电池中,阴离子移向原电池的负极,则CO32﹣向负极移动,故A正确;
B、燃料电池中,阴离子移向原电池的负极,则CO32﹣向负极移动,故B错误;
C、燃料电池中,正极发生的是氧气得电子的反应过程,电极反应为:O2+2CO2+4e﹣→2CO32﹣,故C错误;
D、根据电池反应:2H2+O2=2H2O,当电池生成1mol水时,转移2mol电子,故D错误.
故选A.
15、答案:A
只有氧化还原反应才能设计成原电池。NaOH与HCl的反应为非氧化还原反应。
16、答案:C
解:组装原电池不需要直流电源,答案选C。
17、答案:① C;Cu;AgNO3 溶液;
② 正;负;
③ 正极质量增加;负极质量减少.
①根据电池总反应可知,在反应中,Cu被氧化,失电子,应为原电池的负极,则正极为活泼性较Cu弱的金属或非金属,如碳棒,Ag+在正极上得电子被还原,电解质溶液为AgNO3 ,故答案为:C;Cu;AgNO3 溶液;
②原电池电流方向从正极经外电路流向正极,电子流向相反,故答案为:正;负;
③原电池工作时,负极反应为Cu﹣2e﹣=Cu2+,电极质量不断减小,正极反应为Ag++e=Ag,正极上有银白色物质析出,质量不断增加,故答案为:正极质量增加;负极质量减少.
18、答案:(1)Pb;
(2)PbO2+2e﹣+4H++SO42﹣=PbSO4+2H2O;
(3)增大;
(4)Pb;
(5)PbO2;Pb.
解:(1)原电池中,失电子化合价升高的电极作负极,得电子化合价降低的电极是正极,该原电池中Pb元素化合价由0价、+4价变为+2价,所以Pb作负极、PbO2作正极,故答案为:Pb;
(2)放电时,正极上PbO2得电子和H2SO4反应生成PbSO4,电极反应式为PbO2+2e﹣+4H++SO42﹣=PbSO4+2H2O,故答案为:PbO2+2e﹣+4H++SO42﹣=PbSO4+2H2O;
(3)放电时,H2SO4参加反应导致溶液中c( H+)降低,则溶液pH增大、酸性减小,故答案为:增大;
(4)放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动,Pb为负极,所以阴离子向Pb电极移动,故答案为:Pb;
(5)电流从正极PbO2沿导线流向负极Pb,故答案为:PbO2;Pb.
19、答案:(1)不同;
(2)负极,2Al﹣6e﹣→2Al3+;正极,6H++6e﹣→3H2↑;
(3)负极;2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑;
(4)Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电子由负极流向正极,所以电流计指针偏向铝.
(5)与另一种材料的活泼性、电解质溶液的酸碱性以及电解质溶液的氧化性强弱等因素有关;
(1)实验1中,氧化还原反应发生在金属镁和稀盐酸之间,失电子的是金属镁,为负极金属,实验2中,氧化还原反应发生在金属铝和稀盐酸之间,失电子的是金属铝,为负极金属,所以实验1、2中Al所作的电极不相同,故答案为:不同;
(2)Al、石墨、盐酸构成的原电池中,较活泼的金属铝做负极,电极反应为:2Al﹣6e﹣→2Al3+;石墨电极为正极,电极反应为:6H++6e﹣→3H2↑,故答案为:负极,2Al﹣6e﹣→2Al3+;正极,6H++6e﹣→3H2↑;
(3)实验4中,金属铝和氢氧化钠可以发生自发的氧化还原反应,失电子的是金属铝,为原电池的负极,自发的氧化还原反应即为电池的总反应,故答案为:负极;2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑;
(4)实验5中Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电子由正极流向负极,所以电流计指针偏向铝,故答案为:Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电子由负极流向正极,所以电流计指针偏向铝.
(5)在原电池中,正负极的判断依据:失电子的极是负极,得电子的极是正极;较活泼金属为负极,不活泼的为正极,根据自发的氧化还原反应来判断正负极是最准确的方法,答:与另一种材料的活泼性、电解质溶液的酸碱性以及电解质溶液的氧化性强弱等因素有关;
20、答案: (1)太阳 化学 催化剂 化学 电 H—O
吸热 (2)负 流出 (3)锌 2Zn-4e-===2Zn2+
(4)H++HSO===H2O+SO2↑
(5)如上图。
(6)11 是
(1)科学家利用太阳能使海水分解,所以是太阳能转变为化学能;生成的氢气用于燃料电池时是把化学能转变为电能。(2)A极是失去电子发生氧化反应的电极,所以A极是负极,电子从该极流出。