- 451.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
原电池 化学电源
一、选择题:每小题只有一个选项符合题意。
1.(2020·广州模拟)某小组为研究原电池原理,设计如图装置,下列叙述正确的是( )
A.若X为Fe,Y为Cu,则铁为正极
B.若X为Fe,Y为Cu,则电子由铜片流向铁片
C.若X为Fe,Y为C,则碳棒上有红色固体析出
D.若X为Cu,Y为Zn,则锌片发生还原反应
解析:选C。Fe比Cu活泼,Fe做负极,电子从Fe流向Cu,故A、B错误;若X为Fe,Y为C,电解质为硫酸铜,则正极碳棒上析出Cu,故C正确;Zn比Cu活泼,Zn做负极,发生氧化反应,故D错误。
2.(新题预测)在超市里经常会看到一种外壳为纸层包装的电池,印有如图所示的文字。下列有关说法错误的是( )
A.该电池是一次电池
B.该电池工作时,电子由负极通过外电路流入正极
C.该电池含有的金属元素中毒性最大的是Hg
D.该电池工作时,外电路中每通过0.2 mol电子,锌的质量理论上减少3.25 g
解析:选D。电池工作时,锌失去电子,电极反应式为Zn-2e-===Zn2+,所以外电路中每通过0.2 mol电子,锌的质量理论上应减少6.5 g,所以D项错误。
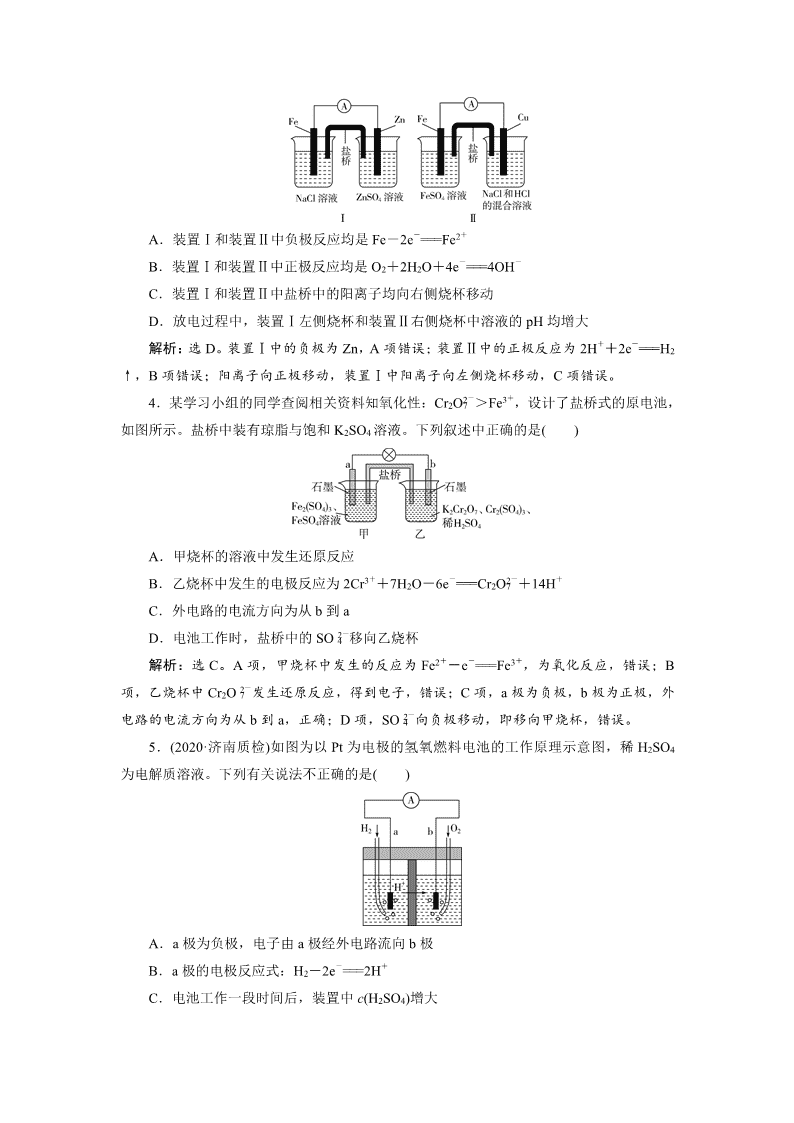
3.根据下图判断,下列说法正确的是( )
A.装置Ⅰ和装置Ⅱ中负极反应均是Fe-2e-===Fe2+
B.装置Ⅰ和装置Ⅱ中正极反应均是O2+2H2O+4e-===4OH-
C.装置Ⅰ和装置Ⅱ中盐桥中的阳离子均向右侧烧杯移动
D.放电过程中,装置Ⅰ左侧烧杯和装置Ⅱ右侧烧杯中溶液的pH均增大
解析:选D。装置Ⅰ中的负极为Zn,A项错误;装置Ⅱ中的正极反应为2H++2e-===H2↑,B项错误;阳离子向正极移动,装置Ⅰ中阳离子向左侧烧杯移动,C项错误。
4.某学习小组的同学查阅相关资料知氧化性:Cr2O>Fe3+,设计了盐桥式的原电池,如图所示。盐桥中装有琼脂与饱和K2SO4溶液。下列叙述中正确的是( )
A.甲烧杯的溶液中发生还原反应
B.乙烧杯中发生的电极反应为2Cr3++7H2O-6e-===Cr2O+14H+
C.外电路的电流方向为从b到a
D.电池工作时,盐桥中的SO移向乙烧杯
解析:选C。A项,甲烧杯中发生的反应为Fe2+-e-===Fe3+,为氧化反应,错误;B项,乙烧杯中Cr2O发生还原反应,得到电子,错误;C项,a极为负极,b极为正极,外电路的电流方向为从b到a,正确;D项,SO向负极移动,即移向甲烧杯,错误。
5.(2020·济南质检)如图为以Pt为电极的氢氧燃料电池的工作原理示意图,稀H2SO4为电解质溶液。下列有关说法不正确的是( )
A.a极为负极,电子由a极经外电路流向b极
B.a极的电极反应式:H2-2e-===2H+
C.电池工作一段时间后,装置中c(H2SO4)增大
D.若将H2改为CH4,消耗等物质的量的CH4时,O2的用量增多
解析:选C。a极通入的H2发生氧化反应,为负极,电子由a极经外电路流向b极;以稀H2SO4为电解质溶液时,负极的H2被氧化为H+;电池总反应为2H2+O2===2H2O,电池工作一段时间后,装置中c(H2SO4)减小;根据电池总反应2H2+O2===2H2O,CH4+2O2===CO2+2H2O可知,等物质的量的CH4比H2消耗O2多。
6.可充电氟镁动力电池比锂电池具有更高的能量密度和安全性,其电池反应为Mg+2MnF3===2MnF2+MgF2。下列有关说法不正确的是( )
A.镁为负极材料
B.正极的电极反应式为MnF3+e-===MnF2+F-
C.电子从镁极流出,经电解质流向正极
D.每生成1 mol MnF2时转移1 mol电子
解析:选C。由电池反应可知,镁失去电子,发生氧化反应,为负极,A项正确;电池反应中,三氟化锰发生还原反应,为正极,B项正确;电子由负极(镁极)流出经外电路流向正极,C项不正确;锰元素由+3价降至+2价,每生成1 mol MnF2转移1 mol电子,D项正确。
7.(2020·雅安模拟)某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质,以CH4为燃料时,该电池工作原理如图所示,下列说法正确的是( )
A.a为空气,b为CH4
B.CO向正极移动
C.此电池在常温时也能工作
D.正极电极反应式为2CO2+O2+4e-===2CO
解析:选D。燃料电池中通入燃料的一极是负极,通入氧化剂的一极是正极,根据电子流向可知,左边电极是负极、右边电极是正极,所以a为CH4,b为空气,故A错误;原电池放电时,阴离子向负极移动,则CO向负极移动,故B错误;电解质为熔融碳酸盐,需要高温条件,故C错误;正极上O2得到电子和CO2反应生成CO,电极反应式为O2+2CO2+4e-===2CO,故D正确。
二、选择题:每小题有一个或两个选项符合题意。
8.(原创题)三元电池成为我国电动汽车的新能源,其正极材料可表示为LixyzO2,且x+y+z=1。充电时电池总反应为LiNixCoyMnzO2+6C(石墨)===Li1-aNixCoyMnzO2+LiaC6,其电池工作原理如图所示,
两极之间有一个允许特定的离子X通过的隔膜。下列说法正确的是( )
A.允许离子X通过的隔膜属于阳离子交换膜
B.充电时,A为阴极,发生氧化反应
C.放电时,B为负极,发生氧化反应
D.放电时,正极反应式为Li1-aNixCoyMnzO2+aLi++ae-===LiNixCoyMnzO2
解析:选AD。根据充电时电池总反应可知,放电时负极反应式为LiaC6-ae-===6C(石墨)+aLi+,正极反应式为Li1-aNixCoyMnzO2+aLi++ae-===LiNixCoyMnzO2,将放电时负极、正极反应式左右颠倒,即分别得到充电时阴极、阳极反应式,D项正确;放电时,A是负极、B是正极,Li+向正极移动,则X是Li+,允许阳离子通过的隔膜为阳离子交换膜,A项正确,C项错误;充电时,A是阴极,发生还原反应,B项错误。
9.镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高且平稳,使镁原电池成为人们研制绿色原电池的关注焦点。其中一种镁原电池的反应为xMg+Mo3S4MgxMo3S4,下列说法正确的是( )
A.电池放电时,正极反应为Mo3S4+2xe-+xMg2+===MgxMo3S4
B.电池放电时,Mg2+向负极迁移
C.电池充电时,阳极反应为xMg2++2xe-===xMg
D.电池充电时,阴极发生还原反应生成Mo3S4
解析:选A。电池放电时,正极发生还原反应,由电池反应可知,Mo3S4为正极,被还原,电极反应为Mo3S4+2xe-+xMg2+===MgxMo3S4,A项正确;电池放电时,阳离子向正极移动,B项错误;电池充电时,阳极发生氧化反应,C项错误;电池充电时,阴极发生还原反应生成金属镁,D项错误。
10.(改编题)十九大报告中提出要“打赢蓝天保卫战”,这意味着对大气污染防治的要求比过去更高。二氧化硫空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。下列说法正确的是( )
A.该电池放电时质子从Pt2电极经过内电路流到Pt1电极
B.Pt1电极附近发生的反应为SO2+2H2O-2e-===H2SO4+2H+
C.Pt2电极附近发生的反应为O2+4e-+4H+===2H2O
D.相同条件下,放电过程中消耗的SO2和O2的体积比为2∶1
解析:选CD。放电时为原电池,质子向正极移动,Pt1电极为负极,则该电池放电时质子从Pt1电极经过内电路流到Pt2电极,A错误;Pt1电极为负极,发生氧化反应,SO2被氧化为硫酸,电极反应为SO2+2H2O-2e-===SO+4H+,硫酸应当拆为离子形式,B错误;Pt2电极为正极,在酸性条件下,氧气在正极上得电子生成水,C正确;相同条件下,放电过程中负极发生氧化反应2SO2+4H2O-4e-===2SO+8H+,正极发生还原反应O2+4e-+4H+===2H2O,根据转移电子数相等可知,相同条件下,放电过程中消耗的SO2和O2的体积比为2∶1,D正确。
11.我国最近在太阳能光电催化化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法中正确的是( )
A.该制氢工艺中光能最终转化为化学能
B.该装置工作时,H+由b极区移向a极区
C.a极上发生的电极反应为Fe3++e-===Fe2+
D.a极区需不断补充含Fe3+和Fe2+的溶液
解析:选A。该制氢工艺中光能转化为电能,最终转化为化学能,A项正确;该装置工作时,H+由a极区移向b极区,B项错误;a极上发生氧化反应,失电子,所以a极上发生的电极反应为Fe2+-e-===Fe3+,C项错误;由题图可知,a极区Fe2+和Fe3+可相互转化,故不需补充含Fe3+和Fe2+的溶液,D项错误。
三、非选择题
12.某兴趣小组做如下探究实验:
(1)图Ⅰ为依据氧化还原反应设计的原电池装置,该反应的离子方程式为___________。反应前,两电极质量相等,一段时间后,两电极质量相差12 g,则导线中通过________mol电子。
(2)如图Ⅰ,其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极的反应式为________________________________________________________________________,
这是由于NH4Cl溶液显________(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因:_________________________________________________________。
(3)如图Ⅱ,其他条件不变,将图Ⅰ中的盐桥换成铜丝与石墨(2)相连成n形,则乙装置中石墨(1)为________(填“正”“负”“阴”或“阳”)极,乙装置中与铜丝相连的石墨(2)电极上的电极反应式为__________________________________________。
(4)将图Ⅱ乙装置中的CuCl2溶液改为400 mL CuSO4溶液,一段时间后,若电极质量增重1.28 g,则此时溶液的pH为________(不考虑反应中溶液体积的变化)。
解析:(1)Fe是活性电极,失电子被氧化生成Fe2+,石墨是惰性电极,溶液中Cu2+在石墨电极得电子被还原生成Cu,故该原电池反应为Fe+Cu2+===Fe2++Cu。工作过程中,Fe做负极,电极反应式为Fe-2e-===Fe2+,铁电极质量减少;石墨做正极,电极反应式为Cu2++2e-===Cu,石墨电极质量增加;设两电极质量相差12 g时电路中转移电子为x mol,则有x mol××56 g·mol-1+x mol××64 g·mol-1=12 g,解得x=0.2。(2)NH4Cl溶液中NH发生水解反应:NH+H2ONH3·H2O+H+,使溶液呈酸性,故石墨电极(即正极)上发生的反应为2H++2e-===H2↑。(3)其他条件不变,若将盐桥换成铜丝与(2)石墨相连成n形,则甲装置为原电池,Fe做负极,Cu做正极;乙装置为电解池,则石墨(1)为阴极,石墨(2)为阳极,溶液中Cl-在阳极放电生成Cl2,电极反应式为2Cl--2e-===Cl2↑。(4)若将乙装置中的CuCl2溶液改为400 mL CuSO4溶液,电解CuSO4溶液的总反应方程式为2CuSO4+2H2O2H2SO4+2Cu+O2↑,当电极质量增重1.28 g(即析出0.02 mol Cu)时,生成0.02 mol H2SO4,则c(H+)==0.1 mol·L-1,pH=-lg 0.1=1,故此时溶液的pH为1。
答案:(1)Fe+Cu2+===Fe2++Cu 0.2
(2)2H++2e-===H2↑ 酸性 NH+H2ONH3·H2O+H+
(3)阴 2Cl--2e-===Cl2↑ (4)1
13.(新题预测)(1)微生物燃料电池指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示:
①HS-在硫氧化菌作用下转化为SO的反应式是___________________________。
②若维持该微生物电池中两种细菌的存在,则电池可以持续供电,原因是_________。
(2)PbSO4热激活电池可用作火箭、导弹的工作电源,基本结构如图所示,其中作为电解质的无水LiClKCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb。
①放电过程中,Li+向________(填“负极”或“正极”)移动。
②负极反应式为___________________________________________。
③电路中每转移0.2 mol电子,理论上生成_____________g Pb。
(3)氨氧燃料电池具有很大的发展潜力。氨氧燃料电池工作原理如图所示。
①a电极的电极反应式是________________________________________________。
②一段时间后,需向装置中补充KOH,请依据反应原理解释原因:___________。
解析:(1)①酸性环境中反应物为HS-,产物为SO,利用质量守恒和电荷守恒进行配平,电极反应式为HS-+4H2O-8e-SO+9H+;②从质量守恒角度来说,HS-、SO浓度不会发生变化,只要有两种细菌存在,就会循环把有机物氧化成CO2放出电子。
(2)③根据电池总反应可知,电路中每转移0.2 mol电子,生成 0.1 mol Pb,即20.7 g。
(3)①a电极是通入NH3的电极,失去电子,发生氧化反应,所以该电极做负极,电极反应式是2NH3-6e-+6OH-===N2+6H2O;②该燃料电池的总反应为4NH3+3O2===N2+6H2O,有水生成,使得溶液逐渐变稀,为了维持碱的浓度不变,所以要补充KOH。
答案:(1)①HS-+4H2O-8e-SO+9H+
②HS-、SO浓度不会发生变化,只要有两种细菌存在,就会循环把有机物氧化成CO2放出电子
(2)①正极 ②Ca-2e-===Ca2+ ③20.7
(3)①2NH3-6e-+6OH-===N2+6H2O
②电池反应为4NH3+3O2===2N2+6H2O,有水生成,使得溶液逐渐变稀,所以要补充KOH