- 202.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
单元复习与测试
【巩固练习】
一、选择题
1.下列说法正确的是( )。
A.向0.1 mol·L-1 Na2CO3溶液中滴加酚酞,溶液变红色
B.Al3+、NO3-、Cl-、CO32-、Na+可大量共存于pH=2的溶液中
C.乙醇和乙酸都能溶于水,都是电解质
D.分别与等物质的量的HCl和H2SO4反应时,消耗NaOH的物质的量相同
2.下列有关pH的变化的判断中,正确的是( )。
A.随着温度的升高,碳酸钠溶液的pH减小
B.随着温度的升高,纯水的pH增大
C.新制氯水经光照一段时间后,pH减小
D.氢氧化钠溶液久置于空气中,pH增大
3.下列根据反应原理设计的应用,不正确的是( )。
A.CO32-+H2OHCO3-+OH- 用热的纯碱溶液清洗油污
B.Al3++3H2OAl(OH)3+3H+ 明矾净水
C.TiCl4+(x+2) H2O(过量)TiO2·xH2O↓+4HCl 制备TiO2纳米粉
D.SnCl2+H2OSn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
4.25℃时,水的电离达到平衡:H2OH++OH- ΔH>0,下列叙述正确的是( )。
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,KW增大,pH不变
5.向三份0.1 mol·L-1的CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为( )。
A.减小、增大、减小 B.增大、减小、减小
C.减小、增大、增大 D.增大、减小、增大
6.有关实验操作的叙述,正确的是( )。
A.用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应
B.用四氯化碳萃取溴水中的溴,分液时有机层从分液漏斗的下端放出
C.用玻璃棒蘸取未知浓度的盐酸,点在湿润的pH试纸上测定其pH
D.将4.0 g NaOH加入100 mL容量瓶中溶解并稀释至刻度,配制成1 mol·L-1的NaOH溶液
7.下列说法正确的是( )。
A.pH=2与pH=l的硝酸中c(H+)之比为1∶10
B.Na2CO3溶液中c(Na+)与c(CO32-)之比为2∶1
C.0.2 mol·L-1与0.1 mol·L-1醋酸中c(H+)之比为2∶1
D.NO2溶于水时,被氧化的n(NO2)与被还原的n(NO2)之比为3∶1
5
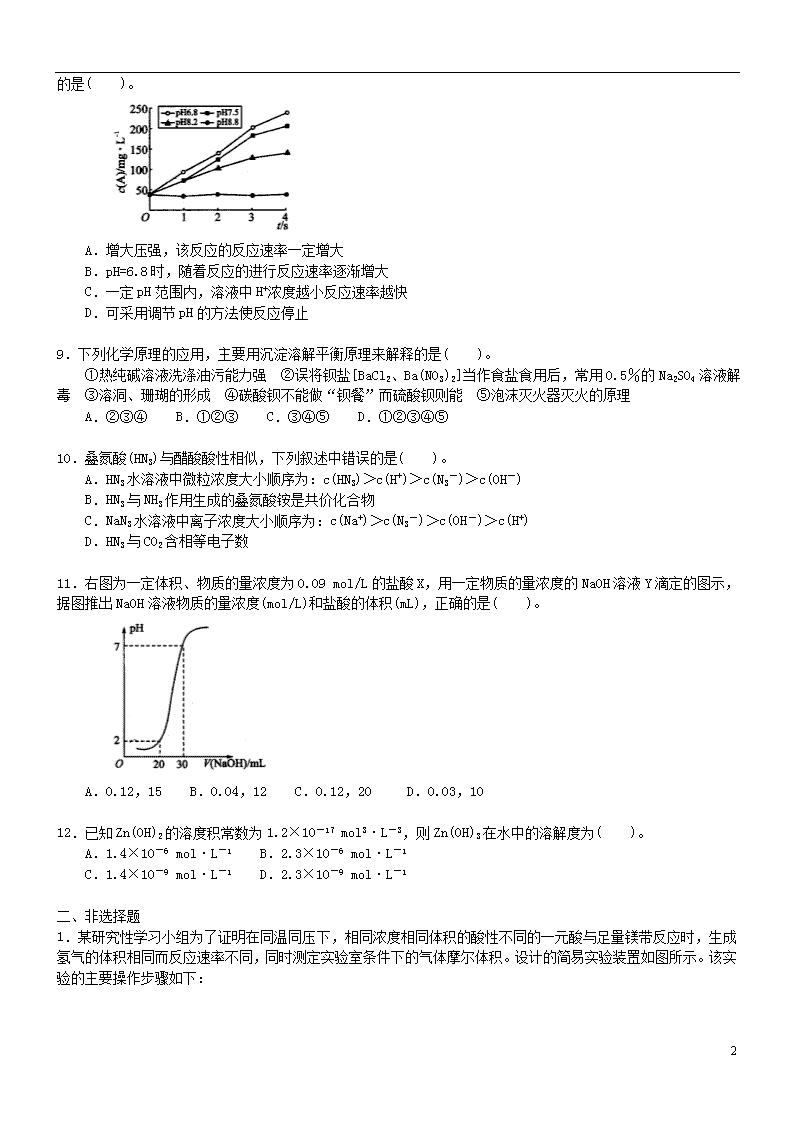
8.实验测得某反应在不同pH下产物A的浓度随时间变化的关系如图所示(其他条件相同)。则下列有关说法正确的是( )。
A.增大压强,该反应的反应速率一定增大
B.pH=6.8时,随着反应的进行反应速率逐渐增大
C.一定pH范围内,溶液中H+浓度越小反应速率越快
D.可采用调节pH的方法使反应停止
9.下列化学原理的应用,主要用沉淀溶解平衡原理来解释的是( )。
①热纯碱溶液洗涤油污能力强 ②误将钡盐[BaCl2、Ba(NO3)2]当作食盐食用后,常用0.5%的Na2SO4溶液解毒 ③溶洞、珊瑚的形成 ④碳酸钡不能做“钡餐”而硫酸钡则能 ⑤泡沫灭火器灭火的原理
A.②③④ B.①②③ C.③④⑤ D.①②③④⑤
10.叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是( )。
A.HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(N3-)>c(OH-)
B.HN3与NH3作用生成的叠氮酸铵是共价化合物
C.NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3-)>c(OH-)>c(H+)
D.HN3与CO2含相等电子数
11.右图为一定体积、物质的量浓度为0.09 mol/L的盐酸X,用一定物质的量浓度的NaOH溶液Y滴定的图示,据图推出NaOH溶液物质的量浓度(mol/L)和盐酸的体积(mL),正确的是( )。
A.0.12,15 B.0.04,12 C.0.12,20 D.0.03,10
12.已知Zn(OH)2的溶度积常数为1.2×10-17 mol3·L-3,则Zn(OH)3在水中的溶解度为( )。
A.1.4×10-6 mol·L-1 B.2.3×10-6 mol·L-1
C.1.4×10-9 mol·L-1 D.2.3×10-9 mol·L-1
二、非选择题
1.某研究性学习小组为了证明在同温同压下,相同浓度相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如图所示。该实验的主要操作步骤如下:
5
①配制浓度均为l mol·L-1的盐酸和醋酸溶液;
②用________量取10.00 mL l mol·L-1的盐酸和醋酸溶液分别加入到两个锥形瓶中;
③分别称取除去表面氧化膜的镁带a g,并系于铜丝,末端,a的数值至少为________;
④在广口瓶中装足量的水,按图3-3所示连接好装置,检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸人酸中(铜丝不与酸接触),至反应完全,记录________;
⑥反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应________,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题:
(1)用文字表述步骤④中检查该装置气密性的操作与观察方法:________。
(2)本实验中应选用________(填序号)的量筒。
A.100 mL B.200 mL C.500 mL
(3)若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为:Vm=________。
(4)简述速率不等的原因________,铜丝不与酸接触的原因是________。
2.现有25℃时0.1 mol/L的氨水。请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中_____(填“增大”“减小”或“不变”)。
(2)若向氨水中加入稀硫酸,使其恰好完全中和,写出反应的离子方程式________;所得溶液的pH____(填“<”“>”或“=”)7,用离子方程式表示其原因________。
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol·L-1,则c(SO42-)=________。
(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中各离子物质的量浓度由大到小的顺序是________。
3.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号
HA物质的量浓度(mol / L)
NaOH物质的量浓度(mol / L)
混合溶液的pH
①
0.1
0.1
pH=9
②
c
0.2
pH=7
③
0.2
0.1
pH<7
请回答:
(1)从①组情况分析,HA是强酸还是弱酸?________(填“强酸”或“弱酸”)。
(2)②组情况表明,c________(填“大于”“小于”或“等于”)0.2 mol/L。混合液中离子浓度c(A-)与c(Na+)的大小关系________。
(3)从③组实验结果分析,说明HA的电离程度________(填“大于”“小于”或“等于”)NaA的水解程度,该混合溶液中离子浓度由大到小的顺序是________。
【参考答案与解析】
1.A
【解析】B项CO32-与H+、CO32-与Al3+不能大量共存,C中乙醇为非电解质。
5
2.C
【解析】升高温度,Na2CO3的水解平衡(CO32-+H2OHCO3-+OH-)向正反应方向移动,c(OH-)增大,pH增大,A错误;升高温度,H2O的电离平衡(H2OH++OH-)向正反应方向移动,c(H+)增大,pH减小,B错误;新制氯水光照后发生反应:2HClO2H++2Cl-+O2↑,c(H+)增大,pH减小,C正确;NaOH溶液久置于空气中发生反应:2OH-+CO2=CO32-+H2O,c(OH-)减小,pH减小,D错误。
3.D
【解析】纯碱溶液能用于清洗油污的原因是其水解呈碱性,A项正确;明矾用作净水剂的原理是Al3+水解生成的Al(OH)3胶体具有较强的吸附能力,能吸附水中的悬浮杂质,达到净水的效果,B项正确;C项利用TiCl4水解生成TiO2纳米粉,正确;为防止SnCl2的水解,在配制SnCl2溶液时应加入盐酸,而不是氢氧化钠。D项错误。
4.B
【解析】向水中加入稀氨水,c(OH-)增大,平衡H2OH++OH-逆向移动,故A项错误;向水中加入NaHSO4固体,NaHSO4溶于水全部电离:NaHSO4=Na++H++SO42-,故c(H+)增大,使水的电离平衡逆向移动,但溶液的温度不变,KW不变,B项正确;向水中加入CH3COONa,由于存在:CH3COO-+H2OCH3COOH+OH-,促进了水的电离,使水的电离平衡向正方向移动,C项说法不正确;KW=c(H+)·c(OH-),加热,促进了水的电离,c(H+)和c(OH-)都增大,故KW增大,pH减小,D项不正确,故本题应选择B项。
5.A
【解析】0.1 mol·L-1 CH3COONa中存在平衡CH3COO-+H2OCH3COOH+OH-,加入NH4NO3、FeCl3两种水解显酸性的盐会使平衡正向移动,c(CHCOO-)减小;加入Na2SO3这种水解显碱性的盐会使平衡逆向移动,c(CH3COO-)增大。
6.B
【解析】焰色反应时铂丝应用稀盐酸洗涤并灼烧;测定pH的pH试纸不能润湿,润湿后会改变待测液的浓度,从而测定不准;容量瓶不能直接用于溶解。
7.A
【解析】由pH=-lg c(H+)可知两种硝酸中的c(H+)之比为10-2 mol/L∶10-1 mol/L=1∶10;由于CO32-易水解:CO32-+H2OHCO3-+OH-,使Na2CO3溶液中c(Na+)∶c(CO32-)>2∶1;由于醋酸是弱酸,0.2 mol/L的醋酸与0.1 mol/L的醋酸的电离程度不相同,则两种酸溶液中c(H+)之比并不等于2∶1;由反应3NO2+H2O=2HNO3+NO可知,被氧化的n(NO2)与被还原的n(NO2)之比为2∶1。
8.D
【解析】没有气体参加的反应增大压强对反应速率几乎没有影响,A项错;图像中表示反应速率的是曲线的斜率,B项理解错误;pH越小,H+浓度越大,C项错;pH=8.8时反应速率接近于0,D项正确。
9.A
【解析】热纯碱溶液洗涤油污能力强,是由于碳酸钠的水解程度随温度的升高而增强.因而溶液的碱性越强,除油污的效果越好;泡沫灭火器灭火的原理也运用了盐类的水解原理,只是强度更大,能够进行得更彻底。
10.B
【解析】本题主要考查知识类比迁移应用的能力。由于HN3和CH3COONa{酸性相似,类比CH3COONH4溶液及CH3COONa溶液中的离子浓度的大小关系可知A、C皆正确,而由CH3COONH4为离子化合物(盐)可知HN3与NH3反应所形成的铵盐是离子化合物,B不正确;经计算可知D正确。答案为B。
11.D
【解析】pH=2时显酸性,即c(H+)=0.01 moL/L,列方程求解。也可以用排除法:pH=7时,0.09 mol·L-1×VX=cY×30 mL,即3VX=1000cY,D成立。
12.A
【解析】Zn(OH)2在水中的溶解度用mol·L-1来表示时在数值上等于饱和溶液中Zn2+浓度的数值。Ksp[Zn(OH)2]=c(Zn2+)·c2(OH-)=c(Zn2+)·[2c(Zn2+)]2=1.2×10-17 mol·L-1,解得c(Zn2+)=1.4×10-6 mol·L-1,即Zn(OH)2在水中的溶解度为1.4×10-6 mol·L-1。
二、非选择题
5
1.②酸式滴定管 ③0.12 ⑤反应起止时间 ⑥将量筒缓缓向下移动,使乙、丙中液面相平
(1)两手掌紧贴锥形瓶外壁一会,若观察到广口瓶中长导管内有一段水柱高出液面,表明装置不漏气(只要表述明确、合理均可)
(2)B (3)0.2V L/mol
(4)盐酸与醋酸的浓度相同时c(H+)不同 防止形成原电池,干扰实验现象的观察及实验结果的准确性
2.(1)减小
(2)NH3·H2O+H+=NH4++H2O < NH4++H2ONH3·H2O+H+
(3) mol/L (4)c(NH4+)>c(SO42-)>c(H+)>c(OH-)
【解析】(1)氨水存在如下电离平衡:NH3·H2ONH4++OH-,加入(NH4)2SO4,使NH4+浓度增大,平衡向左移动,则c(OH-)减小,c(NH3·H2O)增大,故减小。
(2)氨水与稀硫酸反应的离子方程式为:NH3·H2O+H+=NH4++H2O,由于完全中和生成硫酸铵,而硫酸铵水解使溶液呈酸性,故pH<7,其水解的离子方程式为:NH4++H2ONH3·H2O+H+。
(3)由溶液中的电荷守恒可知:c(NH4+)+c(H+)=2c(SO42-)+c(OH-),pH=7,即c(H+)=c(OH-),c(SO42-)=c(NH4+)= mol/L。
(4)向0.1 mol/L氨水中加入等体积的pH=1的硫酸,两者恰好完全反应生成(NH4)2SO4,则溶液水解呈酸性,则各离子浓度大小顺序为:c(NH4+)>c(SO42-)>c(H+)>c(OH-)。
3.(1)弱酸 (2)大于 c(A-)=c(Na+) (3)大于 c(A-)>c(Na+)>c(H+)>c(OH-)
【解析】(1)从第①组情况分析,等体积等物质的量浓度的HA和NaOH溶液混合后,溶液显碱性,说明生成强碱弱酸盐,说明HA是弱酸。
(2)第②组中NaOH的物质的量浓度为0.2 mol/L,混合后溶液显中性,说明HA稍过量,HA的物质的量浓度应大于0.2 moL/L。根据电中性原理,混合液中离子浓度c(A-)=c(Na+)。
(3)第③组实验相当于等体积等物质的量浓度的HA和NaA溶液混合,pH<7说明HA的电离程度大于NaA的水解程度,溶液中离子浓度由大到小的顺序是c(A-)>c(Na+)>c(H+)>c(OH-)。
5
相关文档
- 高中化学选修4课件_9化学平衡(第三2021-08-2435页
- 高中化学选修4第3章第4节 难溶电解2021-08-248页
- 人教版高中化学选修4练习:第二章第2021-08-2412页
- 人教版高中化学选修4练习:第一章第2021-08-248页
- 高中化学选修4第4章电化学基础 单2021-08-2410页
- 人教版高中化学选修4练习:期中检测2021-08-2414页
- 高中化学选修4教案2021-08-24106页
- 高中化学选修4知识点总结及精练精2021-08-2432页
- 高中化学选修4课件_16原电池2021-08-2341页
- 高中化学选修4课件_12溶液pH的计算2021-08-2321页