- 2.17 MB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
秘密★启用前【考试时间:2019年7月4日8:00 - 9:40】
2019年重庆一中高2020级高二下期期末考试
化学测试试题卷
注意事项:
1.答题前,务必将自己的姓名、准考证号填写在答题卡规定的位置上。
2.答选择题时,必须使用2B铅笔将答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦擦干净后,再选涂其他答案标号。
3.答非选择题时,必须使用0.5毫米黑色签字笔,将答案书写在答题卡规定的位置上。
4.所有题目必须在答题卡上作答,在试题卷上答题无效。
可能用到的相对原子质量:H 1 Li 7 C 12 O 16Na23 S 32 K 39 Co 59
Ⅰ卷(选择题,共45分)
一、选择题(本大题共15个小题,每题3分,共45分。每小题只有一个选项符合题意)
1.化学与生产生活密切相关,下列说法错误的是
A.SiO2具有导电性,可用于制作光导纤维和光电池
B.聚四氟乙烯耐酸碱腐蚀,可用作化工反应器的内壁涂层
C.Na2O2可与CO2反应放出氧气,可用于制作呼吸面具
D.SO2具有漂白性,可用于漂白纸浆、毛、丝、草帽辫等
2.常温下,下列各组离子在给定条件下一定能大量共存的是
A.滴加甲基橙显黄色的溶液中:Cu2+、Ba2+、HCO3-、AlO2-
B.澄清透明的溶液中: K+、Na+、NO3-、MnO4-
C.c(OH-)/c(H+)=1.0×1012的溶液中: Ca2+、NH4+、C2O42-、Cr2O72-
D.由水电离的c(H+)=1.0×10-13mol/L的溶液的溶液中:Mg2+、Al3+、Cl-、S2O32-
3.下列反应的离子方程式正确的是
A.向FeI2的溶液中滴加过量的Br2:2Fe2++2I-+2Br2==I2+2Fe3++4Br-
B.向漂白粉溶液中通入少量二氧化硫:Ca2++2ClO-+SO2+H2O==CaSO3↓+2HClO
C.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应:NH4+ + OH-==NH3·H2O
D.氢氧化钠溶液与过量的碳酸氢钙溶液反应:OH-+Ca2++HCO3-==CaCO3↓+H2O
4.下列说法正确的是
A.福尔马林能使蛋白质发生变性,可用于浸制动物标本
B.花生油和润滑油均含不饱和脂肪酸酯,它们都属于高分子化合物
C.用灼烧法可区分蚕丝和人造纤维,有烧焦羽毛味的为人造纤维
D.往含硫酸的淀粉水解液中加银氨溶液并水浴加热,检验淀粉是否水解
5.向含有c(FeCl3)=0.2mol·L-1、c(FeCl2)=0.1mol·L-1的混合溶液中滴加稀NaOH溶液,可得到一种黑色分散系,其中分散质粒子是直径约为9.3nm的金属氧化物,下列有关说法中正确的是
A.该分散系的分散质为Fe2O3,具有丁达尔效应
B.在电场作用下,阴极附近分散系黑色变深,则说明该分散系带正电荷
C.可用过滤的方法将黑色金属氧化物与Na+分离开
D.加入NaOH时发生的反应可能为:Fe2++2Fe3++8OH—=Fe3O4+4H2O
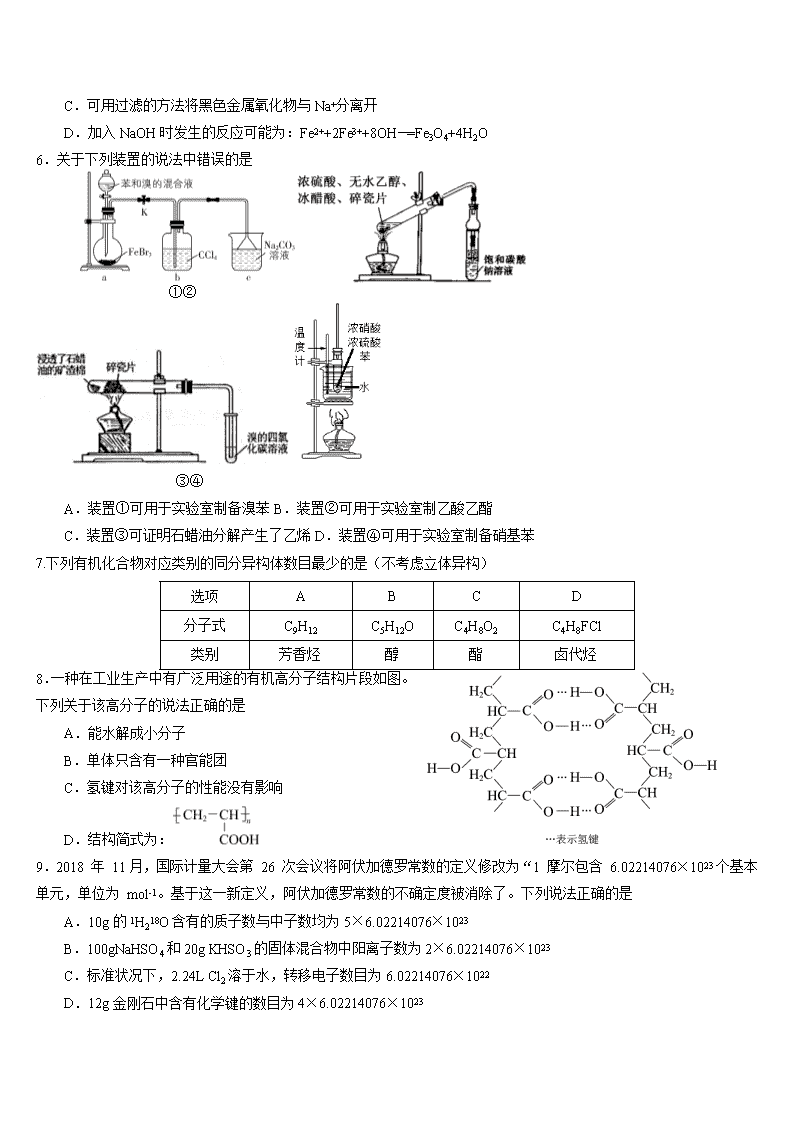
6.关于下列装置的说法中错误的是
①②
③④
A.装置①可用于实验室制备溴苯B.装置②可用于实验室制乙酸乙酯
C.装置③可证明石蜡油分解产生了乙烯D.装置④可用于实验室制备硝基苯
7.下列有机化合物对应类别的同分异构体数目最少的是(不考虑立体异构)
选项
A
B
C
D
分子式
C9H12
C5H12O
C4H8O2
C4H8FCl
类别
芳香烃
醇
酯
卤代烃
8.一种在工业生产中有广泛用途的有机高分子结构片段如图。下列关于该高分子的说法正确的是
A.能水解成小分子
B.单体只含有一种官能团
C.氢键对该高分子的性能没有影响
D.结构简式为:
9.2018 年 11月,国际计量大会第 26 次会议将阿伏加德罗常数的定义修改为“1 摩尔包含 6.02214076×1023个基本单元,单位为 mol-1。基于这一新定义,阿伏加德罗常数的不确定度被消除了。下列说法正确的是
A.10g的1H2 18O含有的质子数与中子数均为5×6.02214076×1023
B.100gNaHSO4和20g KHSO3的固体混合物中阳离子数为2×6.02214076×1023
C.标准状况下,2.24L Cl2溶于水,转移电子数目为6.02214076×1022
D.12g金刚石中含有化学键的数目为4×6.02214076×1023
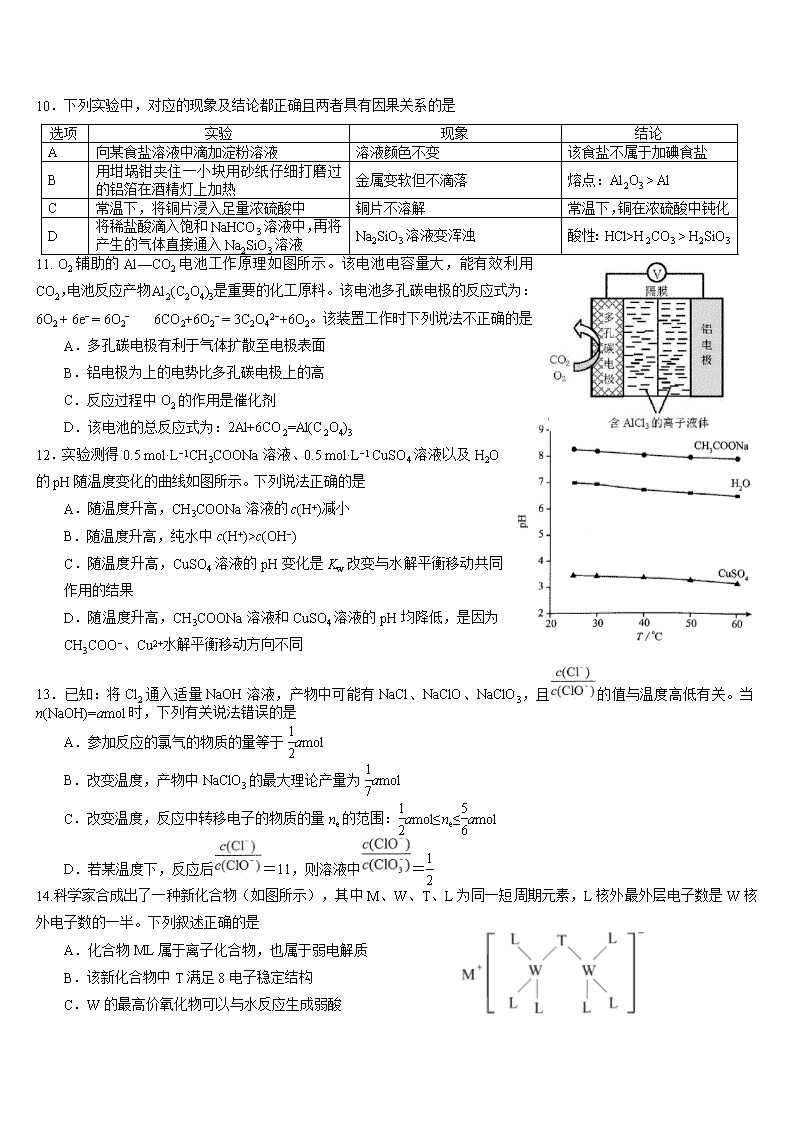
10.下列实验中,对应的现象及结论都正确且两者具有因果关系的是
选项
实验
现象
结论
A
向某食盐溶液中滴加淀粉溶液
溶液颜色不变
该食盐不属于加碘食盐
B
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热
金属变软但不滴落
熔点:Al2O3 > Al
C
常温下,将铜片浸入足量浓硫酸中
铜片不溶解
常温下,铜在浓硫酸中钝化
D
将稀盐酸滴入饱和NaHCO3溶液中,再将产生的气体直接通入Na2SiO3溶液
Na2SiO3溶液变浑浊
酸性:HCl>H2CO3 > H2SiO3
11. O2辅助的Al—CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。该电池多孔碳电极的反应式为:
6O2 + 6e− = 6O2− 6CO2+6O2− = 3C2O42−+6O2。该装置工作时下列说法不正确的是
A.多孔碳电极有利于气体扩散至电极表面
B.铝电极为上的电势比多孔碳电极上的高
C.反应过程中O2的作用是催化剂
D.该电池的总反应式为:2Al+6CO2=Al(C2O4)3
12.实验测得0.5 mol·L−1CH3COONa溶液、0.5 mol·L−1 CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。下列说法正确的是
A.随温度升高,CH3COONa溶液的c(H+)减小
B.随温度升高,纯水中c(H+)>c(OH−)
C.随温度升高,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D.随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO−、Cu2+水解平衡移动方向不同
13.已知:将Cl2通入适量NaOH溶液,产物中可能有NaCl、NaClO、NaClO3,且的值与温度高低有关。当n(NaOH)=amol时,下列有关说法错误的是
A.参加反应的氯气的物质的量等于amol
B.改变温度,产物中NaClO3的最大理论产量为amol
C.改变温度,反应中转移电子的物质的量ne的范围:amol≤ne≤amol
D.若某温度下,反应后=11,则溶液中=
14.科学家合成出了一种新化合物(如图所示),其中M、W、T、L为同一短周期元素,L核外最外层电子数是W核外电子数的一半。下列叙述正确的是
A.化合物ML属于离子化合物,也属于弱电解质
B.该新化合物中T满足8电子稳定结构
C.W的最高价氧化物可以与水反应生成弱酸
D.元素非金属性的顺序为W>T>L
15.在25℃时,甘氨酸在水溶液中解离情况如下:
改变溶液pH值,三种甘氨酸相关离子的分布分数(α,平衡时某物种的浓度占各物种浓度之和的分数)变化如图所示。当调节溶液的pH值使甘氨酸所带的净电荷为零,此时溶液的pH叫等电点。下列说法正确的是
A.曲线Ⅰ、Ⅱ、Ⅲ分别代表的微粒为、、
B.K2=10-2.34,且K2对应的解离基团为
C.在pH=9.60的溶液中加盐酸,α()+α()+α()保持不变
D.甘氨酸的等电点pH约为6,且存在c()=c()=c()
Ⅱ卷(非选择题,共55分)
二、非选择题(本大题共5个小题,共55分)
16.(10分)奥沙拉秦是曾用于治疗急、慢性溃疡性结肠炎的药物,其由水杨酸为起始物的合成路线如下:
回答下列问题:
(1) A的结构简式为;由A制备B的反应试剂和条件为。
(2) 由B制备C的反应类型为______。
(3)由D生成E的反应方程式为。
(4) 工业上常采用廉价的CO2与E反应制备奥沙拉秦,通入的CO2与E的物质的量之比至少应为。
(5) 奥沙拉秦的化学式为,其核磁共振氢谱为组峰,峰面积比为。
(6) F是水杨酸的同分异构体,可以发生银镜反应;F经碱催化水解后再酸化可以得到对苯二酚。F的结构简式为
。
17.(11分)二甲醚(CH3OCH3)重整制取H2,具有无毒、无刺激性等优点。回答下列问题:
(1) CH3OCH3和O2发生反应Ⅰ: CH3OCH3(g)+12O2 (g) =2CO(g)+3H2(g) △H
己知:CH3OCH3(g) =CO(g)+H2(g)+CH4(g) △H= a kJ/mol
CH4(g) +32O2 (g) = CO(g)+2H2O(g) △H= b kJ/mol
H2(g)+12O2 (g) = H2O(g) △H= c kJ/mol
①则反应Ⅰ的△H= (用含a、b、c的代数式表示)。
②保持温度和压强不变,分别按不同进料比通入CH3OCH3和O2,发生反应Ⅰ。测得平衡时H2的体积百分含量与进料气中n(O2)n(CH3OCH3)的关系如图(a)所示。当n(O2)n(CH3OCH3)>0.6时,H2的体积百分含量快速降低,其最主要原因是_____(填标号)。
a.过量的O2起稀释作用
b.过量的O2与H2发生副反应生成H2O
c. n(O2)n(CH3OCH3)>0.6时平衡向逆反应方向移动
(2)T℃时,在刚性反应器中通入CH3OCH3,发生反应Ⅱ:CH3OCH3(g) =CO(g)+H2(g)+CH4(g) △H>0,测得容器内初始压强为41.6 kPa,反应过程中反应速率v(CH3OCH3)、时间t与分压P(CH3OCH3)的关系如图(b)所示。
①t=400 s时,CH3OCH3的分解率α=______(保留2位有效数字);
②反应速率满足v(CH3OCH3)=k Pn(CH3OCH3),n=,k=s-1;400 s时v(CH3OCH3)=kPa·s-1。
③一段时间后反应达到平衡,测得体系的总压强为121.6 kPa,则该反应的平衡常数Kp=kPa2。
④若提高该刚性反应器的温度,再次达到平衡后体系的压强P121.6 kPa(填“大于”、“等于”或“小于”),原因是。
18.(12分)环己烯是重要的化工原料。其实验室制备流程如下:
回答下列问题:
Ⅰ.环己烯的制备与提纯
(1)原料FeCl3·6H2O中若含FeCl2杂质,检验方法为:取一定量的该样品配成溶液,加入溶液(填化学式),现象为__________________。
(2)操作1的装置如图所示(加热和夹持装置已略去)。
①浓硫酸也可作该反应的催化剂,选择FeCl3·6H2O而不用浓硫酸的原因为___(填序号)。
a.浓硫酸易使原料碳化并产生SO2
b.FeCl3·6H2O污染小、可循环使用,符合绿色化学理念
c.同等条件下,用FeCl3·6H2O比浓硫酸的平衡转化率高
②仪器B的作用为____________。
(3)下列玻璃仪器中,操作2中需使用的有________(填标号)。
(4)将操作3(蒸馏)的步骤补齐:安装蒸馏装置,加入待蒸馏的物质和沸石,(填序号)。
①弃去前馏分,收集83℃的馏分②加热③通冷凝水
Ⅱ.环己烯含量的测定
在一定条件下,向a g环己烯样品中加入b mol Br2。充分反应后,向所得溶液中加入足量的KI,再用c mol/L的Na2S2O3标准溶液滴定该溶液,终点时消耗Na2S2O3标准溶液v mL(以上数据均已扣除干扰因素)。
[已知:]
(5)滴定所用指示剂为____________。样品中环己烯的质量分数为____________(用字母表示)。
(6)上述滴定完成后,若滴定管尖嘴处留有气泡会导致最终测定的环己烯含量偏。(填“高”或“低”)
19.(9分)某废旧锂电池材料含有钴酸锂(LiCoO2)、导电剂石墨和铝粉等。回收废旧锂电池中钴的工艺流程如下:
已知:Ksp(CoC2O4)=6.0×10-8,Ksp(CoCO3)=1.5×10-13。
回答下列问题:
(1) LiCoO2中,Co元素的化合价为。
(2)“浸出液”的主要成分是LiHC2O4、Al(HC2O4)3,“浸出渣”的主要成分是CoC2O4。“浸出”中生成CoC2O4的化学方程式为,若H2C2O4用量过大,CoC2O4的产率反而会降低,原因是____。
(3)“转化”中加入Na2CO3溶液发生反应的离子方程式为,该反应进行的程度较大,试通过计算其平衡常数K并解释原因。
(4)“电解”时装置如图所示。阳极的电极反应式为,电解后a室中的电解液可返回工序继续使用。
(5)某废旧锂电池粉末中LiCoO2的质量分数为49%,将50吨该废料进行回收利用,电解得到钴5.9吨,则钴的回收率为____。
20.(13分)芬太尼类似物L具有镇痛作用。它的合成方法如下:
已知:
回答下列问题:
(1)A是一种烯烃,化学名称为,其分子中最多有个原子共面。
(2) B中官能团的名称为、。②的反应类型为。
(3)③的化学方程式为。
(4)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。写出F的结构简式,用星号(*)标出F中的手性碳。G的结构简式为。
(5)已知④有一定的反应限度,反应进行时加入吡啶(一种有机碱),其作用是。
(6)参照上述合成路线,写出以环已烯()和乙醇为起始原料经三步制备化合物的合成路线。
(已知:其他试剂任选)
高二化学参考答案
一、选择题(本大题共15个小题,每题3分,共45分。): ABDAD CCDAB BCBBC
二、非选择题(本大题共5个小题,共55分)
16. (共10分) (1) (1分) 浓硝酸、浓硫酸、加热(1分) (2)还原反应(1分)
(3) (2分)
(4)2:1(1分) (5)C14H8N2O6Na2(1分) 4(1分) 1:1:1:1(1分) (6) (1分)
17. (共11分) (1)①(a+b-2c)kJ/mol(1分) ②b(1分)
(2)①16%(1分) ②1(1分) 0.00044(1分) 0.0154(1分) ③40000(2分) ④大于(1分)
温度提高,体积不变,总压强提高;反应Ⅱ为吸热反应,温度提高,平衡右移,体系物质的量增加,总压强提高。(2分)
18. (共10分) (1)K3[Fe(CN)6] (1分) 出现蓝色沉淀(1分) (2)①ab(1分) ②减少环己醇的蒸出(1分)
(3)ad(1分) (4)③② ① (1分) (5)淀粉溶液(1分) (2分) (6)高(1分)
19. (共11分) (1)+3(1分) (2) (2分)
(1分)
(3) CoC2O4(s)+ CO32-(aq)CoCO3(s) + C2O42-(aq) (1分)
该反应的平衡常数K= c(C2O42-)c(CO32-) = Ksp(CoC2O4)Ksp(CoCO3) = 6.0×10-81.5×10-13= 4×105,反应正向进行的趋势很大(2分)
(4) (1分) 酸溶(1分) (5)40%(2分)
20. (共13分) (1)丙烯(1分) 7(1分) (2)碳碳双键(1分)、氯原子(1分) 取代反应(1分)
(3) (2分)
(4) (1分) (1分) (5)吸收反应生成的HCl,提高反应转化率(1分)
(6) (3分)