- 267.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
宜昌市部分示范高中教学协作体2018年秋期末联考
高二化学
命题人:陈伦兵 审题人:杨闵卓
(全卷满分:100分 考试用时:90分钟)
相对原子质量:H:1 C:12 N:14 O:16 Na:23 Al:27 Ag:108 Cl:35.5 Cu:64 Mn:55
一、 选择题(每小题3分,共48分)
1、对中国古代著作涉及化学的叙述,下列解读错误的是( )
A.《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的碱是K2CO3
B.《天工开物》中“凡石灰,经火焚炼为用”里的“石灰”指的是Ca(OH)2
C.《黄白第十六》中“曾青涂铁,铁赤如铜”,其“曾青”是可溶性铜盐
D.《汉书》中“高奴县有洧水可燃”,这里的“洧水”指的是石油
2、通过控制或改变反应条件可以加快、减缓甚至阻止反应的进行,使化学反应有利于人类的生存和提髙生活质量。下列各图所示的措施中,是为了加快化学反应速率的是( )
3、某反应由两步反应AB C构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能)。下列有关叙述正确的是( )
A. 三种化合物的稳定性顺序:B﹤A﹤C
B. 两步反应均为放热反应
C. 加入催化剂不改变反应的焓变,但能提高产率
D. 整个反应的ΔH=E1-E2
4、下列方程式书写正确的是( )
A.NaHSO4在水溶液中的电离方程式:NaHSO4===Na++HSO
B.HF与NaOH溶液反应:H+(aq)+OH-(aq) = H2O(l) ΔH=-57.3 kJ/mol
C.1g H2燃烧生成液态水放出142.9 kJ的热量,其热化学方程式:
2H2(g)+ O 2(g) = 2H2O (l) ΔH = —142.9 kJ·mol-1
D.CaCO3沉淀溶解平衡方程式:CaCO3(s) Ca2+(aq)+CO(aq)
5、下列指定溶液中,各组离子可能大量共存的是( )
A.使石蕊变红的溶液中:Na+、Cl-、SO42-、AlO2-
B.在中性溶液中:Na+、Al3+、Cl-、HCO3-
C.常温下pH=13的溶液中:NH4+、Fe2+、NO3-、SO42-
D.由水电离出的c(H+)=10-13 mol·L-1的溶液中:Mg2+、Cl-、K+、SO42-
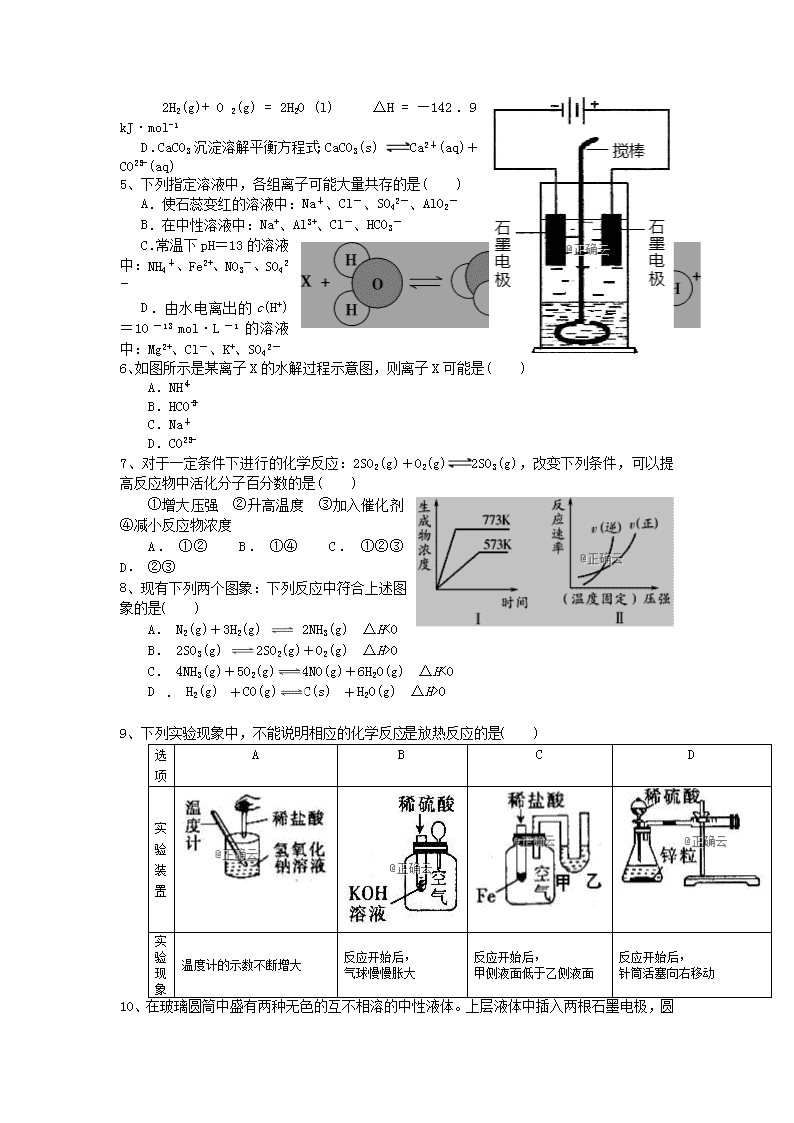
6、如图所示是某离子X的水解过程示意图,则离子X可能是( )
A.NH
B.HCO
C.Na+
D.CO
7、对于一定条件下进行的化学反应:2SO2(g)+O2(g)2SO3(g),改变下列条件,可以提高反应物中活化分子百分数的是( )
①增大压强 ②升高温度 ③加入催化剂 ④减小反应物浓度
A. ①② B. ①④ C. ①②③ D. ②③
8、现有下列两个图象:下列反应中符合上述图象的是( )
A. N2(g)+3H2(g) 2NH3(g) ΔH<0
B. 2SO3(g) 2SO2(g)+O2(g) ΔH>0
C. 4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH<0
D. H2(g)+CO(g)C(s)+H2O(g) ΔH>0
9、下列实验现象中,不能说明相应的化学反应是放热反应的是( )
选项
A
B
C
D
实验
装置
实验
现象
温度计的示数不断增大
反应开始后,
气球慢慢胀大
反应开始后,
甲侧液面低于乙侧液面
反应开始后,
针筒活塞向右移动
10、
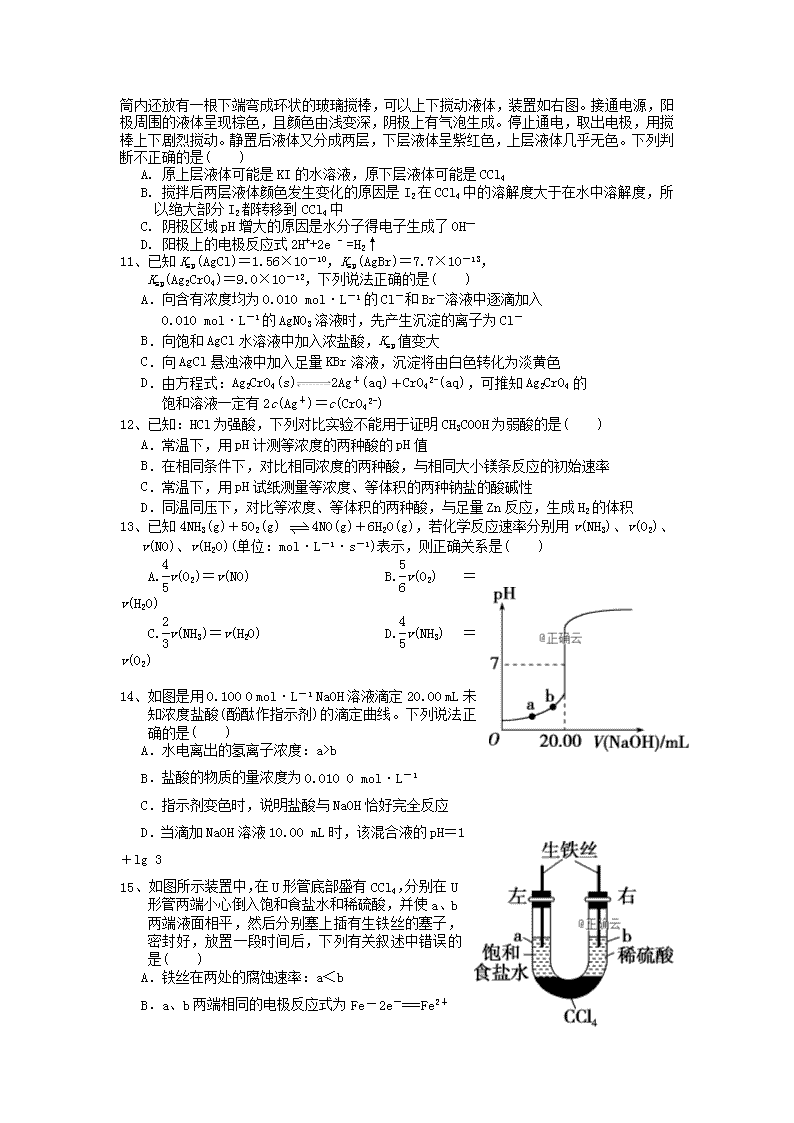
在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。下列判断不正确的是( )
A. 原上层液体可能是KI的水溶液,原下层液体可能是CCl4
B. 搅拌后两层液体颜色发生变化的原因是I2在CCl4中的溶解度大于在水中溶解度,所以绝大部分I2都转移到CCl4中
C. 阴极区域pH增大的原因是水分子得电子生成了OH—
D. 阳极上的电极反应式2H++2e - =H2↑
11、已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,
Ksp(Ag2CrO4)=9.0×10-12,下列说法正确的是( )
A.向含有浓度均为0.010 mol·L-1的Cl-和Br-溶液中逐滴加入
0.010 mol·L-1的AgNO3溶液时,先产生沉淀的离子为Cl-
B.向饱和AgCl水溶液中加入浓盐酸,Ksp值变大
C.向AgCl悬浊液中加入足量KBr溶液,沉淀将由白色转化为淡黄色
D.由方程式:Ag2CrO4(s)2Ag+(aq)+CrO42-(aq),可推知Ag2CrO4的
饱和溶液一定有2c(Ag+)=c(CrO42-)
12、已知:HCl为强酸,下列对比实验不能用于证明CH3COOH为弱酸的是( )
A.常温下,用pH计测等浓度的两种酸的pH值
B.在相同条件下,对比相同浓度的两种酸,与相同大小镁条反应的初始速率
C.常温下,用pH试纸测量等浓度、等体积的两种钠盐的酸碱性
D.同温同压下,对比等浓度、等体积的两种酸,与足量Zn反应,生成H2的体积
13、已知4NH3(g)+5O2(g) 4NO(g)+6H2O(g),若化学反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)(单位:mol·L-1·s-1)表示,则正确关系是( )
A.v(O2)=v(NO) B.v(O2)=v(H2O)
C.v(NH3)=v(H2O) D.v(NH3)=v(O2)
14、如图是用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL未知浓度盐酸(酚酞作指示剂)的滴定曲线。下列说法正确的是( )
A.水电离出的氢离子浓度:a>b
B.盐酸的物质的量浓度为0.010 0 mol·L-1
C.指示剂变色时,说明盐酸与NaOH恰好完全反应
D.当滴加NaOH溶液10.00 mL时,该混合液的pH=1+lg 3
15、如图所示装置中,在U形管底部盛有CCl4,分别在U形管两端小心倒入饱和食盐水和稀硫酸,并使a、b两端液面相平,然后分别塞上插有生铁丝的塞子,密封好,放置一段时间后,下列有关叙述中错误的是( )
A.铁丝在两处的腐蚀速率:a<b
B.a、b两端相同的电极反应式为Fe-2e-===Fe2+
C.一段时间后,a端液面高于b端液面
D.生铁丝中的碳在a、b两处分别作原电池的负极和正极
16、25 ℃,几种弱酸的电离常数如下:
弱酸
CH3COOH
HCN
H2S
电离常数(25 ℃)
1.8×10-5
4.9×10-10
K1=1.3×10-7
K2=7.1×10-15
下列说法正确的是( )
A.等物质的量浓度的各溶液pH关系为pH(CH3COONa)>pH(Na2S)>pH(NaCN)
B.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定大于b
C.NaHS和Na2S混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
D.某浓度HCN的水溶液pH=d,则其中c(OH-)=10-d mol/L
二、非选择题(共4题,共52分)
17、(14分) 完成并分析下列化学原理
(1)在配制三氯化铁溶液时,为了防止发生水解,可以加入少量的 。
(2)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是__ ____;
(3)除去CuCl2溶液中少量的FeCl3,加入的试剂可以是____ ___。
(4)在常温下,稀释等PH值的HCl、HF两种酸的稀溶液时,溶液pH随加水量的变化如图所示,能表示HF的稀释过程的曲线是:
(5)amol·L-1(NH4 )2SO4溶液pH=5,其原因是 _____(用相应的方程式说明)。
(6)有4种混合溶液,分别由等体积0.1 mol·L-1的两种溶液混合而成:①NH4Cl与 CH3COONa ②NH4Cl与HCl ③NH4Cl与NaCl ④NH4Cl与NH3·H2O(混合液呈碱性)。溶液中c(H+)由小到大的顺序为:(填混合溶液的编号)
(7)在做Zn与稀H2SO4反应制取H2的实验中,向溶液中滴加几滴CuSO4溶液,反应放出H2速度加快的原因是:
18、(13分)温室效应是由于大气里温室气体(二氧化碳、甲烷等)含量增大而形成的。回答下列问题:
(1)利用CO2可以制取甲醇,有关化学反应如下:
①CO2(g)+3H2(g)CH3OH(g)+H2O(g ) ΔH1=-178 kJ·mol-1
②2CO(g)+O2(g)2CO2(g) ΔH2=-566 kJ·mol-1
③2H2(g)+O2(g)2H2O(g) ΔH3=-483.6 kJ·mol-1
已知反应①中相关的化学键键能数据如下:
化学键
C—C
C—H
H—H
C—O
H—O
键能/kJ·mol-1
348
413
436
358
463
由此计算断开1 mol CO需要吸收____________kJ的能量。
(2)甲烷燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如图(1)所示:通入a气体的电极是原电池的______极(填“正”或“负”),其电极反应式为______ 。
图(1) 图(2)
(3)上图(2)是用甲烷燃料电池(电解质溶液为KOH溶液)实现铁上镀铜,则b处通入的是____(填“CH4”或“O2”),电解前,U形管的铜电极、铁电极的质量相等,电解2min后,取出铜电极、铁电极,洗净、烘干、称量,质量差为12.8g,在通电过程中,电路中通过的电子为_____mol,消耗标准状况下CH4______mL.
19、(11分)为测定某H2C2O4溶液的浓度,取25.00mL该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定。
(1)滴定实验反应的离子方程式为:__MnO4-+___H2C2O4+___H+=___Mn2++ 8H2O+___( )
(2)滴定时,KMnO4溶液应装在 (填“酸式滴定管”或“碱式滴定管”)中,达到滴定终点的现象为 。
(3)若滴定时,没用标准液洗涤滴定管,会使得草酸溶液的物质的量浓度_ _ (填“偏高”、“偏低”、“无影响”)
(4)取0.50 mol·L-1 H2SO4溶液30 mL与同浓度的NaOH溶液50 mL做中和热的实验,发现|△H|<57.3 kJ·mol-1,产生此偏差的原因可能是___ _(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.一次性把NaOH溶液倒入盛有H2SO4溶液的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
20、(14分)氮及其化合物是重要的化工原料
(1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭
容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示。其中温度为T1
时平衡混合气体中氨气的体积分数为25.0%。当温度由T1变化到T2时,平衡
常数关系K1 K2(填“>”、“<”或“=”),焓变△H 0(填“>”或“<”)。
(2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是 (填字母代号)。
a.增大压强 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
(3)已知:2NO2(g)N2O4(g),N2O4为无色气体。
① 在上述条件下反应能够自发进行,则反应的ΔH 0(填写“>”、“<”或“=”)
② 一定温度下,在密闭容器中反应2NO2(g)N2O4(g)达到平衡,达到平衡状态的标志 。
A.单位时间内生成n mol N2O4的同时生成2 nmolNO2
B.用NO2、N2O4的物质的量浓度变化表示的反应速率之比为2:1的状态
C.混合气体的颜色不再改变的状态
D.混合气体的密度不再改变的状态
E.混合气体的平均相对分子质量不再改变的状态
(4)17℃、1.01×105Pa,往10L密闭容器中充入NO2,达到平衡时,c(NO2)=0.2 mol·L-1,c(N2O4)=0.16 mol·L-1。则反应达到平衡时, NO2的转化率为 ;此温度下该反应的平衡常数K= .
宜昌市部分示范高中教学协作体2018年秋期末联考
高二化学参考答案
一、选择题(每小题3分,共48分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
答案
B
C
A
D
D
A
D
B
D
D
C
D
A
D
D
C
17、(2*7=14分)
(1) 稀盐酸或稀HCl
(2) Al2O3 或氧化铝
(3) 铜或氧化铜、氢氧化铜、碳酸铜、碱式碳酸铜(书写化学式正确得2分)
(4) HB
(5) NH4+ + H2ONH3·H2O+H+ (不是可逆等号扣2分)
(6) 由小到大的顺序为:(填编号) ④< ①< ③< ② (不写“<”不扣分)
(7) 形成锌—铜—稀硫酸原电池,加快反应速率。 (只书写Zn+Cu2+ =Zn2++Cu 得1分)
18、( 13分)
(1) 750 (3分)
(2) 负 (填“正”或“负”) (2分); CH4 + 2H2O - 8e- CO2 + 8H+(2分)
(3) O2(2分) 0.2mol(2分) 560mL(2分)
19、(11分)
(1) 2 5 6 2 10 CO2 (3分 配平正确2分,CO2正确得1分)
(2) 酸式滴定管(2分)(无“滴定管”三个字扣1分)
滴入最后一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色;(2分)
(3) 偏高2分)
(4) a d (2分)(选对一个得1分)
20、(2*7=14分)
(1) > (2分) <(2分)
(2) c (2分)
(3) <(填写“>”、“<”、“=”) (2分)
A C E(填1-2个正确得1分)(2分)
(4) 62% 或61.5% (2分) K= 4(2分)
宜昌市部分示范高中教学协作体2017年秋期末联考
高二化学命题双向细目表
题号
题型
分值
考查知识点
能力要求
试题难度
试题来源
1
选择题
3
STS 元化知识
阅读理解能力
中
2
选择题
3
STS 物质的腐蚀与防护
阅读理解能力
中
3
选择题
3
反应热
基本知识与识图能力
易
4
选择题
3
电离方程式、热化学方程式、
溶解平衡的书写
基本知识与技能
易
5
选择题
3
离子共存
基本知识与技能
中
6
选择题
3
电解质强弱的判定
基本知识与技能
中
7
选择题
3
活化理论
基本知识与技能
中
8
选择题
3
温度、压强对平衡的影响
基本知识与识图能力
中
9
选择题
3
反应热
基本知识与识图能力
中
10
选择题
3
电解与萃取的综合运用
综合运用能力
中
11
选择题
3
溶解平衡
基本知识与技能
易
12
选择题
3
水解
基本知识与识图能力
易
13
选择题
3
化学反应速率的基本运算
基本知识与技能
中
14
选择题
3
中和滴定
基本运算与识图能力
中
15
选择题
3
电化腐蚀
基本知识与技能
中
16
选择题
3
电解质溶液综合运用
综合运用能力
中
17--1
填空题
2
水解的运用
基本知识与技能
易
17--2
填空题
2
水解的运用
基本知识与技能
易
17--3
填空题
2
物质的除杂
基本知识与技能
易
17--4
填空题
2
水解原理
基本知识与技能
易
17--5
填空题
2
电解质溶液稀释PH的变化
基本知识与技能
易
17--6
填空题
2
混合溶液PH大小的比较
基本知识与技能
难
17--7
填空题
2
影响反应速率的因素
基本知识与技能
易
18--1
填空题
3
反应热的计算
理解运用与计算能力
难
18--2
填空题
4
燃料电池正负极判断及半反应的书写
理解运用能力
难
18--3
填空题
6
电子守恒的运用
计算能力
难
19--1
填空题
3
氧化还原方程式的缺项配平
基本知识与技能
中
19--2
填空题
4
氧化还原滴定仪器选择与终点判断
基本知识与技能
易
19--3
填空题
2
氧化还原滴定误差分析
基本知识与技能
中
19--4
填空题
2
中和热测定误差分析
基本知识与技能
中
20--1
填空题
4
平衡常数、反应热与温度变化的关系
基本知识与技能
中
20--2
填空题
2
影响反应速率和平衡的因素
综合运用能力
中
20--3
填空题
4
自由能运用、化学平衡的标志
综合运用能力
难
20--4
填空题
4
转化率与平衡常数的基本计算
基本知识与技能
中