- 480.00 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2017-2018学年湖北省汉川二中高二下学期期末考试化学试题
第一部分 化学反应原理(30分)
选择题:每题3×3分 = 9分;填空题:11+10=21分
1.某反应由两步反应ABC构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。
下列有关叙述正确的是
A.两步反应均为放热反应;
B.三种物质的稳定性:B﹤A﹤C
C.整个反应的ΔH=E1-E4;
D.加入催化剂不改变反应的焓变,但能提高产率
2. 下列说法正确的是
A. 某温度时,pH=6的纯水中,含离子为 mol
B. 含10.6g 溶液中,所含阴离子总数等于0.1mol
C. 电解精炼粗铜时,每转移1 mol电子,阳极上溶解的Cu原子数必为0.5 mol
D. V L a mol/L 溶液中 ,若数目为1 mol,则离子数目大于3 mol
3.常温下,用0.1000mol/L NaOH溶液滴定20.00mL 0.1000mol/L HCl溶液,滴定曲线如图。下列说法错误的是
A.a=20.00
B.滴定过程中,可能存在:c(Cl-)>c(H+)>c(Na+)>c(OH-)
C.若用酚酞作指示剂,观察到溶液由无色变为红色时即停止滴定
D.若将盐酸换成同浓度的醋酸,则滴定到pH=7时,a<20.00
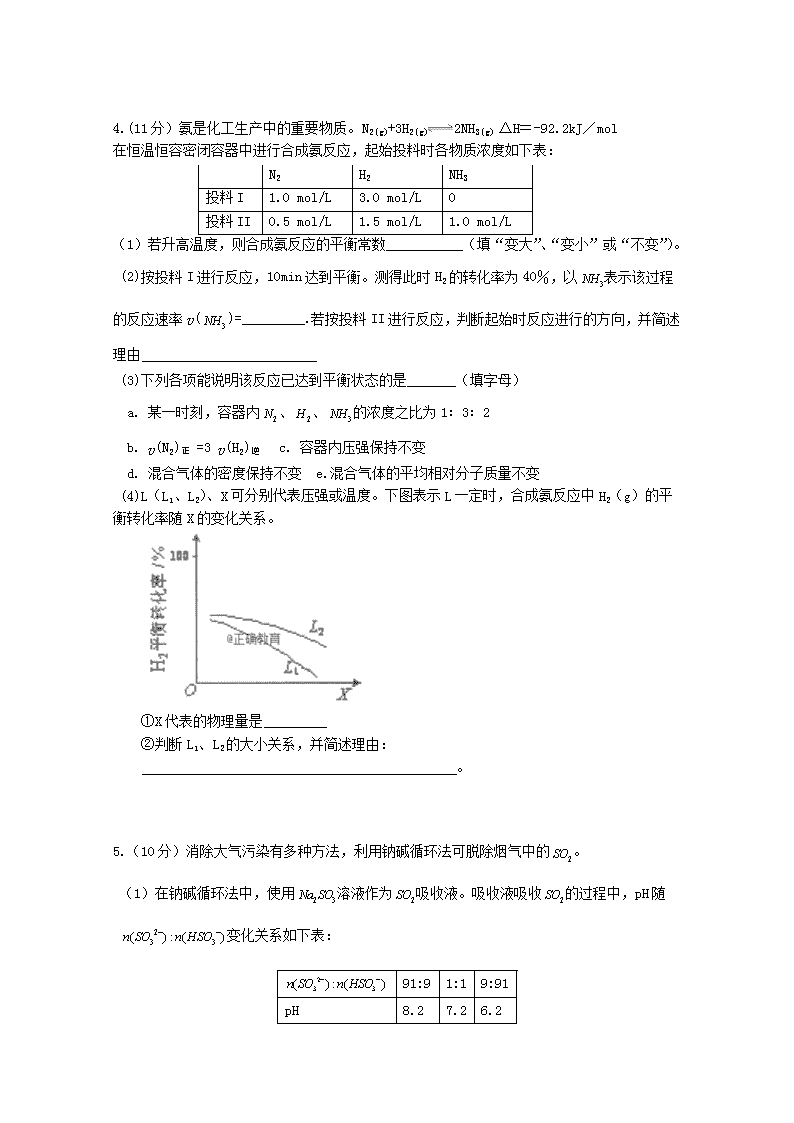
4.(11分)氨是化工生产中的重要物质。N2(g)+3H2(g)2NH3(g) △H=-92.2kJ/mol
在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
N2
H2
NH3
投料I
1.0 mol/L
3.0 mol/L
0
投料II
0.5 mol/L
1.5 mol/L
1.0 mol/L
(1)若升高温度,则合成氨反应的平衡常数___________(填“变大”、“变小”或“不变”)。
(2)按投料I进行反应,10min达到平衡。测得此时H2的转化率为40%,以表示该过程的反应速率v()=_________.若按投料II进行反应,判断起始时反应进行的方向,并简述理由
(3)下列各项能说明该反应已达到平衡状态的是_______(填字母)
a. 某一时刻,容器内、、的浓度之比为1﹕3﹕2
b. v(N2)正 =3 v(H2)逆 c. 容器内压强保持不变
d. 混合气体的密度保持不变 e.混合气体的平均相对分子质量不变
(4)L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系。
①X代表的物理量是_________
②判断L1、L2的大小关系,并简述理由:
。
5.(10分)消除大气污染有多种方法,利用钠碱循环法可脱除烟气中的。
(1) 在钠碱循环法中,使用溶液作为吸收液。吸收液吸收的过程中,pH随
变化关系如下表:
91:9
1:1
9:91
pH
8.2
7.2
6.2
①依据上表判断溶液显______性,联系相关原理,用化学用语解释:____________。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):___________。
a.
b.
c.
(2)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
①在阳极放电的电极反应式是________________。
②当阴极室中溶液pH升至8以上时吸收液再生并可循环利用。简述再生原理: 。
第二部分 有机化学基础 (70分)
选择题6×3分=18分,填空题12+6+6+10+18=52分
6.诗句“春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”和“泪”分别是( )
A.纤维素、脂肪; B.蛋白质、高级烃; C.淀粉、油脂; D.蛋白质、硬化油
7.下列实验能成功的是( )
A.向淀粉水解液中加入碘液判断淀粉是否发生了水解
B.用苯和浓溴水反应制溴苯
C.向CH3CH2Br中滴加AgNO3溶液观察沉淀颜色,判断卤代烃的类型
D.将CuSO4溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热,检验官能团
8.萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是
A.a能使溴的四氯化碳溶液褪色; B.b的一氯代物有5种;
C.c分子中所有碳原子均处于同一平面上; D.a和b、c都属于芳香族化合物
9.分子式为C5H12O且既可与金属钠反应放出氢气,又可分子内脱水
的有机化合物有(不考虑立体异构)
A.5种 B.6种 C.7种 D.8种
10.下图是以烃A为原料生产人造羊毛的合成路线。下列说法错误的是
A.烃A的结构简式为CH≡CH B.A生成C的反应属于加成反应
C.A生成D的反应属于取代反应 D.合成人造羊毛的反应属于加聚反应
11.用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如下图所示。下列说法错误的是
A. 装置A中恒压滴液漏斗使浓硫酸顺利滴下,同时控制其用量
B. 使用装置B可以平衡气压,防堵塞、防倒吸
C. 实验中为了防止反应物大量挥发,应缓慢升温到170℃
D. 装置D中使用冷水冷却,以避免溴的大量挥发
12.(12分)乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
实验步骤:
在A中加入4.4g异戊醇、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50 min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9 g。
回答下列问题:
(1) ①仪器A的作用是______________。②本实验中加入过量乙酸的目的是_______________。
(2)浓硫酸的作用是①__________;②__________
(3)在洗涤操作中,第一次水洗的主要目的是_____________________________,第二次水洗的主要目的是________________。
(4)在洗涤、分液操作中,应充分振荡,然后静置。待分层后,分出乙酸异戊酯粗品的操作是
________________________________________________
(5) 蒸馏之前,加入少量无水MgSO4的目的是________。蒸馏操作中,仪器选择及安装都正确的是________(填标号)。
(6)本实验的产率是________
13.(6分)某医用化学杂志曾报道,用合成纤维材料C制成的手术缝合线比天然肠线好。它的合成过程见下图:
―→B ―→C
(1)A的名称是 ;写出反应A―→B的化学方程式_______
(2)若A在一定条件下直接生成C,写出该反应的化学方程式________。
14.(6分)硝酸甘油(三硝酸甘油酯)是临床上常用的抗心率失常药.该药可以以丙烯为原料来合成制得.其合成步骤如下:
(1)步骤①反应条件为 ;
(2)上述合成步骤中,未涉及到的反应类型有(填序号) .
a.取代反应 b.加成反应 c.消去反应 d.氧化反应
(3)步骤⑤的化学方程式为
15.(10分)以葡萄糖为原料制得的山梨醇(A)和异山梨醇(B)都是重要的生物质转化平台化合物。E是一种治疗心绞痛的药物,由葡萄糖为原料合成E的过程如下:
回答下列问题:
(1)葡萄糖的结构简式为__________。(2)C的结构简式为__________。
(3)由D到E的反应方程式为______________。
(4)F是B的同分异构体,7.30 g的F与足量饱和碳酸氢钠作用可释放出2.24 L二氧化碳(标准状况),F的可能结构共有________种(不考虑立体异构),其中核磁共振氢谱为三组峰,峰面积比为3∶1∶1的结构简式为_________。
16.(18分)扁桃酸衍生物是重要的医药中间体,以A和B为原料合成扁桃酸衍生物F路线如下:
(1)A的分子式为C2H2O3,可发生银镜反应,且具有酸性,A所含官能团名称为:_________,
写出A+B→C的化学反应方程式为__________________________.
(2)中①、②、③3个“—OH”的酸性由强到弱的顺序是:_____________。
(3)E是由2分子C生成的含有3个六元环的化合物,E的分子中不同化学环境的氢原子有_______种。
(4)1mol F在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为:________mol。
写出符合下列条件的F的所有同分异构体(不考虑立体异构)的结构简式:
①属于一元酸类化合物,②苯环上只有2个取代基且处于对位,③能够使FeCl3溶液显紫色
(5)已知:
A有多种合成方法,在方框中写出由乙酸合成A的路线流程图(其他原料任选)合成路线流程图示例如下:
参考答案
第一部分 化学反应原理
T1 B T2 D T3 C (每题3分,共12分)
T4 (11分)第1空1分,其余每空2分
(1)变小(1分)
(2) 0.08mol/(L·min);逆向移动; 因为此时QC >K;
(3)c e
(4) ①温度 ② L1