- 473.00 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2017 年秋季鄂东南省级示范高中教育教学改革联盟学校期中联考
6.已知:
CH3
CH3
CH3
H
ΔH =-4.0kJ/mol,下列说法中正确的是( )
高二化学试卷
H H
(顺-2-丁烯)
H CH3
(反-2-丁烯)
考试时间: 11 月 14 日 10:00—11:30 试卷满分:100 分
可能用到的相对原子质量:H-l C-12 O-16 Na-23 Mn-55
第 I 卷
一、选择题(本题包括 16 小题,每小題 3 分,共 48 分。在每个小題只有一项是符合題目要求。)
1.我们生活在千变万化的物质世界里。下列的过程或变化与电化学原理无关的是( ) A.iPhone7 手机电池放电 B.铁锁镀铜 C.浸泡在洪水中的铁门生锈 D.铁制品经钝化处理后不易生锈
2.下列事实不能用勒夏特列原理解释的是( )
可乐开瓶
旺仔牛奶夏天变质
合成氨时加压
氯水光照时颜色变浅
A
B
C
D
3.化学与生产、生活和科研密切相关。下列说法正确的是( )
A. 手机上使用的锂电池、玩具上使用的碱性锌锰电池均是二次电池 B.硅太阳能电池利用的是原电池原理 C.潮汐、地热、阳光均是新能源 D.银饰品久置变暗属于电化学腐蚀
4.在一定条件下,当可逆反应:2HCl(g)+CuO(s) H2O(g)+CuCl2(s) ΔH>0 达到化学平衡 时,改变下列某一条件,能提高 HCl (g)的转化率的是( )
A.升高温度 B.增大容器的体积
C.加入催化剂 D.再加入一定量的 CuO
5.将 1mol 氨基甲酸铵(H2NCOONH4)置于密闭容器中(假设容器体积不变,固体试样体积忽略 不计)。在恒定温度下使其分解达到平衡:H2NCOONH4(s)2NH3(g)+CO2(g),下列 能说明该化学反应达到平衡状态的是( )
A.正、逆反应速率都为零 B.体系压强保持不变
C.c(NH3):c(CO2)=2:1 D.CO2 的体积分数保持不变
A.顺—2—丁烯比反—2—丁烯稳定
B.顺—2—丁烯分子比反—2—丁烯分子能量低 C.等物质的量的顺—2—丁烯和反—2—丁烯分别与足量氢气反应,后者放出的热量多 D.等物质的量的顺—2—丁烯和反—2—丁烯分别与足量氢气反应,前者放出的热量多
7. 下列化学用语表述正确的是( ) A.在低温下该反应:4M(s)+N(g)+2W(l) 4Q(s) ΔH>0 能自发进行 B.在潮湿空气中,钢铁的表面形成水膜时,正极的电极反应式:2H++2e-=H2 ↑ C.中和热:57.3kJ/mol,则表示中和反应的热化学方程式:
H2SO4(aq)+2NaOH(aq)===Na2SO4(aq)+2H2O(l) ΔH =-114.6kJ·mol-1
=====
D.用铜作电极电解饱和氯化钠溶液:2Cl-+2H2O 电解 2OH-+H2↑+Cl2↑
8.设 NA 代表阿伏加德罗常数的数值,下列说法正确的是( )
A.1mol I2(g)和 3 mol H2 在一定条件下反应,所得混合气体分子数小于 4NA
B.一定条件下恒容容器中,3 mol H2(g)和 1 mol N2(g)发生反应:3H2(g)+N2(g) 2NH3(g) ΔH
=-Q kJ/mol,当该反应放出 0.25Q kJ 的热量时,容器中的氢分子数为 0.75NA
C.用铅蓄电池电解氯化钠溶液,当得到标准状况下的氢气 22.4L 时,理论上消耗氢离子的数目 为 2NA
D.H2O2 常用作燃料电池的正极原料,当消耗 1mol H2O2 时转移的电子数为 2 NA
9. 在硫酸盐还原菌的作用下,深埋在潮湿土壤中的铁管道能被硫酸根腐蚀,其电化学腐蚀原理如 图所示,下列有关表述正确的是( )
A.铁管道发生的是吸氧腐蚀
B.输送暖气的管道也易发生此类腐蚀 C.这种情况下,土壤中的 pH 增大 D.管道上刷富铜油漆可以延缓铁管道的腐蚀
10.碳呼吸电池被《科学美国人》评为近几年十大创新技术之首,电池的电极材料采用的是铝和多 孔碳构成,铝、二氧化碳在电池内部发生反应,产生电能并生成 Al2(C2O4)3。下列有关说法中 错误的是( )
A.负极反应式:Al-3e-=Al3+
B.正极反应式:2CO2+2e-=C2O42-
C.每得到 1 mol 草酸铝,电路中转移 3 mol 电子
2-
D.电池放电时 C2O4
由正极向负极迁移
鄂东南省级示范高中教育教学改革联盟学校期中联考 高二化学试卷(共 8 页)第 1页 鄂东南省级示范高中教育教学改革联盟学校期中联考 高二化学试卷(共 8 页)第 2页
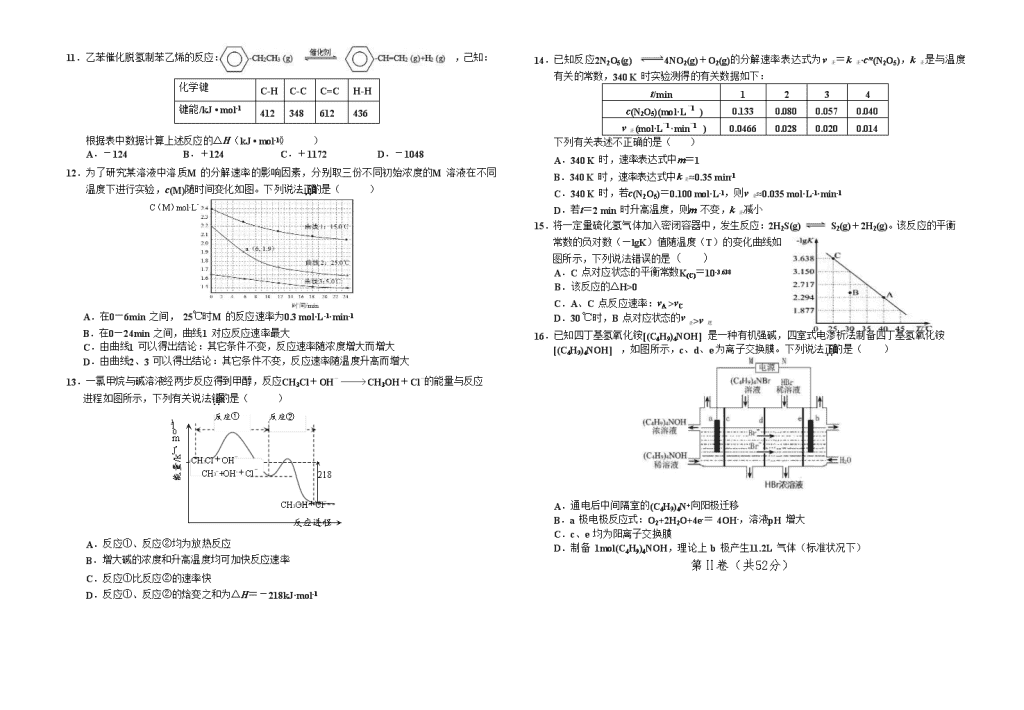
11.乙苯催化脱氢制苯乙烯的反应: ,己知:
14.已知反应 2N2O5(g) 4NO2(g)+O2(g)的分解速率表达式为 v 正=k 正·cm(N2O5),k 正是与温度 有关的常数,340 K 时实验测得的有关数据如下:
化学键
C-H
C-C
C=C
H-H
键能/kJ • mol-1
412
348
612
436
c(N2O5)(mol·L )
v 正(mol·L
·min )
t/min
1
2
3
4
-1
0.133
0.080
0.057
0.040
-1 -1
0.0466
0.028
0.020
0.014
根据表中数据计算上述反应的△H(kJ • mol-1)( )
A.-124 B.+124 C.+1172 D.-1048
下列有关表述不正确的是( )
A.340 K 时,速率表达式中 m=1
12.为了研究某溶液中溶质 M 的分解速率的影响因素,分别取三份不同初始浓度的 M 溶液在不同
B.340 K 时,速率表达式中 k
正≈0.35 min-1
温度下进行实验,c(M)随时间变化如图。下列说法正.确.的是( )
C.340 K 时,若 c(N2O5)=0.100 mol·L-1,则 v 正≈0.035 mol·L-1·min-1
1
C(M)mol·L-
D.若 t=2 min 时升高温度,则 m 不变,k
正减小
15.将一定量硫化氢气体加入密闭容器中,发生反应:2H2S(g) S2(g)+2H2(g)。该反应的平衡 常数的负对数(—lgK)值随温度(T)的变化曲线如
图所示,下列说法错误的是( )
A.C 点对应状态的平衡常数 K(C)=10-3.638
B.该反应的△H>0
C.A、C 点反应速率:vA >vC
A.在 0—6min 之间, 25℃时 M 的反应速率为 0.3 mol·L-1·min-1
D.30 ℃时,B 点对应状态的 v
正>v 逆
B.在 0—24min 之间,曲线 1 对应反应速率最大
C.由曲线 1 可以得出结论:其它条件不变,反应速率随浓度增大而增大
D.由曲线 2、3 可以得出结论:其它条件不变,反应速率随温度升高而增大
13.一氯甲烷与碱溶液经两步反应得到甲醇,反应 CH3Cl+OH- ¾¾® CH3OH+Cl-的能量与反应 进程如图所示,下列有关说法错.误.的是( )
1
-
l
o
m
·
J
反应① 反应②
16.已知四丁基氢氧化铵[(C4H9)4NOH] 是一种有机强碱,四室式电渗析法制备四丁基氢氧化铵
[(C4H9)4NOH] ,如图所示,c、d、e为离子交换膜。下列说法正.确.的是( )
能量/k
CH3Cl+OH-
CH3++OH-+Cl-
218
-
CH3OH+Cl
A.通电后中间隔室的(C4H9)4N+向阳极迁移
A.反应①、反应②均为放热反应
B.增大碱的浓度和升高温度均可加快反应速率
C.反应①比反应②的速率快
反应进程
B.a 极电极反应式:O2+2H2O+4e-= 4OH-,溶液 pH 增大
C.c、e 均为阳离子交换膜
D.制备 1mol(C4H9)4NOH,理论上 b 极产生 11.2L 气体(标准状况下)
第Ⅱ卷(共 52 分)
D.反应①、反应②的焓变之和为△H=-218kJ·mol-1
17. (11 分)硫酸镁可以用作制革、炸药、造纸、肥料以及医疗制药等。300℃时,向 2L 的恒容密
闭容器中加入 MgSO4(s)和 CO(g),发生反应:MgSO4(s)+CO(g) MgO(s)+CO2(g)+SO2(g)
反应过程中测定的部分数据见下表
反应时间/min
n(MgSO4)/mol
n(CO)/mol
n(CO2) / mol
0
2.00
2.00
0
2
0.80
4
1.20
回答下列问题:
(1)反应在 0~2min 内的平均速率为 v(SO2)= 。
(2)能判断该反应已经达到平衡状态的是 。
A.CO 的 生成速率与 CO2 的消耗速率相等 B.容器内压强保持不变
C.容器内气体的密度保持不变 D.容器内各气体的浓度保持不变
(3)要提高上述反应的转化率,可采取的措施是 (任写一种)。
(4)温度为 300℃时,该反应的化学平衡常数 K= ,若升高温度,反应的平衡常数变为
1.00,则正反应为 热(填“吸”或“放”)反应,该反应在 温(填“高”或“低”) 下能自发进行。
(5)保持其他条件不变,若起始时向容器中充入 1.00mol MgSO4 和 1.00molCO,到达平衡时 n(CO2)
(填“>”、“<”或“==”)0.60mol。
18.(8 分)钙、铅均是重要的金属元素,在工农业生产中有着广泛的应用。
(1)加热条件下用 CO 还原 PbO 可得到单质铅。己知:
① 2Pb(s)+O2(g)==2PbO(s) △H=-438kJ/mol
② 2CO(g)+O2(g)==2CO2(g) △H=-566kJ/mol
则 CO 还原 PbO 的热化学方程式为 。
(2)与 CaSO4•2H2O 脱水反应相关的热化学方程式有:
(4)目前工业上合成电石主要采用无焰氧化加热法。
已知:CaO(s)+3C(s)CaC2(s)+CO(g) ΔH=+464.1 kJ·mol-1
C(s)+1O2(g) CO(g) ΔH=-110.5 kJ·mol-1
2
若不考虑热量耗散,原料转化率均为100%,最终炉中出来的气体只有CO。则为了维持热平衡, 每生产1 mol CaC2,投料的量为1 mol CaO、 mol C及 mol O2。
19.(11 分)某学校化学兴趣小组设计如下实验探究铁的电化学腐蚀原理:
(1)实验一:甲小组同学设计如下实验图 1 证明铁发生了电化学腐蚀。
装置
分别进行的实验
现象
a.连接好装置,一段时间后,向烧杯中滴加酚酞
碳棒附近溶液变红
b.连接好装置,一段时间后,向烧杯中滴加
K3[Fe(CN)6]
铁片表面产生蓝色沉淀
①用化学用语解释实验 a 中的现象: 。
②写出实验 b 中生成蓝色沉淀的离子反应方程式 。
③已知 K3[Fe(CN)6]具有氧化性。据此有同学认为仅通过 b 中现象不能证明铁发生了电化学腐蚀, 理由是 。
(2)实验二:乙小组向图 2 所示装置的烧杯 a、b 中分别加入 30 mL 3.5% 的 NaCl 溶液,闭合 K,指针未发生偏转。加热烧杯 a,指针向右偏 转。
①分别取 a、b 中溶液少量于试管中,滴加 K3[Fe(CN)6]溶液,a 中出 现蓝色沉淀,b 中无变化,则 b 中铁片作 极。
H
CaSO4•2H2O(s)==CaSO4•1
2
2O(s)+3H2O(g)△H1=+83.2KJ•mol﹣1
2
②加热后,指针发生偏转的原因可能是 。
CaSO4•2H2O(s)==CaSO4(s)+2H2O(l)△H2=+26KJ•mol﹣1
(3)实验三:丙小组向图 2 所示装置的烧杯 a、b 中各加入 30 mL 不同
H2O(g)=H2O(l)△H3=﹣44KJ•mol﹣1
实验
a
b
指针偏转方向
Ⅰ
0.1%
0.01%
向右
Ⅱ
0.1%
3.5%
向左
Ⅲ
3.5%
饱和溶液
向右
H
则反应 CaSO4•1H2O(s)==CaSO4(s)+1
2O(g)的△H4= KJ•mol﹣1.
质量分数的
NaCl
溶液,实验记录如下表所示。
2 2
(3)在 2 000 ℃时,已知热化学方程式
①CaO(s)+C(s) Ca(g)+CO(g) ΔH1=a kJ·mol-1
②Ca(g)+2C(s)CaC2(s) ΔH2=b kJ·mol-1
③2CaO(s)+CaC2(s) 3Ca(g)+2CO(g) ΔH3
则ΔH3= kJ·mol-1(用含a、b的代数式表示)。
则实验Ⅱ的 b 烧杯中发生的电极反应式是 。
20.(10 分)硫及其化合物在日常生活中有着广泛的应用。
(1)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见下表),其相关反 应的平衡常数的对数值与温度的关系如图 3。
21.(12 分)某研究小组采用矿浆电解法从复杂锑铅矿(主要成分为 Sb2S3、PbS、FeS)中提取金属 锑,实现了锑、铅的一步分离。其工艺流程图如下:
相关反应
反应热
平衡常数 K
FeS2(s) + H2(g) FeS(s) + H2S(g)
ΔH1
K1
1/2 FeS2(s) + H2(g) 1/2Fe(s)+H2S(g)
ΔH2
K2
FeS(s) + H2(g) Fe(s)+H2S(g)
ΔH3
K3
NH4Cl、HCl
金属锑
Fe 2 O 3 • nH 2 O
矿Ⅰ 电解
锑铅矿 电 浆
阳极余液
N a C l O 3
解槽
I
Ⅱ
阳极渣
2 过滤
●
滤液
NH4Cl 溶液
Ⅲ 硫磺 滤渣
0 lgK2
●
NH4HCO3 溶液
已知:PbS、PbCl2、Sb2S3 不溶于水,只溶于浓盐酸,Sb3+ + 6Cl‾
碳酸铅
6
SbCl 3- 。
lgK
-2
-4
lgK3
●
(1)锑铅矿在反应前要进行充分粉碎的目的是 。
(2)金属锑是 (选填:“阴极”或“阳极”)产物, 金属硫化物会在阳极区因硫元素被氧 化而溶解,写出 Sb2S3 在阳极溶解的电极反应式 。
(3)在阳极区,加入 NH4Cl 可以提高电解时 SbCl3 的溶解度,请用化学平衡的理论知识解释原因
。
400 600 800 1000 1200 1400
(4)如图 5,用锑作电极进行电解(不考虑锑失电子),
图 3 T / K
①上述反应中,ΔH1 0(选填:“>”或“<”)。
②提高硫的脱除率可采取的措施有 (举 1 例)。
③1000K 时,平衡常数的对数 lgK1、lgK2 和 lgK3 之间的关系为 。
(2)右图 4 是 Li/FeS2 电池的装置,该电池具有比能量高、互换性强、绿色 环保和贮存时间长等优点。
①在 Li/FeS2 电池中,金属锂作 极(选填:“正”或“负”)。
则 Sb(1)电极的反应式为 ;碱性条件下,用 Sb(2)电极排 出的 S O2- 溶液吸收 NO2,使其转化为 N2,同时有 SO2- 生成。若阳极转移电子 6 mol,则理论
②电池放电反应为 FeS2+4Li==Fe+4Li++2S2-。该反应可认为分两步 进行:第 1 步反应是 FeS2+2Li==2Li++FeS22-,则第 2 步正极的电 极反应式为 。
2 4
上吸收 NO2
3
气体 mol。
2017年秋季鄂东南省级示范高中教育教学改革联盟学校期中联考
高二化学参考答案
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
D
B
C
A
B
D
C
D
C
C
B
C
C
D
D
C
17. (11分)
(1)0.3 mol·L-1·min-1 (1分)
(2)BCD (2分) (3) 减压或及时分离CO2(g)或 SO2(g)等(2分)
(4)0.9 mol·L-1(2分) 吸(1分) 高(1分)(5)>(2分)
18. (8分)
(1) PbO(s)+CO(g)==Pb(s)+ CO2(g) △H=-64kJ/mol(2分)
(2)+30.8(2分) (3)(2a-b)(2分) (4)7.2(1分) 2.1(1分)
19. (11分)
(1)①O2+2H2O+4e﹣═4OH﹣(2分)
②3Fe2++2[Fe(CN)6]3-==Fe3[Fe(CN)6]2↓(2分)
③铁电极能直接和K3[Fe(CN)6]溶液发生氧化还原反应生成Fe2+,会干扰由于电化学腐蚀负极生成Fe2+的检验;(2分)
(2)① 正 (1 分) ② 温度升高,Fe还原性增强 ,反应速率加快 (2 分)
(3) Fe-2e- == Fe2+ (2 分)
20. (10分)
(1)①> (2分) ②升高温度(或提高氢气的浓度或及时除去生成的H2S)(2分)
③2lgK2=lgK1+lgK3(2分)
(2)①负 (2分)
② FeS+2e-==2S2-+Fe(2分)
21. (12分)
(1) 增大接触面积,加快反应速率(2分)
(2) 阴极(2分)Sb2S3 + 12Cl--6e- == 3S + 2SbCl63-或Sb2S3-6e- == 3S + 2Sb3+ (2分)
(3)提高氯离子浓度,使Sb3+ + 6Cl- SbCl63-正向移动 (2分)
(4)SO2+2H2O-2e-==SO+4H+ (2分)1.5(2分)
说明:化学方程式书写,未标“↓”、“↑”或未写条件的扣一分,配平错误不得分。
1. D解析:D项铁经钝化处理后表面会形成致密的氧化物保护膜,此变化与电化学原理无关。
2. B解析:旺仔牛奶夏天变质与勒夏特列原理无关,故选B。
3.C解析:碱性锌锰电池是一次电池,故A项错误;硅太阳能电池是将太阳能转化为电能,原电池是将化学能转化为电能,二者原理不同,故B项错误;银饰品久置变暗属化学腐蚀,D项错误。
4.A解析:升高温度,平衡向正反应方向移动,故A项正确。
5.B解析:该反应是气体体积发生变化的反应,压强改变能作为到达平衡的标志。NH3(g)与CO2(g)的体积比始终为2:1,故其体积分数保持不变不能作为到达平衡的标志。
6.D解析:由热化学方程式可知,该反应放热。故顺-2-丁烯分子比反-2-丁烯分子能量高,反-2-丁烯较稳定,等物质的量的顺-2-丁烯和反-2-丁烯分别与足量氢气反应,放出的热量不相等,前者放出的热量多。
7.C解析:4M(s)+N(g)+2W(l)4Q(s)为熵减反应,低温下能自发进行,说明该反应一定是放热反应,故A错误;钢铁在潮湿空气中,表面形成水膜时发生吸氧腐蚀故B项错误;D项,金属铜作阳极时,铜电极本身失去电子,阳极反应为Cu-2e-===Cu2+,阴极是水中的氢离子放电,故电解原理方程式为Cu+2H2OCu(OH)2↓+H2↑,故D错误。
8.D解析: I2(g)和H2在一定条件下反应,反应前后气体分子数不变,故所得混合气体分子数为4NA,故A项错误;由题可知有0.25 mol N2参加反应,反应掉H2为0.75 mol,剩余2.25 mol H2,故B项错误;铅蓄电池电解氯化钠溶液,得到标准状况下的氢气22.4L,理论上铅蓄电池中消耗氢离子个数为4NA,故C项错误。
9.C解析:由题意可知,原电池的正极发生还原反应,由图示可知发生的电极反应为SO42-+5H2O+8e-=HS-+9OH-,故不是发生吸氧腐蚀,故A错误;硫酸盐还原菌是蛋白质,在高温下易变性,失去催化效率,则输送暖气的管道不易发生此类腐蚀,故B错误;管道上刷富铜油漆,形成Cu—Fe原电池,Fe作为负极,可以加快管道的腐蚀,故D错误。C项正确。
10.C解析:金属铝是负极,失电子生成草酸铝,所以每得到1 mol草酸铝,电路中转移3×2=6mol电子,故C错误。
11.B解析:反应热=反应物总键能-生成物总能键能,由有机物的结构可知,应是-CH2CH3中总键能与-CH=CH2、H2总键能之差,故△H=(5×412+348-3×412-612-436)kJ•mol-1=+124kJ•mol-1,故选B。
12.C解析:A项在0-6min之间,25℃时M的浓度减少2.2-1.9=0.3mol/L,则M的反应速率0.3mol/L/6min=0.05mol·L-1.min-1错误;B项在相同时间内曲线2的浓度的变化最大,所以反应速率最大,错误;C项由曲线1可知,随着反应的进行,R的浓度逐渐减小,在每个6min内浓度的变化越来越小,则速率逐渐减小,说明其它条件不变,速率随浓度增大而增大,正确;D项曲线3的温度低于曲线2,浓度也低于曲线2,所以分解速率小于曲线2,不能说明分解速率随温度升高而增大,而曲线1与曲线2相比,曲线2的浓度低于曲线1,温度高于曲线1,在前12min内曲线2的速率却大于曲线1,说明速率随温度升高而增大,错误。
13.C解析:本题考查反应热和化学反应速率知识。反应①的活化能比反应②大,故①反应速率要慢。
14.D解析:由表中数据可知,c(N2O5)浓度之比等于v正之比,则v正与 c(N2O5)浓度成正比关系,故m=1,故A正确;v正与 c(N2O5)浓度成正比关系,则m=1,由2min数据可知,0.028mol.L-1.min-1=k正×0.080mol.L-1,解得k正≈0.35min-1,故B正确;340K时,若c(N2O5)=0.100mol.L-1,则v正≈0.35min-1×0.35min-1=0.035mol.L-1.min-1,故C正确;升高温度,反应速率加快,k正是与温度有关的常数,不影响m值,根据v正=k正.c(N2O5)可知k正增大,故D错误。
15. D解析:C点-lgK=3.638,则平衡常数K=10-3.638,故A正确;-lgK越大,则平衡常数K越小,由图可知,随温度升高,平衡常数增大,则升高温度平衡正向移动,正反应为吸热反应,该反应的△H>0,故B正确;A点温度高于C点,vA >vC,故C正确;B点浓度商大于平衡常数,反应向逆反应进行,则B点对应状态的υ正<υ逆,故D错误。
16.C解析:以四丁基溴化铵[(C4H9)4NBr]为原料,采用电渗析法合成(C4H9)4NOH的过程中,据溴离子的移动方向可知,a为阴极b为阳极,(C4H9)4N+向阴极迁移,故A项错误;据图分析,生成HBr浓溶液,说明阳极上不是溴离子放电,阳极电极反应式为2H2O-4e-=O2↑+4H+,故B错误;阳极上不是溴离子放电,则e不是阴离子交换膜,是阳离子交换膜,据左池产物分析,c也是阳离子交换膜,故C正确;b电极为OH-放电生成氧气,生成标准状况下11.2L氧气需要2mol OH-放电,即 可制备2mol(C4H9)4NOH,故D错误。
17.(11分)(1)0.3 mol·L-1·min-1 (1分)
(2)BCD (2分) (3) 减压或及时分离CO2(g)或 SO2(g)等(2分)
(4)0.9mol·L-1 (2分) 吸(1分) 高(1分)
(5)>(2分)
解析:(1)由表中数据,可知2min内△n(CO)=2mol-0.8mol=1.2mol,由方程式可知△n(SO2)=△n(CO)=1.2mol,则v(SO2)=0.3mol/(L.min);(2)生成CO的速率和消耗CO2的速率均是表示逆反应,故A项错误,即选BCD。(3)减压或及时分离CO2(g)或 SO2(g)等。(4)平衡时c(SO2)=c(CO2)=0.6mol/L,c(CO)=0.4mol/L,则平衡常数K=0.9,若升高温度,反应的平衡常数变为1.00,大于原温度下平衡常数0.9mol·L-1,说明升高温度平衡正向移动,升高温度平衡向吸热反应移动,故正反应为吸热反应,该反应是熵增的反应,其△H>0,故在高温条件下才能使△G<0。保持其他条件不变,起始时向容器中充入1.00mol MgSO4和1.00molCO,等效为在原平衡基础上减小压强,平衡正向移动,CO转化率大于原平衡,则到达平衡时n(CO2)>0.60mol。
18.(8分)(1)CO(g)+PbO(s)=Pb(s)+CO(g)△H=-64kJ/mol(2分)
(2)+30.8(2分) (3)(2a-b)(2分) (4)7.2(1分) 2.1(1分)
解析:(1)①2Pb(s)+O2(g)=2PbO(s)△H=-438kJ•mol﹣1
②2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol﹣1
由②-①/2得,CO(g)+PbO(s)=Pb(s)+CO(g)△H=-64kJ/mol。
(2)已知①CaSO4•2H2O(s)═CaSO4•H2O(s)+H2O(g)△H1=83.2kJ•mol﹣1
②CaSO4•2H2O(s)═CaSO4(s)+2H2O(l)△H2=26kJ•mol﹣1
③H2O(g)=H2O(l)△H3=﹣44kJ•mol﹣1
将②﹣③×2﹣①得CaSO4•H2O(s)═CaSO4(s)+H2O(g),则△H4=[26kJ•mol﹣1﹣(﹣44kJ•mol﹣1)×2﹣83.2kJ•mol﹣1]=+30.8kJ•mol﹣1;
(3) 由反应,②CaO(s)+C(s)⇌Ca(g)+CO(g)△H1=a kJ•mol-1;③Ca(g)+2C(s)⇌CaC2(s)△H2=b kJ•mol-1;根据盖斯定律,目标反应的反应热为:②×2-③得△H3=(2a-b)kJ•mol-1;
(4)若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO.则为了维持热平衡,所以每生产1molCaC2,则投料的量为:1molCaO、而投入碳的量为:3mol+=7.2mol,氧气的物质的量为:×1/2=2.1mol。
19.(11分)(1)①O2+2H2O+4e﹣═4OH﹣(2分)
②3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓(2分)
③铁电极能直接和K3[Fe(CN)6]溶液发生氧化还原反应生成Fe2+,会干扰由于电化学腐蚀负极生成Fe2+的检验;(2分)
(2)① 正 (1 分)
② 温度升高,Fe还原性增强 ,反应速率加快 (2 分)
(3) Fe-2e- = Fe2+ (2分)
解析:(1)装置为铁的吸氧腐蚀,铁为负极,碳棒为正极,正极发生 O2+2H2O+4e﹣═4OH﹣,呈碱性,滴加酚酞,溶液变红,实验a中的现象是碳棒附近溶液变红,用化学用语解释实验i中的现象:碳棒为正极,故答案为:O2+2H2O+4e﹣═4OH﹣; ②3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓;可能为铁电极能直接和K3[Fe(CN)6]溶液发生氧化还原反应生成Fe2+,产生的Fe2+再与K3[Fe(CN)6]反应生成蓝色沉淀。(2)①K3[Fe(CN)6]溶液与二价铁离子反应生成蓝色沉淀,而取a、b中溶液少量,滴加K3[Fe(CN)6]溶液,a中出现蓝色沉淀,说明a中生成二价铁离子,b中无变化,b中没有二价铁离子生成,所以a做负极,b做正极; ②加热后,指针发生偏转的原因可能是:温度升高,Fe还原性增强,反应速率加快;(3)依据图表中Ⅱ组数据及指针向左偏转,则可知:b极为负极,失去电子发生氧化反应,电极反应式:Fe-2e-=Fe2+;
20.(10分)(1)①> (2分)
②升高温度(或提高氢气的浓度或及时除去生成的H2S)(2分)
③2lgK2=lgK1+lgK3(2分)
(2)① 负(2分)
② FeS+2e-=2S2-+Fe(2分)
解析:(1)①由图像可知,随温度升高,lgK1增大,即K1增大,平衡向正反应方向移动,正反应是吸热反应。② 由①分析可知:3个反应均为吸热反应,升高温度,平衡均向正反应方向移动。③由盖斯定律可得反应②×2=①+③,有(K2)2=K1×K2,有2lgK2=lgK1+lgK3。
(2)负极反应式为Li-e-=Li+,用总反应减去第1步反应得,2Li + FeS=Fe + 2Li++2S2-,用该反应减去负极反应式,消去Li+即可得正极反应式的第2步。
21.(12分)(1)增大接触面积,加快反应速率(2分)
(2)阴极(2分) Sb2S3 + 12Cl--6e- == 3S + 2SbCl63-或Sb2S3-6e- == 3S + 2Sb3+ (2分)
(3)提高氯离子浓度,使Sb3+ + 6Cl- SbCl63-正向移动 (2分)
(4)SO2+2H2O-2e-===SO+4H+ (2分)1.5(2分)
解析:(1)锑铅矿在反应前要进行充分粉粹的目的是加快反应速率;(2)阴极得电子,元素化合价降低,故金属锑是阴极产物。Sb2S3在阳极区因硫元素被氧化而溶解,失电子发生氧化反应生成S和SbCl63-或S和Sb3+(3)锑铅矿(主要成分为Sb2S3、PbS、FeS)加入氯化铵和盐酸与矿浆电解槽中电解,溶液中存在平衡Sb3++6Cl‾⇌SbCl63‾,加入NH4Cl可以提高电解时SbCl3在阳极区的溶解度是因为提高氯离子浓度,使Sb3++6Cl-⇌SbCl63-正向移动;(4)由图可知Pt(1)电极上二氧化硫被氧化为硫酸,所以该电极是负极,电极的反应式为SO2-2e-+2H2O===SO+4H+;碱性条件下,用Pt(2)电极排出的S2O溶液吸收NO2,使其转化为N2,同时有SO生成。二氧化氮转化为氮气,N元素的化合价由+4降为0价,得4个电子,根据得失电子守恒,若阳极转移电子6 mol,则理论上处理NO2气体6/4 mol=1.5 mol。