- 435.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
题型层级练 7 电化学原理应用——化学电源与电解技术
授课提示:对应学生用书 133 页
(A 级)
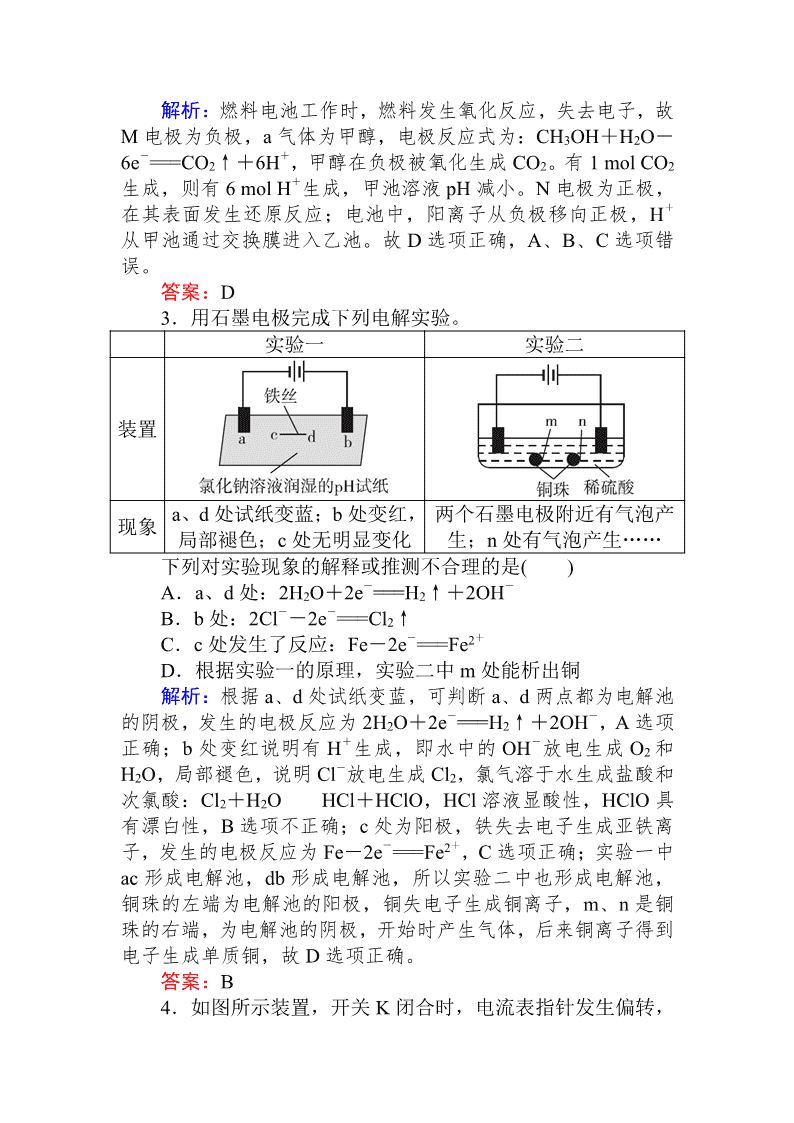
1.根据光合作用原理,设计如图原电池装置。下列说法正
确的是( )
A.a 电极为原电池的正极
B.外电路电流方向是 a→b
C.b 电极的电极反应式为:O2+2e-+2H+===H2O2
D.a 电极上每生成 1 mol O2,通过质子交换膜的 H+为 2 mol
解析:根据图示可知,a 电极上 H2O 转化为 H+和 O2,发生
氧化反应,则 a 电极为原电池的负极,A 项错误;a 电极为负极,
b 电极为正极,外电路电流方向应从正极到负极,即 b→a,B 项
错误;根据图示可知,b 电极上 O2 得电子转化为 H2O2,电极反
应式为:O2+2e-+2H+===H2O2,C 项正确;a 电极上每生成 1 mol
O2,转移 4 mol 电子,则通过质子交换膜的 H+为 4 mol,D 项错
误。
答案:C
2.甲醇燃料电池是目前应用比较广泛的一种燃料电池,其
工作原理如下图所示:
下列说法正确的是( )
A.N 为正极,发生氧化反应
B.a 气体为氧气,b 气体为甲醇
C.甲池溶液 pH 增大,乙池溶液 pH 减小
D.若有 1 mol CO2 生成,则有 6 mol H+从甲池透过交换膜
进入乙池
解析:燃料电池工作时,燃料发生氧化反应,失去电子,故
M 电极为负极,a 气体为甲醇,电极反应式为:CH3OH+H2O-
6e-===CO2↑+6H+,甲醇在负极被氧化生成 CO2。有 1 mol CO2
生成,则有 6 mol H+生成,甲池溶液 pH 减小。N 电极为正极,
在其表面发生还原反应;电池中,阳离子从负极移向正极,H+
从甲池通过交换膜进入乙池。故 D 选项正确,A、B、C 选项错
误。
答案:D
3.用石墨电极完成下列电解实验。
实验一 实验二
装置
现象 a、d 处试纸变蓝;b 处变红,
局部褪色;c 处无明显变化
两个石墨电极附近有气泡产
生;n 处有气泡产生……
下列对实验现象的解释或推测不合理的是( )
A.a、d 处:2H2O+2e-===H2↑+2OH-
B.b 处:2Cl--2e-===Cl2↑
C.c 处发生了反应:Fe-2e-===Fe2+
D.根据实验一的原理,实验二中 m 处能析出铜
解析:根据 a、d 处试纸变蓝,可判断 a、d 两点都为电解池
的阴极,发生的电极反应为 2H2O+2e-===H2↑+2OH-,A 选项
正确;b 处变红说明有 H+生成,即水中的 OH-放电生成 O2 和
H2O,局部褪色,说明 Cl-放电生成 Cl2,氯气溶于水生成盐酸和
次氯酸:Cl2+H2O HCl+HClO,HCl 溶液显酸性,HClO 具
有漂白性,B 选项不正确;c 处为阳极,铁失去电子生成亚铁离
子,发生的电极反应为 Fe-2e-===Fe2+,C 选项正确;实验一中
ac 形成电解池,db 形成电解池,所以实验二中也形成电解池,
铜珠的左端为电解池的阳极,铜失电子生成铜离子,m、n 是铜
珠的右端,为电解池的阴极,开始时产生气体,后来铜离子得到
电子生成单质铜,故 D 选项正确。
答案:B
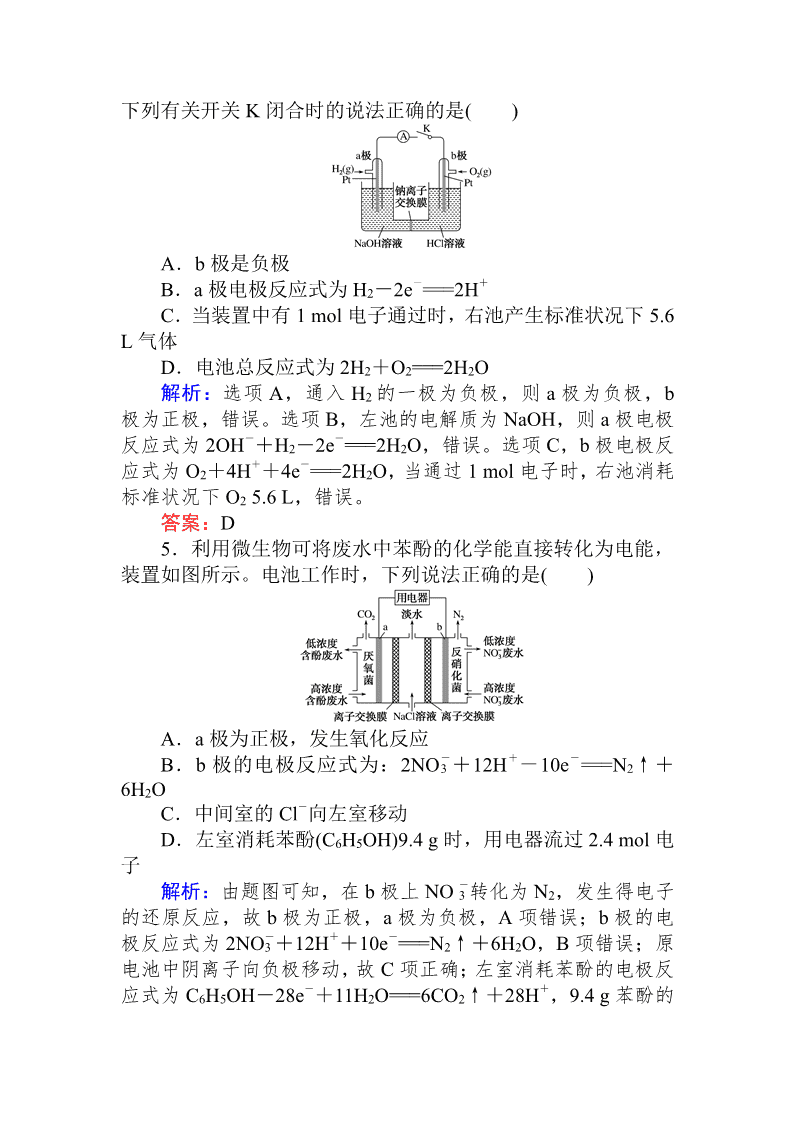
4.如图所示装置,开关 K 闭合时,电流表指针发生偏转,
下列有关开关 K 闭合时的说法正确的是( )
A.b 极是负极
B.a 极电极反应式为 H2-2e-===2H+
C.当装置中有 1 mol 电子通过时,右池产生标准状况下 5.6
L 气体
D.电池总反应式为 2H2+O2===2H2O
解析:选项 A,通入 H2 的一极为负极,则 a 极为负极,b
极为正极,错误。选项 B,左池的电解质为 NaOH,则 a 极电极
反应式为 2OH-+H2-2e-===2H2O,错误。选项 C,b 极电极反
应式为 O2+4H++4e-===2H2O,当通过 1 mol 电子时,右池消耗
标准状况下 O2 5.6 L,错误。
答案:D
5.利用微生物可将废水中苯酚的化学能直接转化为电能,
装置如图所示。电池工作时,下列说法正确的是( )
A.a 极为正极,发生氧化反应
B.b 极的电极反应式为:2NO-
3 +12H+-10e-===N2↑+
6H2O
C.中间室的 Cl-向左室移动
D.左室消耗苯酚(C6H5OH)9.4 g 时,用电器流过 2.4 mol 电
子
解析:由题图可知,在 b 极上 NO -
3 转化为 N2,发生得电子
的还原反应,故 b 极为正极,a 极为负极,A 项错误;b 极的电
极反应式为 2NO-
3 +12H++10e-===N2↑+6H2O,B 项错误;原
电池中阴离子向负极移动,故 C 项正确;左室消耗苯酚的电极反
应式为 C6H5OH-28e-+11H2O===6CO2↑+28H+,9.4 g 苯酚的
物质的量为 0.1 mol,故用电器应流过 2.8 mol 电子,D 项错误。
答案:C
6.工业上联合生产硫酸和烧碱溶液的装置如图所示,其中
阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的
体积比约为 1:2,下列有关说法正确的是( )
A.a 电极的电极反应式为:2H++2e-===H2↑
B.产物丙为硫酸
C.离子交换膜 d 为阴离子交换膜
D.每转移 0.1 mol 电子,产生 1.12 L 的气体乙
解析:根据题图并结合题意,同温同压下,气体甲与气体乙
的体积比约为 1:2,知甲为 O2,乙为 H2,则 a 电极上 OH-放电,
产生氧气,电极反应式为:2H2O-4e-===4H++O2↑,A 项错误;
a 电极为阳极,阳极上 OH-放电,SO 2-
4 向阳极移动,因此产物
丙为硫酸,B 项正确;b 电极为阴极,阴极上 H+放电,Na+向阴
极移动,则 d 为阳离子交换膜,C 项错误;根据 b 电极的电极反
应:2H2O+2e-===H2↑+2OH-,知每转移 0.1 mol 电子,产生
标准状况下 1.12 L 气体乙(H2),D 项错误。
答案:B
7.微生物燃料电池是指在微生物的作用下将化学能转化为
电能的装置。某微生物燃料电池的工作原理如图所示,下列说法
正确的是( )
A.HS-在硫氧化菌作用下转化为 SO 2-
4 的反应为 HS-+4H2O
-8e-===SO2-
4 +9H+
B.电子从电极 b 流出,经外电路流向电极 a
C.如果将反应物直接燃烧,能量的利用率不会变化
D.若该电池电路中有 0.4 mol 电子发生转移,则有 0.5 mol H
+通过质子交换膜
解析:根据题图知,在硫氧化菌作用下 HS-转化为 SO2-
4 ,
发生氧化反应:HS-+4H2O-8e-===SO2-
4 +9H+,A 项正确;电
子从电极 a 流出,经外电路流向电极 b,B 项错误;如果将反应
物直接燃烧,有部分化学能转化为热能和光能,能量的利用率降
低,C 项错误;若该电池电路中有 0.4 mol 电子发生转移,则有
0.4 mol H+通过质子交换膜,D 项错误。
答案:A
8.法国格勒诺布尔(Grenoble)约瑟夫·傅立叶大学的研究小
组发明了第一块可植入人体为人造器官提供电能的葡萄糖生物
燃料电池,其基本原理是葡萄糖和氧气在人体中酶的作用下发生
反应:C6H12O6+6O2=====酶 6CO2+6H2O(酸性环境)。下列有关该
电池的说法不正确的是( )
A.该生物燃料电池不可以在高温下工作
B.电池的负极反应为 C6H12O6+6H2O-24e-===6CO2↑+
24H+
C.消耗 1 mol 氧气时转移 4 mol e-,H+向负极移动
D.今后的研究方向是设法提高葡萄糖生物燃料电池的效
率,从而使其在将来可以为任何可植入医疗设备提供电能
解析:酶在高温下会变性,失去催化活性,所以该生物燃料
电池不可以在高温下工作,A 项正确;电池中 C6H12O6 在负极发
生氧化反应,负极反应为 C6H12O6+6H2O-24e-===6CO2↑+
24H+,B 项正确;原电池反应中,阳离子向正极移动,C 项错误;
提高葡萄糖生物燃料电池的效率肯定是今后的研究方向,D 项正
确。
答案:C
(B 级)
9.我国科学家设计出的一种装置(如图所示),实现了“太阳
能→电能→化学能”的转化,总反应为 2CO2===2CO+O2。下列
有关说法正确的是( )
A.该装置属于原电池
B.人体呼出的水蒸气参与 Y 极反应:
CO2+H2O+2e-===CO+2OH-
C.反应完毕,该太阳能装置中的电解质溶液碱性增强
D.X 极电极反应式为 O2+2H2O+4e-===4OH-
解析:该装置实现了太阳能→电能→化学能的转化,而将电
能转化为化学能属于电解池,A 项错误;由图可知 Y 极发生的
是得电子的反应,人体呼出的气体中含有 CO2 和 H2O,B 项正确;
由得失电子守恒原理知,X 极消耗的 OH-总量等于 Y 极生成的
OH-总量,即电解质溶液的碱性没有改变,C 项错误;从电子的
流向看,X 电极失去电子,故 X 电极是负极,电极反应式为 4OH
--4e-===2H2O+O2↑,D 项错误。
答案:B
10.我国对“可呼吸”的钠二氧化碳电池的研究取得突破
性进展。该电池的总反应式为:4Na+3CO2
放电充电 2Na2CO3+
C,其工作原理如图所示(放电时产生的 Na2CO3 固体储存于碳纳
米管中)。下列说法不正确的是( )
A.放电时,钠金属片作负极,碳纳米管作正极
B.充电时,阳极反应为:2Na2CO3+C-4e-===3CO2↑+
4Na+
C.放电时,Na+从负极区向正极区移动
D.该电池的电解质溶液也可使用 NaClO4 的水溶液
解析:A.放电时为原电池反应,钠金属片失去电子作负极,
碳纳米管上得电子作正极,故 A 正确;B.充电时,阳极失去电子
发生氧化反应,反应为 C+2Na2CO3-4e-===3CO2↑+4Na+,故
B 正确;C.放电时,阳离子向正极移动,则 Na+从负极区向正极
区移动,故 C 正确;D.钠与水反应,不能用水溶液代替 TEGDME
作溶剂,故 D 错误。
答案:D
11.正、负极都是碳材料的双碳性电池,电池充、放电过程
为 2nC+LiA 充电放电 CnA+LiCn,充电时 Li+、A-分别吸附在两
极上形成 LiCn 和 CnA(如图所示),下列说法正确的是( )
A.a 是电池的负极
B.放电时,A-向 b 极移动
C.放电时,负极的电极反应式是 nC-e-+A-===CnA
D.充电时,电解质中的离子总数保持不变
解析:充电时 A-吸附在 a 极形成 CnA,则 a 极为阳极,发
生氧化反应,而放电时 a 极发生还原反应,故 a 为电池的正极,
A 项错误;放电时 a 为正极,b 为负极,而放电时阴离子向负极
移动,B 项正确;放电时负极上发生氧化反应:LiCn-e-===nC
+Li+,C 项错误;充电时 Li+、A-分别吸附在两极上形成 LiCn
和 CnA,故电解质中的离子总数逐渐减小,D 项错误。
答案:B
12.已知某种微生物燃料电池的工作原理如图所示。下列说
法正确的是( )
A.电流的流动方向:B 极 ――→外电路A 极
B.溶液中的 H+由 B 极区移向 A 极区
C.在高温下,该微生物燃料电池的工作效率更高
D.A 极的电极反应式为 CH3COOH-8e-+8OH-===2CO2
+6H2O
解析:结合工作原理图示,该电池实质是酸性条件下的
CH3COOH 作燃料的燃料电池。A 极为负极,B 极为正极,电流
的流动方向:B→A,H+(阳离子)移向正极区,A 正确、B 错误。
C.该电池为微生物燃料电池,在高温条件下微生物不能存活,C
错误;D.该电池为酸性环境,在电极反应中不可能出现 OH-,D
错 误 , 配 平 A 极 电 极 反 应 式 应 为 CH3COOH - 8e - +
2H2O===2CO2↑+8H+。
答案:A
13.微生物电池是指在微生物的作用下将化学能转化为电能
的装置,其工作原理如图所示。下列有关微生物电池的说法错误
的是( )
A.正极反应中有 CO2 生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为 C6H12O6+6O2===6CO2+6H2O
解析:由电池结构图可知,在正极上氧气得到电子发生还原
反应,与移向正极的 H+反应生成水,A 错误;微生物在反应中
促进葡萄糖的氧化,即促进了电子的转移,B 正确;利用原电池
工作原理知,质子可通过质子交换膜由负极区移向正极区,C 正
确;该电池的总反应为葡萄糖发生氧化反应生成二氧化碳和水,
D 正确。
答案:A
14.锂空气电池是一种新型的二次电池,其放电时的工作原
理如图所示。下列说法正确的是( )
A.该电池放电时,正极的反应式为 O2+4e-+4H+===2H2O
B.该电池充电时,阴极发生了氧化反应:Li++e-===Li
C.电池中的有机电解液可以用稀盐酸代替
D.正极区产生的 LiOH 可回收利用
解析:正极的反应式为 O2+4e-+2H2O===4OH-,A 项错误;
电池充电时,阴极发生还原反应,B 项错误;有机电解液不能用
稀盐酸代替,因为金属锂与稀盐酸能发生反应,C 项错误。
答案:D
15.H3BO3 可以通过电解 NaB(OH)4 溶液的方法制备,其工
作原理如图,下列叙述错误的是( )
A.M 室发生的电极反应式为 2H2O-4e-===O2↑+4H+
B.N 室中:a%