- 727.00 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
考前仿真模拟(五)
时间:50分钟 满分:100分
可能用到的相对原子质量 H:1 B:11 N:14 O:16 Na:23 Ca:40
第Ⅰ卷(选择题,共42分)
一、选择题(本题包括7个小题,每小题6分,共42分。每小题仅有一个选项符合题意)
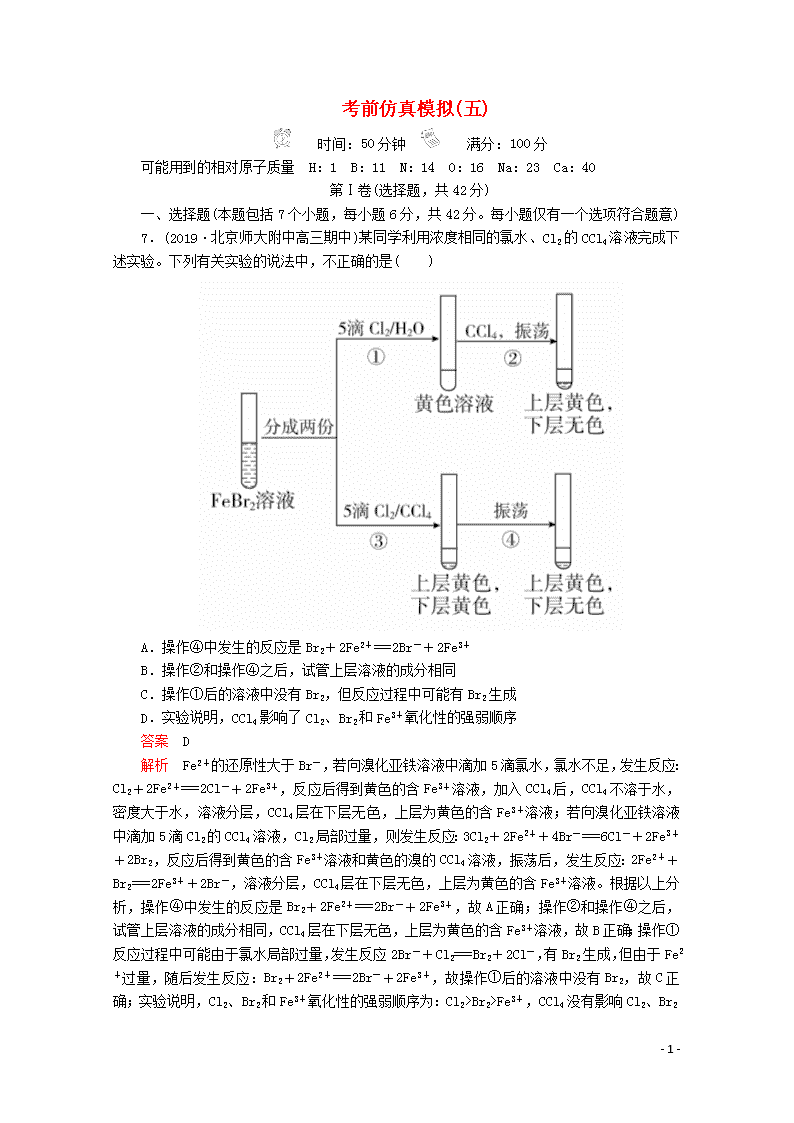
7.(2019·北京师大附中高三期中)某同学利用浓度相同的氯水、Cl2的CCl4溶液完成下述实验。下列有关实验的说法中,不正确的是( )
A.操作④中发生的反应是Br2+2Fe2+===2Br-+2Fe3+
B.操作②和操作④之后,试管上层溶液的成分相同
C.操作①后的溶液中没有Br2,但反应过程中可能有Br2生成
D.实验说明,CCl4影响了Cl2、Br2和Fe3+氧化性的强弱顺序
答案 D
解析 Fe2+的还原性大于Br-,若向溴化亚铁溶液中滴加5滴氯水,氯水不足,发生反应:Cl2+2Fe2+===2Cl-+2Fe3+,反应后得到黄色的含Fe3+溶液,加入CCl4后,CCl4不溶于水,密度大于水,溶液分层,CCl4层在下层无色,上层为黄色的含Fe3+溶液;若向溴化亚铁溶液中滴加5滴Cl2的CCl4溶液,Cl2局部过量,则发生反应:3Cl2+2Fe2++4Br-===6Cl-+2Fe3++2Br2,反应后得到黄色的含Fe3+溶液和黄色的溴的CCl4溶液,振荡后,发生反应:2Fe2++Br2===2Fe3++2Br-,溶液分层,CCl4层在下层无色,上层为黄色的含Fe3+溶液。根据以上分析,操作④中发生的反应是Br2+2Fe2+===2Br-+2Fe3+,故A正确;操作②和操作④之后,试管上层溶液的成分相同,CCl4层在下层无色,上层为黄色的含Fe3+溶液,故B正确;操作①反应过程中可能由于氯水局部过量,发生反应2Br-+Cl2===Br2+2Cl-,有Br2生成,但由于Fe2+过量,随后发生反应:Br2+2Fe2+===2Br-+2Fe3+,故操作①后的溶液中没有Br2,故C正确;实验说明,Cl2、Br2和Fe3+氧化性的强弱顺序为:Cl2>Br2>Fe3+,CCl4没有影响Cl2、Br2
- 13 -
和Fe3+氧化性的强弱顺序,故D错误。
8.下列有关表述正确的是( )
A.同位素的性质完全相同
B.H2O分子比较稳定,是因为水分子间的作用力比较大
C.在船身上装锌块来避免船体遭受腐蚀,是牺牲阳极的阴极保护法
D.配制1 L 1 mol/L NaCl溶液,可用托盘天平称取5.85 g的NaCl固体
答案 C
解析 同位素的核外电子排布相同,它们的化学性质几乎完全相同,但物理性质不一定相同,A错误;H2O分子比较稳定,是因为分子内的化学键较为稳定,与分子间作用力无关,B错误;锌、铁和海水构成原电池,锌作负极,铁作正极被保护,该保护方法为牺牲阳极的阴极保护法,C正确;托盘天平只能精确到0.1 g,不能称取5.85 g的NaCl固体,D错误。
9.(2019·北京东城高三期末)BHT是一种常用的食品抗氧化剂,由对甲基苯酚()合成BHT的常用方法有2种(如图),下列说法不正确的是( )
A.BHT能使酸性KMnO4溶液褪色
B.BHT与对甲基苯酚互为同系物
C.BHT中加入浓溴水易发生取代反应
D.方法一的原子利用率高于方法二
答案 C
解析 BHT结构中有酚羟基,可以被酸性KMnO4溶液氧化,其结构中有一个甲基直接与苯环相连,也能被酸性KMnO4溶液直接氧化,A正确;对甲基苯酚和BHT相比,都含有1个酚羟基,BHT多了8个“CH2”原子团,符合同系物的定义——结构相似,组成上相差若干个CH2,B正确;BHT中酚羟基的邻对位已无H原子,所以不能与浓溴水发生取代反应,C错误;方法一为加成反应,原子利用率理论高达100%,而方法二为取代反应,产物中还有水,原子利用率相对较低,D正确。
10.设NA为阿伏加德罗常数的数值,下列有关叙述正确的是( )
A.将78 g Na2O2与过量CO2反应转移的电子数为2NA
B.0.1 mol FeCl3完全水解转化为氢氧化铁胶体,生成0.1NA个胶粒
C.标准状况下,2.24 L CCl4中所含原子数为0.5NA
D.标准状况下,18 g D2O中所含电子数为9NA
- 13 -
答案 D
解析 78 g (1 mol) Na2O2和过量CO2反应时,转移1 mol电子,A错误;1个氢氧化铁胶粒是多个氢氧化铁分子的聚集体,故0.1 mol FeCl3完全水解转化为氢氧化铁胶体,生成的胶粒数小于0.1NA,B错误;标准状况下,CCl4为液体,故不能使用标准状况下的气体摩尔体积来计算其物质的量,C错误;18 g (0.9 mol) D2O中含9NA个电子,D正确。
11.短周期元素a、b、c、d的原子序数依次增大,a和c位于同主族。X、Y两种化合物均含这四种元素,常温下,0.1 mol·L-1 Y溶液的pH=1。在X溶液中滴加Y溶液,产生气体的物质的量与加入的Y溶液中Y的物质的量的关系如图所示(假设溶液中气体全部逸出)。下列说法正确的是( )
A.简单离子半径:d>c>b
B.气态氢化物的热稳定性:d>b
C.c2d2中含两种化学键
D.常温下,0.1 mol·L-1Y溶液中由水电离的c(H+)=0.1 mol·L-1
答案 C
解析 依题意及题图知,Y是硫酸氢钠,X为亚硫酸氢钠,二者发生的反应为NaHSO3+NaHSO4===Na2SO4+SO2↑+H2O,则a为氢,b为氧,c为钠,d为硫。简单离子半径:r(S2-)>r(O2-)>r(Na+),A错误;H2O的热稳定性比H2S强,B错误;Na2S2中含有离子键、非极性共价键,C正确;常温下,0.1 mol·L-1 NaHSO4溶液的pH=1,溶液中c(H+)=0.1 mol·L-1,c水(OH-)=c溶液(OH-)=1.0×10-13 mol·L-1,则c水(H+)=c水(OH-)=1.0×10-13 mol·L-1,D错误。
12.(2019·石景山区高三期末)在一定条件下,甲苯可生成二甲苯的混合物和苯。有关物质的沸点、熔点如下:
对二甲苯
邻二甲苯
间二甲苯
苯
沸点/℃
138
144
139
80
熔点/℃
13
-25
-47
6
下列说法不正确的是( )
A.苯、甲苯、对二甲苯属于同系物
B.推测甲苯的沸点高于80 ℃而低于138 ℃
C.甲苯生成二甲苯和苯的反应属于取代反应
D.用蒸馏的方法能从二甲苯混合物中分离出对二甲苯
答案 D
- 13 -
解析 苯、甲苯、对二甲苯属于苯及其同系物,故A正确;苯及其同系物随着相对分子质量增大,熔沸点依次增大,甲苯的相对分子质量比二甲苯小、比苯大,故沸点比对二甲苯低、比苯高,故B正确;甲苯变成二甲苯是苯环上的氢原子被甲基取代所得,属于取代反应,故C正确;对二甲苯与邻二甲苯和间二甲苯沸点不同,但相差不大,不能用蒸馏的方法从二甲苯混合物中分离出对二甲苯,故D错误。
13.如图为“甲醇燃料电池”的工作原理示意图,下列有关说法正确的是( )
A.该燃料电池工作过程中电流方向从a极流向b极
B.该燃料电池工作时电路中通过1 mol电子,消耗的O2的体积为5.6 L
C.Pt(a)电极的反应式为CH3OH-6e-+H2O===CO2↑+6H+
D.该燃料电池工作时H+由b极室向a极室移动,电解质溶液的pH增大
答案 C
解析 b电极通入氧气,b电极是正极,a电极是负极,该燃料电池工作过程中电流方向从b极流向a极,A错误;1 mol氧气得到4 mol电子,该燃料电池工作时电路中通过1 mol电子,消耗的O2的物质的量是0.25 mol,其体积在标准状况下为5.6 L,题中没注明标准状况,B错误;a电极为负极,甲醇在负极失去电子,发生氧化反应,由于电解质溶液显酸性,则负极的反应式为CH3OH-6e-+H2O===CO2↑+6H+,C正确;原电池中阳离子向正极移动,该燃料电池工作时H+由a极室向b极室移动,D错误。
第Ⅱ卷(非选择题,共58分)
二、必考题(本题包括3个小题,共43分)
26.(2019·成都七中高三期末)(15分)甲烷在加热条件下可还原氧化铜。某化学小组利用如图装置探究其反应产物。
- 13 -
[查阅资料] ①CO能与银氨溶液反应:
CO+2[Ag(NH3)2]++2OH-===2Ag↓+2NH+CO+2NH3
②Cu2O为红色,能发生反应:Cu2O+2H+===Cu2++Cu+H2O
(1)仪器a的名称是________,装置A中反应的化学方程式为_____________。
(2)按气流方向各装置从左到右的连接顺序为A→________(填字母编号,每个装置限用一次)。
(3)已知气体产物中含有CO,则装置C中可观察到的现象是__________;装置F的作用为______________________。
(4)当反应结束后,装置D处试管中固体全部变为红色。
①设计简单实验证明红色固体中含有Cu2O:_______________。
②若红色固体为单质,且产物中含碳氧化物的物质的量之比为1∶1,则D处发生的反应化学方程式是______________________。
答案 (1)圆底烧瓶 Al4C3+12HCl===3CH4↑+4AlCl3
(2)F→D→B→E→C→G
(3)试管内有黑色固体生成 除去CH4中杂质气体HCl和H2O
(4)①取少量红色固体,加入适量稀硫酸,若溶液变蓝色,说明原固体中含Cu2O ②2CH4+7CuO7Cu+CO+CO2+4H2O
解析 (2)装置A中反应是稀盐酸和Al4C3反应生成AlCl3和CH4,CH4在加热条件下可还原CuO,气体产物除水蒸气外,还有碳的氧化物,生成的CH4气体通过装置F吸收气体HCl并干燥,通过装置D加热还原氧化铜,通过装置B检验生成的水蒸气,通过装置E检验吸收生成产物CO2,通过装置C中银氨溶液验证CO,CO能与银氨溶液反应:CO+2[Ag(NH3)2]++2OH-
- 13 -
===2Ag↓+2NH+CO+2NH3,最后用排水法吸收和收集气体,按气流方向各装置从左到右的连接顺序为A→F→D→B→E→C→G。
(3)气体含有CO,C中银氨溶液被CO还原生成Ag单质,会看到试管内有黑色固体生成,F是除去甲烷中杂质气体HCl和H2O。
(4)当反应结束后,装置D处试管中固体全部变为红色。
①可利用Cu2O与酸发生反应:Cu2O+2H+===Cu2++Cu+H2O,反应产生的Cu2+的水溶液显蓝色检验。
27.(14分)过氧化钙晶体(CaO2·8H2O)是白色固体,微溶于水。过氧化钙可用作种子消毒剂、高温氧化剂、鱼池增氧剂等。实验室模仿工业上制备过氧化钙的主要流程如下:
回答下列问题:
(1)写出“沉淀”过程中生成CaO2·8H2O的化学方程式_______________。
(2)从“滤液”中可以提取某物质,主要步骤包括蒸发浓缩、____________、_____________、洗涤、干燥等。“水洗”的操作方法是____________________。
(3)乙醇洗的目的是______________________。
(4)设计如下三种方案测定产品纯度:
①量气法。已知CaO2在350 ℃迅速分解生成CaO和O2。下图是实验室测定产品中CaO2含量的装置(夹持装置省略)。
若所取产品质量是m g,测得气体体积为V mL(已换算成标准状况),则产品中CaO2的质量分数为________________________(用字母表示)。
②滴定法。准确称取a g产品于带有塞子的锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1 H2SO4溶液,充分反应;向上述锥形瓶中加入几滴淀粉溶液;逐滴加入浓度为c mol·L-1的Na2S2O3溶液至完全反应,消耗溶液V mL。(有关反应为:CaO2+2KI+2H2SO4===CaSO4+I2+2H2O+K2SO4,2Na2S2O3+I2===2NaI+Na2S4O6)
该产品中CaO2的质量分数为________________________;若滴定过程中锥形瓶振荡过于激烈,导致少量溶液溅出,则测得的质量分数________(填“偏大”“偏小”或“无影响”)。
③重量法。采用重量法测定产品纯度,需要测定的物理量有______________。
- 13 -
答案 (1)CaCl2+2NH3+H2O2+8H2O===CaO2·8H2O↓+2NH4Cl
(2)冷却结晶 过滤 向过滤器中引入蒸馏水至没过固体,待水自然流下,重复2~3次
(3)去除晶体表面水分
(4)①×100% ②×100%
偏小 ③产品质量、完全分解后剩余固体的质量
解析 (3)晶体用蒸馏水洗涤后吸附有H2O,晶体不溶于乙醇,而H2O溶于乙醇,所以乙醇洗可以除去晶体表面的水分。
(4)①根据2CaO22CaO+O2↑,n(O2)= mol,则m(CaO2)= mol×2×72 g·mol-1= g,故w(CaO2)=×100%。②存在CaO2~I2~2Na2S2O3,则n(CaO2)=× mol,故w(CaO2)=×100%=×100%。少量溶液溅出,则滴定消耗的Na2S2O3溶液的体积减小,从而使测定结果偏小。
28.(14分)CO2是一种常用的化工原料。
Ⅰ.以CO2与NH3为原料可以合成尿素[CO(NH2)2]。合成尿素的反应为2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)。
(1)在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率变化情况如图所示。该反应的ΔH________0(填“>”“<”或“=”,下同),若y表示压强,则y1________y2,若y表示反应开始时的水碳比,则y1________y2。
(2)t ℃时,若向容积为2 L的密闭容器中加入3 mol NH3和1 mol CO2,达到平衡时,容器内压强为开始时的0.75倍。若保持条件不变,再向该容器中加入0.5 mol CO2和1 mol H2O,NH3的转化率将______(填“增大”“减小”或“不变”)。
Ⅱ.CO2与H2反应可用于生产甲醇。
(3)已知氢气与甲醇的燃烧热分别为-285.8 kJ·mol-1、-726.5 kJ·mol-1,则CO2与H2反应产生液态甲醇与液态水的热化学方程式为_______________。
(4)下图是某甲醇燃料电池工作的示意图。
- 13 -
质子交换膜(只有质子能够通过)左、右两侧的溶液均为1 L 2 mol·L-1 H2SO4溶液。电极a上发生的电极反应式为____________________________,当电池中有1 mol e-发生转移时左、右两侧溶液的质量之差为________g(假设反应物耗尽,忽略气体的溶解)。
答案 (1)< > <
(2)减小
(3)CO2(g)+3H2(g)===CH3OH(l)+H2O(l)
ΔH=-130.9 kJ·mol-1
(4)CH3OH-6e-+H2O===CO2+6H+ 12
解析 (1)根据图示可知,随着温度的升高,氨气的转化率逐渐降低,说明升温平衡左移,正反应为放热反应,ΔH<0;该反应为气体体积减小的反应,则加压平衡会右移,氨气的转化率增大,若y表示压强,根据图示可知,y1时氨气的转化率较高,则y1>y2;反应开始时的水碳比越大,氨气的转化率越小,若y表示反应开始时的水碳比,根据图示可知,y1时氨气的转化率较高,则y1<y2。
(2)t ℃时,设CO2的变化浓度为x,则根据“三段式”有:
2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)
1.5 0.5 0
2x x x
1.5-2x 0.5-x x
同温同体积条件下,气体的压强之比等于物质的量之比,则=0.75,解得x=0.25 mol·L-1,则平衡时c(NH3)=1 mol·L-1,c(CO2)=0.25 mol·L-1,K===1,再向该容器中加入0.5 mol CO2和1 mol H2O,此时c(CO2)=0.25 mol·L-1+=0.5 mol·L-1,c(H2O)=0.25 mol·L-1+=0.75 mol·L-1,Qc==1.5>K=1,平衡左移,NH3的转化率将减小。
(3)根据氢气与甲醇的燃烧热分别为-285.8 kJ·mol-1、-726.5 kJ·mol-1,可以写出热化学方程式:
- 13 -
①H2(g)+O2(g)===H2O(l)ΔH1=-285.8 kJ·mol-1,
②CH3OH(l)+O2(g)===CO2(g)+2H2O(l)ΔH2=-726.5 kJ·mol-1,
根据盖斯定律,①×3-②得:CO2(g)+3H2(g)===CH3OH(l)+H2O(l) ΔH=3ΔH1-ΔH2=-285.8 kJ·mol-1×3+726.5 kJ·mol-1=-130.9 kJ·mol-1。
(4)根据图示分析,通入甲醇的a电极为原电池的负极,通入O2的b电极为原电池的正极,a电极上发生的电极反应式为:CH3OH-6e-+H2O===CO2↑+6H+,根据原电池原理,阳离子移向正极,故每转移1 mol e-时,有1 mol H+由左侧溶液进入右侧溶液,则电子转移的量与左侧溶液质量减少量的关系式可以看成6e-~H2O,转移1 mol e-时,左侧溶液质量减少 g=3 g;b电极上发生的电极反应式为:O2+4H++4e-===2H2O,则电子转移的量与右侧溶液质量增加量的关系式可以看成4e-~2H2O,转移1 mol e-时,右侧溶液质量增加 g=9 g,则左、右两侧溶液的质量差为3 g+9 g=12 g。
三、选考题(两个题中任选一题作答,共15分)
35.[化学——选修3:物质结构与性质](15分)
硼及其化合物应用广泛。回答下列问题:
(1)基态B原子的价电子轨道表达式为______________,其第一电离能比Be的________(填“大”或“小”)。
(2)氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,其中提供孤电子对的成键原子是________,写出一种与氨硼烷互为等电子体的分子________(填化学式)。
(3)常温常压下硼酸(H3BO3)晶体为层状结构,其二维平面结构如图所示。
①B原子的杂化方式为________。从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大:_________。
②路易斯酸碱理论认为,任何可接受电子对的分子或离子叫做路易斯酸,任何可给出电子对的分子或离子叫做路易斯碱。从结构角度分析硼酸是路易斯酸的原因:_____________________。
(4)金刚石的晶胞结构如图所示,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。
- 13 -
①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是______________。
②立方氮化硼晶体的晶胞结构与金刚石相似,晶胞边长为361.5 pm(1 pm=10-12 m)。立方氮化硼晶体的密度是________g·cm-3(只要求列出算式,不必计算出具体数值,阿伏加德罗常数的值为NA)。
答案 (1) 小
(2)N C2H6
(3)①sp2 硼酸分子间通过氢键缔合成层状“大分子”,故不易溶于水,加热时,氢键被破坏,溶解度增大
②硼酸分子中B原子有一个2p空轨道,可接受电子对
(4)①金刚石>碳化硅>晶体硅
②
解析 (1)Be原子的2s轨道上有2个电子,为全充满的稳定状态,B原子的2p轨道上只有1个电子,失去1个电子后2p轨道可形成空轨道,所以B的第一电离能比Be的小。
(2)形成配位键时一方提供空轨道,另一方提供孤电子对,在氨硼烷中,N原子提供孤电子对,B原子提供空轨道,可接受电子对。CH3CH3与NH3BH3互为等电子体。
(3)①由题图可知,硼酸中每个B原子与3个O原子形成3个σ键,B原子上无孤对电子,故B原子采取sp2杂化。H3BO3分子间形成的氢键不利于H3BO3的溶解,加热时,硼酸分子间的氢键被破坏,硼酸的溶解度增大。②硼酸分子中,B原子有一个空的2p轨道,根据路易斯酸碱理论知,硼酸可以接受电子对,故硼酸为路易斯酸。
(4)①金刚石、晶体硅、碳化硅晶体都属于原子晶体,熔点的高低取决于共价键的强弱,由于原子半径:C< Si,即键长的大小顺序为金刚石<碳化硅<晶体硅,键长越长,共价键越弱,物质的熔点越低。②立方氮化硼晶体的晶胞结构与金刚石相似,分析晶胞结构可知,立方氮化硼晶胞中含有4个B原子,4个N原子,晶胞的体积为(361.5×10-10)3 cm3,立方氮化硼晶体的密度ρ= g·cm-3。
36.(2019·北京朝阳高三期末)[化学——选修5:有机化学基础](15分)
我国科学家在合成、生产生物医用材料——新型增塑剂(DEHCH)方面获得重要进展,该增塑剂可由有机物D和L制备,其结构简式如下:
- 13 -
(1)有机物D的一种合成路线如下:
C2H4C2H2CH3CHO
①由C2H4生成A的化学方程式是____________________。
②试剂a是________________。
③写出B中所含官能团的名称为________________。
④有机物D的结构简式是________________。
(2)增塑剂(DEHCH)的合成路线如下:
①D→M的化学方程式是_________________。
②有机物L的分子式为C4H2O3,核磁共振氢谱显示只有一种化学环境的氢原子。W的结构简式是______________。
③以Y和Q为原料合成DEHCH分为两步反应,写出有关化合物的结构简式:
+―→
- 13 -
中间产物的结构简式是________,反应a的反应类型是________。
答案 (1)①CH2===CH2+Br2―→CH2Br—CH2Br
②NaOH/CH3CH2OH ③碳碳双键、醛基
④CH3CH2CH2CH2OH
解析 (1)①乙烯与溴水发生加成反应,生成1,2-二溴乙烷;
②1,2-二溴乙烷与NaOH的乙醇溶液在加热时发生消去反应,生成乙炔CH≡CH、NaBr及水;
③CH≡CH与水在催化剂存在时,加热,发生加成反应产生乙醛CH3CHO,2分子的乙醛在稀NaOH溶液中加热发生反应,产生B:CHCH3CHCHO,所以B中所含官能团的名称为碳碳双键、醛基;
④CHCH3CHCHO与H2在Ni催化下,加热,发生加成反应产生CH3CH2CH2CH2OH。
(2)①CH3CH2CH2CH2OH在Cu催化下,加热被氧气氧化为CH3CH2CH2CHO;
- 13 -
- 13 -