- 680.72 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
山东省2020年普通高中学业水平等级考试(模拟卷)化学试题
1.答题前,考生先将自己的姓名、考生号、座号填写在相应位置,认真核对条形码上的姓名、考生号和座号,并将条形码粘贴在指定位置上。
2.选择题答案必须使用2B铅笔(按填涂样例)正确填涂;非选择题答案必须使用0.5毫米黑色签字笔书写,字体工整、笔迹清楚。
3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。保持卡面清洁,不折叠、不破损。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 C1 35.5
一、 选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1. 化学与生活密切相关,下列说法错误的是
A.乙醇汽油可以减少尾气污染
B.化妆品中添加甘油可以起到保湿作用
C.有机高分子聚合物不能用于导电材料
D.葡萄与浸泡过高锰酸钾溶液的硅藻土放在一起可以保鲜
2.某烯烃分子的结构简式为 ,用系统命名法命名其名称为
A.2,2,4-三甲基-3-乙基-3-戊烯 B. 2,4,4-三甲基-3-乙基-2-戊烯
C. 2,2,4-三甲基-3-乙基-2-戊烯 D. 2-甲基-3-叔丁基-2-戊烯
3.实验室提供的玻璃仪器有试管、导管、容量瓶、烧杯、酒精灯、表面皿、玻璃棒(非玻璃仪器任选),选用上述仪器能完成的实验是
A.粗盐的提纯 B.制备乙酸乙酯
C.用四氯化碳萃取碘水中的碘 D.配制0.1mol·L-1的盐酸溶液
4.某元素基态原子4s轨道上有1个电子,则该基态原子价电子排布不可能是
A.3p64s1 B.4s1 C.3d54s1 D.3d104s1
5.Calanolide A 是一种抗 HTV 药物,其结构简式如右图所示。下列关于 Calanolide A 的 说法错误的是
A.分子中有3个手性碳原子
B.分子中有3种含氧官能团
C.该物质既可发生消去反应又可发生加成反应
D.1 mol 该物质与足量NaOH 溶液反应时消耗 1 mol NaOH
6.X、Y、Z、W为原子序数依次增大的四种短周期主族元素,A、B、C、D、E为上述四种元素中的两种或三种所组成的化合物。已知A的相对分子质量为28,B分子中含有18个电子,五种化合物间的转化关系如右图所示。下列说法错误的是
A. X、Y组成化合物的沸点一定比X、Z组成化合物的沸点低
B. Y的最高价氧化物的水化物为弱酸
C. Y、Z组成的分子可能为非极性分子
D. W是所在周期中原子半径最小的元素
973K
Ni-Co
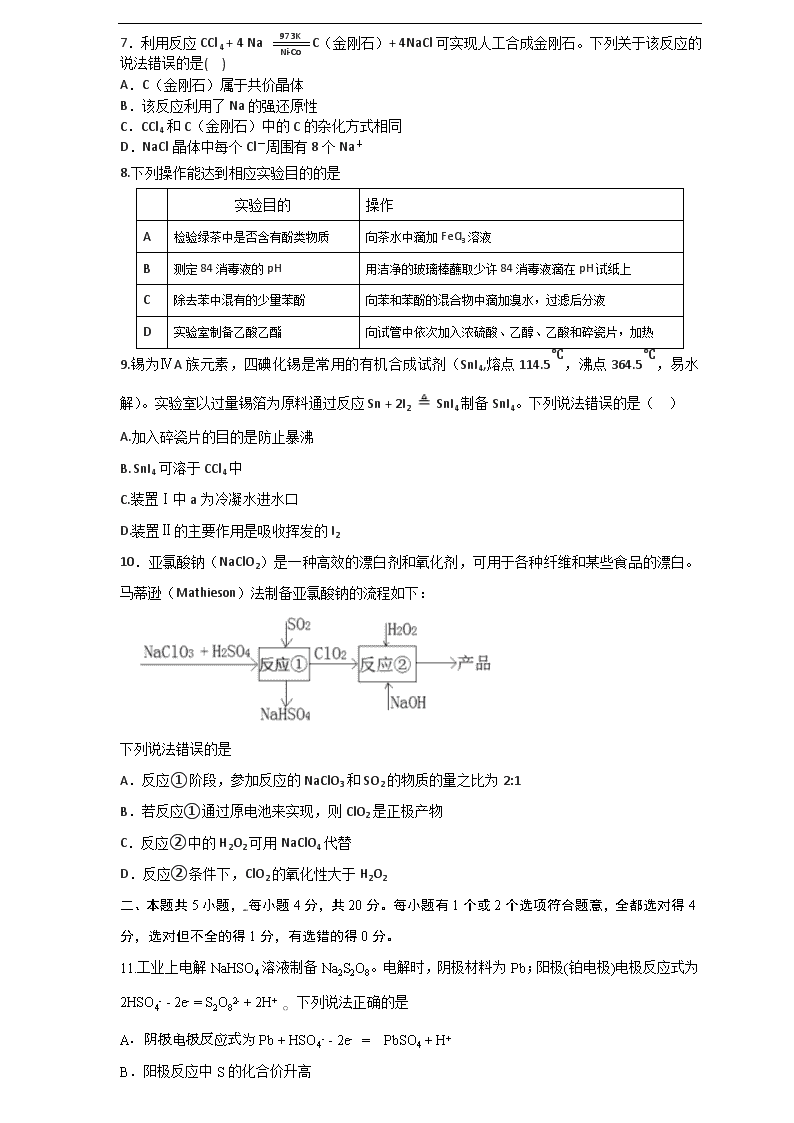
7.利用反应CCl4 + 4 Na C(金刚石)+ 4NaCl可实现人工合成金刚石。下列关于该反应的说法错误的是( )
A.C(金刚石)属于共价晶体
B.该反应利用了Na的强还原性
C.CCl4和C(金刚石)中的C的杂化方式相同
D.NaCl晶体中每个Cl-周围有8个Na+
8.下列操作能达到相应实验目的的是
实验目的
操作
A
检验绿茶中是否含有酚类物质
向茶水中滴加FeCl3溶液
B
测定84消毒液的pH
用洁净的玻璃棒蘸取少许84消毒液滴在pH试纸上
C
除去苯中混有的少量苯酚
向苯和苯酚的混合物中滴加溴水,过滤后分液
D
实验室制备乙酸乙酯
向试管中依次加入浓硫酸、乙醇、乙酸和碎瓷片,加热
9.锡为ⅣA族元素,四碘化锡是常用的有机合成试剂(SnI4,熔点114.5℃,沸点364.5℃,易水解)。实验室以过量锡箔为原料通过反应Sn + 2I2 SnI4制备SnI4。下列说法错误的是( )
A.加入碎瓷片的目的是防止暴沸
B. SnI4可溶于CCl4中
C.装置Ⅰ中a为冷凝水进水口
D.装置Ⅱ的主要作用是吸收挥发的I2
10.亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:
下列说法错误的是
A.反应①阶段,参加反应的NaClO3和SO2的物质的量之比为2:1
B.若反应①通过原电池来实现,则ClO2是正极产物
C.反应②中的H2O2可用NaClO4代替
D.反应②条件下,ClO2的氧化性大于H2O2
二、本题共5小题,优题速享每小题4分,共20分。每小题有1个或2个选项符合题意,全都选对得4分,选对但不全的得1分,有选错的得0分。
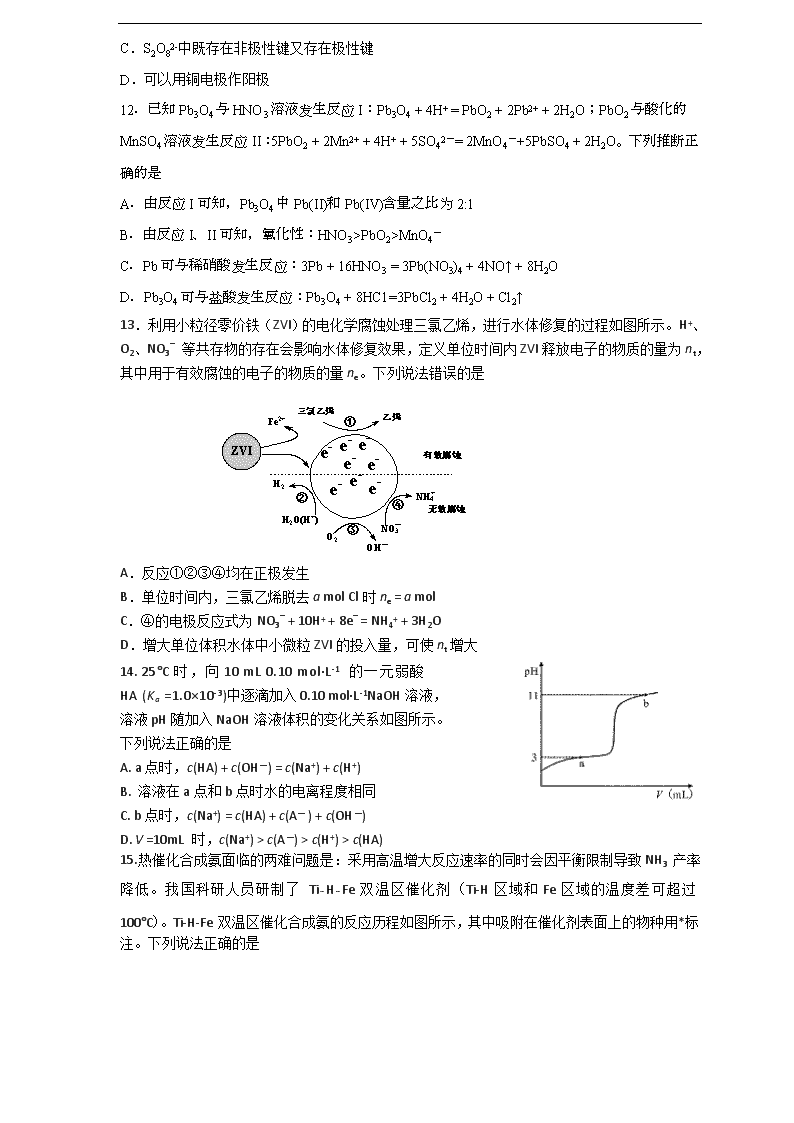
11.工业上电解NaHSO4溶液制备Na2S2O8。电解时,阴极材料为Pb;阳极(铂电极)电极反应式为2HSO4- - 2e- = S2O82- + 2H+ 。下列说法正确的是
A.阴极电极反应式为Pb + HSO4- - 2e- = PbSO4 + H+
B.阳极反应中S的化合价升高
C.S2O82-中既存在非极性键又存在极性键
D.可以用铜电极作阳极
12.已知Pb3O4与HNO3溶液发生反应I:Pb3O4 + 4H+ = PbO2 + 2Pb2+ + 2H2O;PbO2与酸化的MnSO4溶液发生反应II:5PbO2 + 2Mn2+ + 4H+ + 5SO42-= 2MnO4-+5PbSO4 + 2H2O。下列推断正确的是
A.由反应I可知,Pb3O4中Pb(II)和Pb(IV)含量之比为2:1
B.由反应I、II可知,氧化性:HNO3>PbO2>MnO4-
C.Pb可与稀硝酸发生反应:3Pb + 16HNO3 = 3Pb(NO3)4 + 4NO↑ + 8H2O
D.Pb3O4可与盐酸发生反应:Pb3O4 + 8HC1=3PbCl2 + 4H2O + Cl2↑
13.利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图所示。H+、O2、NO3_ 等共存物的存在会影响水体修复效果,定义单位时间内ZVI释放电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量ne。下列说法错误的是
A.反应①②③④均在正极发生
B.单位时间内,三氯乙烯脱去a mol Cl时ne = a mol
C.④的电极反应式为NO3_ + 10H+ + 8e_ = NH4+ + 3H2O
D.增大单位体积水体中小微粒ZVI的投入量,可使nt增大
14. 25°C时,向10 mL 0.10 mol·L-1 的一元弱酸
HA (Ka =1.0×10-3)中逐滴加入0.10 mol·L-1NaOH溶液,
溶液pH随加入NaOH溶液体积的变化关系如图所示。
下列说法正确的是
A. a点时,c(HA) + c(OH—) = c(Na+) + c(H+)
B. 溶液在a点和b点时水的电离程度相同
C. b点时,c(Na+) = c(HA) + c(A— ) + c(OH—)
D. V =10mL 时,c(Na+) > c(A—) > c(H+) > c(HA)
15.热催化合成氨面临的两难问题是:釆用高温增大反应速率的同时会因平衡限制导致NH3 产率降低。我国科研人员研制了 Ti-H-Fe双温区催化剂(Ti-H区域和Fe区域的温度差可超过100°C)。Ti-H-Fe双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法正确的是
A.①为氮氮三键的断裂过程
B.①②③在高温区发生,④⑤在低温区发生
C.④为N原子由Fe区域向Ti-H区域的传递过程
D.使用Ti-H-Fe双温区催化剂使合成氨反应转变为吸热反应
三、非选择题:本题共5小题,共60分。
16.(10分)聚乙烯醇生产过程中会产生大量副产物乙酸甲酯,其催化醇解反应可用于制备甲醇和乙酸己酯,该反应的化学方程式为:
已知v正= k正χ(CH3COOCH3)·χ(C6H13OH),v逆= k逆χ(CH3COO C6H13)·χ(CH3OH),
其中v正、v逆 为正、逆反应速率,k正、k逆为速率常数,χ为各组分的物质的量分数。
(1)反应开始时,已醇和乙酸甲酯按物质的量之比1:1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(α)随时间(t)的变化关系如下图所示。
该醇解反应的ΔH_________0(填>或<)。348K时,以物质的量分数表示的化学平衡常数Kx=____________(保留2位有效数字)。
在曲线①、②、③中,k正-k逆值最大的曲线是___________________;A、B、C、D四点中,v正最大的是_____________,v逆最大的是___________________。
(2)343K时,己醇和乙酸甲酯按物质的量之比1:1、1:2和2:1进行初始投料。则达到平衡后,初始投料比_____________时,乙酸甲酯转化率最大;与按1:2投料相比,按2:1投料时化学平衡常数Kx____________(填增大、减小或不变)。
(3)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法正确的是______。
a. 参与了醇解反应,但并不改变反应历程 b. 使k正和k逆增大相同倍数
c. 降低了醇解反应的活化能 d. 提高乙酸甲酯的平衡转化率
17.(12分)非线性光学晶体在信息、激光技术、医疗、国防等领域具有重要应用价值。我国科学家利用Cs2CO3、XO2(X=Si、Ge)和H3BO3首次合成了组成为CsXB3O7的非线性光学晶体。回答下列问题:
(1)C、O、Si三种元素电负性由大到小的顺序为 ;第一电离能I1(Si) I1(Ge)(填>或<)。
(2)基态Ge原子核外电子排布式为 ;SiO2、GeO2具有类似的晶体结构,其中熔点较高的是 ,原因是 。
(3)右图为硼酸晶体的片层结构,其中硼的杂化方式为 。H3BO3在热水中比冷水中溶解度显著增大的主要原因是 。
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。CsSiB3O7属正交晶系(长方体形)。晶胞参数为a pm、b pm、c pm。右图为沿y轴投影的晶胞中所有Cs原子的分布图和原子分数坐标。据此推断该晶胞中Cs原子的数目为 。CsSiB3O7的摩尔质量为M g·mol-1,设NA为阿伏加德罗常数的值,则CsSiB3O7晶体的密度为 g·cm-3(用代数式表示).
18.(13分)四溴化钛(TiBr4)可用作橡胶工业中烯烃聚合反应的催化剂。已知TiBr4常温下为橙黄色固体,熔点为38.3 °C,沸点为233.5°C,具有潮解性且易发生水解。实验室利用反应TiO2 + C + 2Br2 TiBr4 + CO2制备TiBr4的装置如下图所示。回答下列问题:
(1)检查装置气密性并加入药品后,加热前应进行的操作是 ,其目的是 ,此时活塞K1、K2、K3、的状态为 ; 一段时间后,打开电炉并加热反应管,此时活塞K1、K2、K3的状态为 。
(2)试剂A为 ,装置单元X的作用是 ;反应过程中需用热源间歇性微热连接管,其目的是 。
(3)反应结束后应继续通入一段时间CO2,主要目的是 。
(4)将连接管切断并熔封,采用蒸馏法提纯。此时应将a端的仪器改装为 、承接管和接收瓶,在防腐胶塞上加装的仪器是_____(填仪器名称)。
19.(11分)普通立德粉(BaSO4·ZnS)广泛用于工业生产中,可利用ZnSO4和BaS共沉淀法制备。以粗氧化锌(含Zn、CuO、FeO等杂质)和BaSO4为原料制备立德粉的流程如下:
(1)生产ZnSO4的过程中,反应器Ⅰ要保持强制通风,原因是 。
(2)加入锌粉的主要目的是 (用离子方程式表示)。
(3)已知KMnO4在酸性环境中被还原为Mn2+,在弱酸性、弱碱性溶液中被还原为MnO2,在碱性环境中被还原为MnO42-。据流程判断,加入KMnO4时溶液的pH应调至 ;
a.2.2~2.4 b.5.2~5.4 c.12.2~12.4
滤渣Ⅲ的成分为 。
(4)制备BaS时,按物质的量之比计算,BaSO4和碳粉的投料比要大于1:2,目的是 ;生产过程中会有少量氧气进入反应器Ⅳ,反应器Ⅳ中产生的尾气需用碱液吸收,原因是 。
(5)普通立德粉(BaSO4·ZnS)中ZnS含量为29.4%。高品质银印级立德粉中ZnS含量为62.5%。在ZnSO4、BaS、Na2SO4、Na2S中选取三种试剂制备银印级立德粉。所选试剂为 ,反应的化学方程式为 (已知BaSO4的相对分子质量为233。ZnS的相对分子质量为97)。
20.(14分)酯类化合物与格氏试剂(RMgX,X=Cl、Br、I)的反应是合成叔醇类化合物的重要方法,可用于制备含氧多官能团化合物。化合物F的合成路线如下,回答下列问题:
已知信息如下:
(1)A的结构简式为__________________,B→C的反应类型为_________,C中官能团的名称为________,C→D的反应方程式为__________________________。
(2)写出符合下列条件的D的同分异构体_________(填结构简式,不考虑立体异构)。
①含有五元环碳环结构;②能与NaHCO3溶液反应放出CO2气体;
③能发生银镜反应。
(3)判断化合物F中有无手性碳原子,若有用“*”标出。
(4)已知羟基能与格氏试剂发生反应。写出以和CH3OH和格氏试剂为原料制备的合成路线(其他试剂任选)。
山东省2020年普通高中学业水平等级考试(模拟卷)
化学试题参考答案
一、 选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.C 2.B 3.B 4.A 5.D 6.A 7.D 8.A 9.D 10.C
二、本题共5小题,每小题4分,共20分。每小题有1个或2个选项符合题意,全都选对得4分,选对但不全的得1分,有选错的得0分。
11.C 12.AD 13.B 14.A 15.BC
三、非选择题:本题共5小题,共60分。
16.(10分)
(1)> 3.2 ① A C
(2)2:1 不变
(3)bc
17.(12分)
(1)O>C>Si >
(2)1s22s22p63s23p63d104s24p2(或[Ar]3d104s24p2);SiO2;二者均为原子晶体,Ge原子半径大于Si,Si-O键长小于Ge-O键长,SiO2键能更大,熔点更高。
(3)sp2;热水破坏了硼酸晶体中的氢键,并且硼酸分子与水形成分子间氢键,使溶解度增大。
(4)4 ,
18. (13分)
(1)先通入过量的CO2气体 ,排除装置内空气,打开K1,关闭K2和K3;打开K2和K3 ,同时关闭K1。
(2) 浓硫酸,优题速享吸收多余的溴蒸气同时防止外界的水蒸气使产物水解;防止产品四溴化钛凝固成晶体,堵塞连接管,造成危险。
(3) 排出残留在装置中的TiBr4和溴蒸气
(4) 直形冷凝管 、温度计(量程250°C)
19.(11分)
(1)反应中产生氢气,达一定浓度后易爆炸,出现危险,需要通风。
(2)Zn+Cu2+= Zn2++Cu2+
(3)b, MnO2和Fe(OH)3
(4)避免产生CO等有毒气体;尾气中含有的SO2等有毒气体
(5)ZnSO4、BaS、Na2S;4 ZnSO4 + BaS + 3 Na2S = BaSO4·4ZnS + 3 Na2SO4
20.(14分)
(1);氧化反应;羰基和羧基;
(2)
(3)
(4)
相关文档
- 2019-2020学年河南省鹤壁市淇滨高2021-08-2419页
- 山西省长治市第二中学2019-2020学2021-08-2422页
- 山东省实验中学2020届高三下学期线2021-08-2425页
- 黑龙江省鹤岗市第一中学2019-20202021-08-248页
- 2017-2018学年浙江省东阳中学高二2021-08-246页
- 山东省威海市2020届高三模拟考试42021-08-2425页
- 云南省昆明市2019-2020学年高一下2021-08-2422页
- 浙江大学附属中学2020届高三全真模2021-08-2416页
- 2019学年高一化学下学期第一次月考2021-08-249页
- 2017-2018学年江西省新余市第四中2021-08-246页