- 1.51 MB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题四 化学实验
第13讲 化学实验基础知识
最新考纲
考向分析
1.了解化学实验是科学探究过程中的一种重要方法。
2.了解化学实验室常用仪器的主要用途和使用方法。
3.了解化学实验仪器基本操作。
4.能对常见的物质进行检验。
5.能对常见的物质进行分离和提纯。
1.客观题:仍以无机元素化合物和有机物为载体的分离、除杂、鉴别、制备、仪器装置及实验基本操作、原理分析、评价、数据处理或以上各项的综合考查。
2.主观题:将在综合实验设计题或工艺流程图题中,考查常用实验仪器的应用和基本操作,物质分离、提纯的实验操作和物质检验的步骤等。
考点一 仪器的使用、化学实验基本操作
K (课前)
1.(实验基本操作)下列实验操作能达到实验目的的是 ( D )
实验目的
实验操作
A.
制备Fe(OH)3胶体
将NaOH浓溶液滴加到饱和FeCl3溶液中
B.
由MgCl2溶液制备无水MgCl2
将MgCl2溶液加热蒸干
C.
除去Cu粉中混有的CuO
加入稀硝酸溶解,过滤、洗涤、干燥
D.
比较水与乙醇中氢的活泼性
分别将少量钠投入到盛有水和乙醇的烧杯中
2.下列装置或操作能达到实验目的的是 ( B )
A.装置①可用于证明SO2与NaOH溶液发生了反应
B.装置②中X为CCl4,可用于吸收氨气或氯化氢
C.装置③可用于实验室从食盐水中提取氯化钠
D.装置④可用于证明溴乙烷与NaOH醇溶液共热生成乙烯
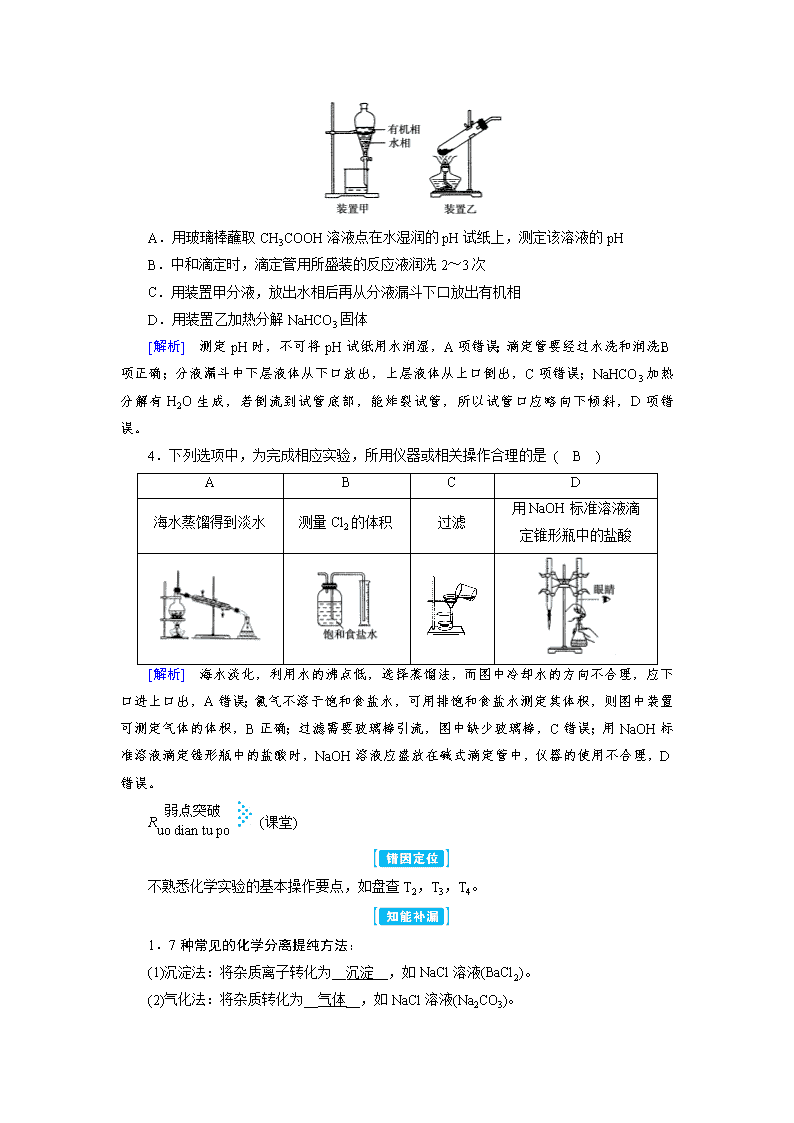
3.(实验基本操作)下列实验操作正确的是 ( B )
A.用玻璃棒蘸取CH3COOH溶液点在水湿润的pH试纸上,测定该溶液的pH
B.中和滴定时,滴定管用所盛装的反应液润洗2~3次
C.用装置甲分液,放出水相后再从分液漏斗下口放出有机相
D.用装置乙加热分解NaHCO3固体
[解析] 测定pH时,不可将pH试纸用水润湿,A项错误;滴定管要经过水洗和润洗,B项正确;分液漏斗中下层液体从下口放出,上层液体从上口倒出,C项错误;NaHCO3加热分解有H2O生成,若倒流到试管底部,能炸裂试管,所以试管口应略向下倾斜,D项错误。
4.下列选项中,为完成相应实验,所用仪器或相关操作合理的是 ( B )
A
B
C
D
海水蒸馏得到淡水
测量Cl2的体积
过滤
用NaOH标准溶液滴
定锥形瓶中的盐酸
[解析] 海水淡化,利用水的沸点低,选择蒸馏法,而图中冷却水的方向不合理,应下口进上口出,A错误;氯气不溶于饱和食盐水,可用排饱和食盐水测定其体积,则图中装置可测定气体的体积,B正确;过滤需要玻璃棒引流,图中缺少玻璃棒,C错误;用NaOH标准溶液滴定锥形瓶中的盐酸时,NaOH溶液应盛放在碱式滴定管中,仪器的使用不合理,D错误。
R (课堂)
不熟悉化学实验的基本操作要点,如盘查T2,T3,T4。
1.7种常见的化学分离提纯方法:
(1)沉淀法:将杂质离子转化为__沉淀__,如NaCl溶液(BaCl2)。
(2)气化法:将杂质转化为__气体__,如NaCl溶液(Na2CO3)。
(3)热分解法:加热使不稳定的物质__分解__,如NaCl(NH4Cl)。
(4)杂转纯法:将杂质转化为需要__提纯__的物质,如CO2(HCl)。
(5)氧化还原法:用氧化剂(还原剂)除去具有__还原性__
(__氧化__性)的杂质,如Fe2+(Cu2+)。
(6)酸碱溶解法:利用物质与酸或碱溶液混合后的差异进行分离提纯,如Mg(Al)。
(7)调pH法:加入试剂来调节溶液的pH,使溶液中的某成分__沉淀__而分离,如CuCl2(FeCl3)。
2.4种常见的物理分离方法:
(1)过滤——分离__固体__和液体,装置如图__a__。
(2)分液——分离__互不相溶__的液体,装置如图__c__。
(3)蒸馏——分离__沸点__相差较大的互溶液体,装置如图__d__。
(4)蒸发——除去含固体溶质的溶液中部分溶剂,装置如图__b__。
判断下列说法是否正确,正确的打“√”,错误的打“×”。
(1)用托盘天平称取12.20 g NaCl固体。(×)
(2)滴定管、分液漏斗、容量瓶等仪器在使用前必须检查是否漏液。(√)
(3)用25 mL的碱式滴定管准确量取12.50 mL 0.100 mol·L-1的酸性KMnO4溶液。(×)
(4)试管、圆底烧瓶、坩埚、蒸发皿均可直接在酒精灯上加热。(×)
(5)量筒、滴定管、容量瓶均标有使用温度。(√)
(6)容量瓶、量筒和滴定管均标有“0”刻度。(×)
(7)用湿润的蓝色石蕊试纸检验氨气。(×)
(8)用湿润的pH试纸检验溶液的pH,一定存在实验误差。(×)
(9)取用固体药品一定要用镊子夹取。(×)
(10)可用稀盐酸除去长时间存放石灰水的试剂瓶内壁的白色固体。(√)
实验基本知识的9个注意点
(1)酸式滴定管不能装碱性溶液,碱式滴定管不能装酸性及氧化性溶液。
(2)容量瓶不能作溶解或稀释仪器,不可加热。
(3)pH试纸不能直接蘸取待测液,不能用蒸馏水润湿。
(4)药品不能入口和用手直接接触,实验剩余药品不能放回原处(K、Na等除外),
不能随意丢弃,要放入指定容器中。
(5)中和滴定实验中锥形瓶不能用待测液润洗。
(6)量筒不能用来配制溶液或进行化学反应,更不能用来加热或量取热的溶液。
(7)用试管加热液体时,管口不能朝向人;加热固体时,管口应略向下倾斜。
(8)蒸发时不能将溶液蒸干。
(9)稀释浓硫酸时切记“酸入水”。
1.某地发生大型爆炸事件造成多人伤亡,专家估测其能量不亚于24吨TNT(2,4,6三硝基甲苯)爆炸发出的能量,同时现场发现有大量的碱、氰化钠等化学物质。下列说法正确的是 ( B )
A.爆炸一定都属于化学变化
B.盛放氰化钠的容器上应贴有如图所示的安全标识
C.生石灰烧伤应立即用大量的水冲洗并涂上中和剂硼酸
D.TNT爆炸的产物只有CO、CO2及氮氧化物
2.下列实验操作安全,且能达到实验目的的是 ( A )
A.配制硫酸亚铁溶液时,在配制的溶液中加入少许铁粉
B.发现酒精灯内酒精太少,熄灭酒精灯,立即补加
C.用无水乙醇萃取溴水中的溴,然后通过蒸馏分离乙醇与溴
D.将苯和溴水混合后加入铁粉制取溴苯
3.下列关于仪器使用的说法不正确的是 ( B )
A.酸碱中和滴定实验中,锥形瓶用蒸馏水洗涤后,不需要干燥
B.在量取液体后,量筒中残留的液体要用蒸馏水洗涤并转入相应容器
C.在测量或监测温度时,温度计水银球不能碰到容器内壁或底部
D.分液漏斗使用前需要检漏,确认不漏水后方可使用
考点二 物质的检验与鉴别
K (课前)
1.(物质的鉴别)下列实验所用试剂、现象和结论均正确的是 ( A )
实验序号
实验内容
试剂
现象和结论
①
鉴别K2CO3和Na2SO3
盐酸、澄清的石灰水
产生的无色无味气体,能使澄清的石灰水变浑浊的是K2CO3
②
鉴别NO2和Br2蒸气
湿润的淀粉KI试纸
使试纸变蓝色的是Br2蒸气
③
除去氯化钙溶液中的氯化铁杂质
生石灰
调节溶液的pH为3.7,再过滤
④
鉴别AlCl3溶液和MgCl2溶液
氨水
产生白色沉淀然后沉淀消失的是AlCl3溶液
A.①③ B.①②③
C.②④ D.①②③④
[解析] ①K2CO3中加入盐酸产生无色无味且能使澄清石灰水变浑浊的气体,Na2SO3中加入盐酸产生无色有刺激性气味且能使澄清石灰水变浑浊的气体,因此可以用盐酸、澄清的石灰水鉴别二者;②NO2和Br2蒸气均能使湿润的淀粉KI试纸变蓝;③氯化铁在溶液中存在水解平衡FeCl3+3H2OFe(OH)3+3HCl,加入生石灰后,CaO和HCl反应生成氯化钙,水解平衡右移,溶液的pH达到3.7时, FeCl3完全转化为Fe(OH)3沉淀,经过滤可除去;④向AlCl3溶液和MgCl2溶液中分别加入氨水后均产生白色沉淀,且白色沉淀均不溶于过量的氨水。综上所 述,①③正确,②④错误。
2.在一定条件下,甲苯可生成二甲苯混合物和苯。有关物质的沸点、熔点如下:
对二甲苯
邻二甲苯
间二甲苯
苯
沸点/℃
138
144
139
80
熔点/℃
13
-25
-47
6
下列说法不正确的是 ( B )
A.该反应属于取代反应
B.甲苯的沸点高于144 ℃
C.用蒸馏的方法可将苯从反应所得产物中首先分离出来
D.从二甲苯混合物中,用冷却结晶的方法可将对二甲苯分离出来
3.只用一种试剂可区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、(NH4)2SO4五种溶液,这种试剂是 ( A )
A.NaOH B.H2SO4
C.Ba(OH)2 D.AgNO3
4.现有一瓶标签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验:
已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀。该同学得出的结论正确的是 ( C )
A.根据现象1可推出该试液中含有Na+
B.根据现象2可推出该试液中不含有葡萄糖酸根
C.根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+
D.根据现象5可推出该试液中一定含有Fe2+
[解析] 现象1说明滤液中含有Na+,但不能说明原来的试液中是否含有Na+,因为实验中加入了NaOH和Na2CO3,A错误;葡萄糖含有醛基可发生银镜反应,但葡萄糖酸结构为CH2OH(CHOH)4COOH,分子不含—CHO,因此溶液不能发生银镜反应,B错误;调节pH=4后的滤液加入氨水无现象,说明不含Mg2+,加入Na2CO3溶液产生白色沉淀,说明含有Ca2+,C正确;根据现象5,可说明反应后的溶液中含有Fe3+,但不能说明原试液一定含有Fe2+,也可能原试液就含有Fe3+,D错误。
R (课堂)
1.忽视物质鉴别时产生的相同现象,如盘查T1。
2.不能依据不同物质(或离子)间的反应进行鉴别与推断,如盘查T3,T4。
1.必考的离子检验方法:
(1)利用盐酸和其他试剂检验。
CO:加入__BaCl2__溶液后生成白色沉淀,再加稀盐酸沉淀溶解,并放出无色__无__味的气体。
SO:先加入足量稀__盐酸__,无沉淀生成,再加入__BaCl2__溶液,产生白色沉淀。
SO:加入__BaCl2__溶液,产生白色沉淀,再加稀盐酸,放出无色有__刺激性__气味且能使__品红__溶液褪色的气体。
(2)利用AgNO3(HNO3酸化)溶液检验。
(3)利用某些特征反应检验。
①I-:滴入淀粉溶液和氯水,溶液变__蓝__色。
③利用焰色反应
④特殊的检验方法
2.鉴别物质的四种常见方法:
(1)__溶解__法:如BaCO3和Na2CO3。
(2)__加试剂__法:如用Ba(NO3)2可鉴别(NH4)2SO4和NH4Cl。
(3)__顺序滴加__法:如鉴别Na2CO3与盐酸、AlCl3溶液与NaOH溶液。
(4)__两两混合__法:如鉴别Na2CO3、HCl、NaCl、Ba(NO3)2四种溶液。
判断下列说法是否正确,正确的打“√”,错误的打“×”。
(1)向溶液中滴加盐酸酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO。(×)
(2)往无色溶液中滴加氯水和CCl4,振荡、静置,下层溶液呈紫色,说明原溶液中有I-。(√)
(3)只用试管和胶头滴管,不用任何试剂就可鉴别Ca(OH)2和NaHCO3溶液。(×)
(4)向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色无味气体,则该溶液中一定含有CO。(×)
(5)向某溶液中加入少量新制的氯水后加入几滴KSCN溶液,溶液变为红色,则该溶液中一定含有Fe2+。(×)
1.物质检验的一般程序和基本原则:
第一步:取少量试样(如果试样是固体要先配成溶液)放入容器(通常用试管)。
第二步:根据要求在试样中加入合适的试剂。
第三步:根据所发生的现象,进行分析、判断,得出结论。
2.物质检验的技巧和要求:
(1)先物理后化学,先利用物质的特殊颜色、状态、气味、焰色反应等进行检验,后利用化学反应检验。
(2)先常温后加热,先鉴别出常温下反应的物质,后鉴别加热条件下反应的物质。
(3)先分组后“逐一”,根据阴(阳)离子或官能团的性质分成若干组,然后再逐一鉴别。
(4)检验反应要求具有一定的选择性、典型性和明显性的外部特征。如品红溶液检验SO2,KSCN溶液检验Fe3+,湿润的红色石蕊试纸检验NH3等颜色的改变,或气体的生成,或沉淀的生成和溶解等特征现象。
(5)检验反应时常需排除干扰,如检验SO应排除CO、SO等干扰,检验Fe2+、Fe3+混合溶液中的Fe2+和检验CO2、SO2混合气体中的CO2等。
(6)通过①观察颜色;②反应现象;③共存关系;④电荷守恒;⑤来龙去脉,追踪推断物质组成成分中一定含有、一定不含有、可能含有某物质(离子)。
1.某无色气体,可能含HCl、CO2、NO2、HI、SO2、HBr中的一种或几种。将其通入氯水中,得到无色透明溶液,把溶液分成两份,向一份中加入盐酸酸化的BaCl2溶液,出现白色沉淀;另一份加入硝酸酸化的AgNO3溶液,也有白色沉淀生成。对于原无色气体推断一定正确的是 ( B )
A.一定存在HCl
B.一定存在SO2
C.肯定没有CO2
D.不能肯定是否含有NO2、HI
2.1 000 mL某待测溶液中除含有0.2 mol·L-1的Na+外,还可能含有下列离子中的一种或多种:
阳离子
K+、NH、Fe3+、Ba2+
阴离子
Cl-、Br-、CO、HCO、SO、SO
现进行如下实验操作(每次实验所加试剂均过量):
(1)写出生成白色沉淀B的离子方程式:__Ba2++HCO+OH-===BaCO3↓+H2O__。
(2)待测液中肯定不存在的阳离子是__Fe3+和Ba2+__。
(3)若无色气体D是单一气体:判断原溶液中K+是否存在__是__(填“是”或“否”),若存在,求其物质的量浓度的最小值,若不存在,请说明理由:__0.1_mol·L-1__。
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是__CO、HCO、SO__。
②沉淀A中能与稀硝酸反应的成分是__BaCO3、BaSO3__(写化学式)。
[解析] 待测液和氯化钡溶液反应得到沉淀A,则溶液中可能含有CO、SO、SO,向沉淀中加入稀硝酸生成气体,且有部分沉淀不溶解,则溶液中存在CO,可能存在SO、SO中的两种或一种,根据离子共存可知,原溶液中不存在Ba2+。溶液A中有Ba2+,加入过量的NaOH溶液得到气体B、白色沉淀B,则溶液中一定含有NH、HCO,一定不存在Fe3+,气体B为NH3,白色沉淀B为BaCO3。溶液B中通入氯气,得浅黄绿色溶液,溶液中一定没有Br-,溶液B中加入硝酸银、硝酸溶液得到白色沉淀C,C为AgCl,说明溶液B中含有Cl-,由于加入氯化钡溶液,不能确定原溶液中是否含有Cl-。
(1)由上述分析可知,白色沉淀B为碳酸钡,是由HCO、Ba2+、OH-反应生成,反应离子方程式为HCO+Ba2++OH-===BaCO3↓+H2O。
(2)由上述分析可知,溶液中一定没有的阳离子是Fe3+、Ba2+。
(3)若无色气体D是单一气体,则气体D为CO2,原溶液中不含SO,一定含有SO。则溶液中一定含有的阴离子有SO、CO、HCO,阳离子一定有Na+、NH。
沉淀D为BaSO4,则n(SO)==0.05 mol;
沉淀E为CaCO3,则n(CO)==0.1 mol;
气体B为NH3,则n(NH)==0.1 mol;
沉淀B为BaCO3,则n(HCO)==0.1 mol。
阳离子Na+、NH所带正电荷的物质的量为0.3 mol,阴离子SO、CO、HCO所带负电荷的物质的量为0.4 mol,根据电荷守恒,则阳离子一定还含有K+,由于溶液中阴离子还可能含有Cl-,则K+物质的量最少为0.1 mol,c(K+)最小为0.1 mol·L-1。
(4)若无色气体D是混合气体,只能为CO2、NO混合气体,白色沉淀D只能为BaSO4,溶液中一定含有SO,不能确定是否含有SO,沉淀A中一定含有BaCO3、BaSO3。①待测液中一定含有的阴离子是CO、HCO、SO。②沉淀A中的BaCO3、BaSO3均与稀硝酸反应。
考点三 混合物的分离提纯
K (课前)
1.正丁醛经催化加氢可制备1丁醇。为提纯含少量正丁醛杂质的1丁醇,现设计如下路线:
已知:①正丁醛与饱和NaHSO3溶液反应可生成沉淀;②乙醚的沸点是34 ℃,难溶于水,与1丁醇互溶;③1丁醇的沸点是118 ℃。则操作1~4分别是 ( D )
A.萃取、过滤、蒸馏、蒸馏
B.过滤、分液、蒸馏、萃取
C.过滤、蒸馏、过滤、蒸馏
D.过滤、分液、过滤、蒸馏
2.下列除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质) ( C )
选项
待提纯的物质
除杂的试剂
操作方法
A
NO2(NO)
O2
收集气体
B
CO2(HCl)
饱和Na2CO3溶液
洗气
C
FeCl2溶液(FeCl3)
足量铁粉
过滤
D
KCl溶液(MgCl2)
NaOH溶液
过滤
3.青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157 ℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35 ℃,从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺如图所示:
(1)对青蒿进行干燥破碎的目的是__增大青蒿与乙醚的接触面积,提高青蒿素的浸取率__。
(2)操作Ⅰ需要的玻璃仪器主要有烧杯、__漏斗、玻璃棒__,操作Ⅱ的名称是__蒸馏__。
(3)操作Ⅲ的主要过程可能是__B__(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)用下列实验装置测定青蒿素分子式的方法如下:将28.2 g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。
①装置A、E、F中盛放的物质分别是__NaOH溶液__、__CaCl2(或P2O5)__、__碱石灰__。
②G的作用是__防止空气中的CO2和水蒸气进入F装置__。
③
装置
实验前/g
实验后/g
E
22.6
42.4
F
80.2
146.2
则测得青蒿素的最简式是__C15H22O5__,欲确定其分子式,则还需要的物理量为__相对分子质量和摩尔质量__。
R (课堂)
1.记不住物质分离提纯的原则和要求。
2.想不出合适的方法,如盘查T2。
1.分离、提纯的“四原则”和“三必须”:
2.根据物质的物理性质选择分离(提纯)的方法:
(1)“固+固”混合物的分离(提纯)。
(2)“固+液”混合物的分离(提纯)。
(3)“液+液”混合物的分离(提纯)。
判断下列说法是否正确,正确的打“√”,错误的打“×”。
(1)用加热方法提纯含有少量NaHCO3的Na2CO3固体。(√)
(2)除去FeCl2溶液中的少量FeCl3,可用通入过量氯气的方法。(×)
(3)用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗的下口放出。(×)
(4)用加热的方法分离NH4Cl固体和碘单质。(×)
(5)除去CO2中的少量HCl,可先通过饱和NaHCO3溶液,再通过浓硫酸。(√)
(6)除去BaSO4中的BaCO3固体,可加入足量的硫酸,过滤洗涤干燥,得到的固体即为纯净的BaSO4。(√)
对于同一分离提纯问题。可能存在多种方法,但都要遵循步骤少、操作简单、除杂质彻底的原则。
1.下列除杂试剂或方法有错误的是 ( A )
选项
原物质
所含杂质
除杂试剂
主要操作方法
A
HNO3溶液
H2SO4
BaCl2溶液
过滤
B
CO2
SO2
酸性KMnO4溶液、浓硫酸
洗气、干燥
C
SiO2
Al2O3
稀盐酸
过滤
D
C2H5OH
CH3COOH
CaO
蒸馏
[解析] 硫酸与氯化钡反应生成硫酸钡和盐酸,引入新杂质,A项错误;二氧化硫与高锰酸钾发生反应,而二氧化碳不能,则利用酸性KMnO4溶液、浓硫酸试剂洗气、干燥可除杂,B项正确;氧化铝与盐酸反应,而二氧化硅不能,则加足量稀盐酸、过滤可除杂,C项正确;乙酸与CaO反应后生成醋酸钙,增大与乙醇沸点差异,则加CaO后蒸馏可除去C2H5OH中的CH3COOH,D项正确。
2.下列装置能达到实验目的的是 ( D )
A.用装置甲蒸发、结晶制取粗盐
B.用装置乙加热熔融NaOH固体
C.用装置丙除去CO2中的少量HCl
D.用装置丁进行萃取、分离
[解析] 蒸发结晶制取粗盐时,要用玻璃棒不断搅拌,A项错误;瓷坩埚成分中含有SiO2,SiO2能与NaOH发生反应,不能用瓷坩埚加热熔融的NaOH固体,B项错误;CO2、HCl均与饱和Na2CO3溶液反应,应用饱和NaHCO3溶液除去CO2中的少量HCl,C项错误;I2的CCl4溶液与水不互溶,能分层,可用分液漏斗分离,D项正确。
3.如图所示为固体混合物中分离X的两种方案,请根据方案1和方案2指出下列说法中合理的是 ( D )
A.可以选用方案1分离碳酸氢钠中含有的氯化铵
B.方案1中的残留物应该具有的性质是受热易挥发
C.方案2中加入的试剂一定能够与除X外的物质发生化学反应
D.方案2中加入NaOH溶液可以分离出SiO2和Fe2O3混合物中的Fe2O3
[解析] ①加热法分离、提纯固体混合物应满足的条件:一种物质受热易挥发或分解,另一物质受热不挥发或难分解。②加试剂法分离(过滤)提纯固体混合物应满足的条件:所加试剂能达到让一种物质形成溶液,而另一物质形成难溶物的状态。A项中碳酸氢钠、氯化铵受热均易分解,故用方案1不能将两物质分离开,错误;B项方案1中的残留物应该具有受热时不挥发或难分解的性质,错误;C项方案2中加入的试剂可能不与除X外的物质发生化学反应,如加水进行溶解分离,错误;D项中SiO2与NaOH溶液反应生成Na2SiO3溶液而分离,正确。
1.《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是 ( B )
A.蒸馏 B.升华
C.干馏 D.萃取
[解析] 本题以“科技文献”为载体,考查砒霜的性质、混合物的分离提纯等化学知识。蒸馏用于分离两种或多种互溶的液体混合物,根据液体沸点的不同进行分离,A项错误;升华是指固态物质受热直接变成气态物质,气态物质遇冷凝华为固态物质。即砒霜样品受热使有效成分三氧化二砷变成蒸气(升华)
,降温,蒸气凝华成固体,从而达到分离提纯砒霜的目的,B项正确;干馏是指煤等在隔绝空气的条件下加强热发生一系列化学变化的过程,砒霜提纯过程中有效成分没有发生变化,C项错误;萃取是指用萃取剂将一种物质从其溶液中提取出来的过程,如用苯或四氯化碳萃取溴水中的溴(或碘水中的碘),D项错误。升华是分离一些特殊物质的方法。例如,从氯化钠和碘、碘和砂的混合物中提纯碘,可以采用升华法。采用类似升华的方法分离氯化铵和氯化钠,注意:升华法不能分离氯化铵和碘的混合物。
2.实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气)。下列说法正确的是 ( B )
A.①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
B.管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C.结束反应时,先关闭活塞K,再停止加热
D.装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
[解析] 本题考查实验设计与评价,涉及氢气制备和氢气还原氧化钨的实验。审题时抓住两个关键、一个迁移:关键1——锌粒中的硫指硫元素,即锌粒中含有少量硫化锌(ZnS),暗示:制备氢气时会生成H2S;关键2——焦性没食子酸溶液用于吸收装置内少量O2;迁移——氢气还原氧化钨实验类似教材中氢气还原氧化铜实验。加热WO3之前,要确保排尽装置内的空气,因为H2在空气中的浓度达到一定范围时,加热易发生爆炸,通过检验氢气的纯度判断空气是否排尽,B项正确。装置Q是启普发生器,是氢气的发生装置,装置排列顺序是氢气发生装置→安全瓶→除去HCl、O2装置→除去H2S装置→干燥氢气装置→氢气还原氧化钨装置→尾气处理装置。Zn+2HCl===ZnCl2+H2↑、ZnS+2HCl===ZnCl2+H2S↑,用装置Q制得的氢气中含有H2S、O2、HCl、H2O等杂质,由于酸性高锰酸钾溶液氧化氯化氢生成氯气,所以,应先用焦性没食子酸溶液吸收氧气,同时除去氯化氢(易溶于水),再用酸性高锰酸钾溶液吸收硫化氢,最后用浓硫酸干燥,试剂盛放顺序依次为焦性没食子酸溶液、酸性高锰酸钾溶液、浓硫酸,A项错误;类似氢气还原氧化铜,实验完毕后,先停止加热,再继续通入氢气一段时间,C项错误;装置Q不能加热,适合块状固体与液体在常温下反应,而实验室用二氧化锰与浓盐酸反应制氯气需要加热,且二氧化锰是粉末状固体,故不能用装置Q制备氯气,D项错误。
3.下列由实验得出的结论正确的是 ( A )
实验
结论
A
生成的1,
将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明
2-二溴乙烷无色、可溶于四氯化碳
B
乙醇和水都可与金属钠反应产生可燃性气体
乙醇分子中的氢与水分子中的氢具有相同的活性
C
用乙酸浸泡水壶中的水垢,可将其清除
乙酸的酸性小于碳酸的酸性
D
甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红
生成的氯甲烷具有酸性
[解析] 本题考查有机化学实验。乙烯与溴发生加成反应生成的1,2—二溴乙烷是一种无色、可溶于CCl4的有机物,A项正确。乙醇和水均能与Na反应生成H2,但Na与水反应更剧烈,故水分子中氢的活性强于乙醇分子中氢的活性,需要注意的是乙醇分子中只有—OH中的H能与Na反应,乙醇分子中氢的活性不完全相同,B项错误;乙酸能除去水垢,说明酸性:乙酸>碳酸,C项错误;CH4与Cl2发生取代反应生成的CH3Cl、CH2Cl2、CHCl3、CCl4不具有酸性,但生成的HCl能使湿润的石蕊试纸变红,D项错误。
4.由下列实验及现象不能推出相应结论的是 ( C )
实验
现象
结论
A
向2 mL 0.1 mol·L-1的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液
黄色逐渐消失,加KSCN溶液颜色不变
还原性: Fe>Fe2+
B
将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶
集气瓶中产生大量白烟,瓶内有黑色颗粒产生
CO2具有氧化性
C
加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸
石蕊试纸变蓝
NH4HCO3显碱性
D
向2支盛有2 mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液
一支试管中产生黄色沉淀,另一支中无明显现象
Ksp(AgI)< Ksp(AgCl)
[解析] 本题考查化学实验。向FeCl3溶液中加入足量铁粉后,Fe3+完全转化为Fe2+,滴入KSCN溶液,溶液不变色,可证明还原性,Fe>Fe2+,A项正确;燃着的金属钠能在装有CO2的集气瓶中反应生成Na2CO3和C,说明CO2具有氧化性,B项正确;NH4HCO3受热分解生成的NH3能使湿润的红色石蕊试纸变蓝,只能说明NH3为碱性气体,不能确定NH4HCO3的酸碱性,C项错误;根据题中描述可知黄色沉淀为AgI,另一支试管中无明显现象,说明没有AgCl析出,可证明Ksp(AgI)