- 503.00 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2020年天津市十二区县重点学校高三毕业班联考(一)
化学试卷
本试卷分为第I卷(选择题)和第II卷(非选择题)两部分,共100分,考试用时60分钟。第I卷1至4页,第II卷5至8页。
答卷前,考生务必将自己的姓名、考生号填写在答题卡上,并在规定位置粘贴考试用条形码。答题时,考生务必将答案涂写在答题卡上,答在试卷上的无效。
祝各位考生考试顺利!
第I卷
注意事项:
1.每题选出答案后,用铅笔将答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。
2.本卷共12题,每题3分,共36分。在每题给出的四个选项中,只有一项是最符合题目要求的。
以下数据可供解题时参考:
相对原子质量:H 1 Li 7 C 12 N 14 O 16 Mg 24 S 32 Br 80
1.我国在物质制备领域成绩斐然,下列物质属于有机物的是
A.砷化铌纳米带
B.全氮阴离子盐
C.聚合氮
D.双氢青蒿素
2.下列有关化学用语表示正确的是
A.氮气的电子式: B.氯原子的结构示意图为:
C.Cr的基态原子价电子排布式为:3d54s1 D.聚氯乙烯的链节:CH2=CHCl
3.设NA为阿伏加德罗常数的值,下列有关说法正确的是
A.常温常压下,1.8g甲基(—CD3)中含有的电子数为NA
B.0. lmol环氧乙烷()中含有的共价键数为0. 3 NA
C.常温下,1L pH=9的CH3COONa溶液中,发生电离的水分子数为1×10-9 NA
D.加热条件下,含0.2molH2SO4的浓硫酸与足量铜反应,转移电子数小于0.2NA
4.下列说法正确的是
A.最外层都只有2个电子的元素原子性质一定相似
B.同一周期元素中,第一电离能随原子序数增加而增大
C.I3AsF6晶体中存在I3+离子,I3+离子的几何构型为V形
D.H2O2是一种含有极性键和非极性键的非极性分子
5.化学产品在抗击新型冠状病毒的战役中发挥了重要作用,下列说法不正确的是
A.75%的医用酒精常用于消毒,用95%的酒精消毒效果更好
B.“84”消毒液的主要成分是次氯酸钠
C.用硝酸铵制备医用速冷冰袋是利用了硝酸铵溶于水快速吸热的性质
D.医用防护口罩中熔喷布的生产原料主要是聚丙烯,聚丙烯的单体是丙烯
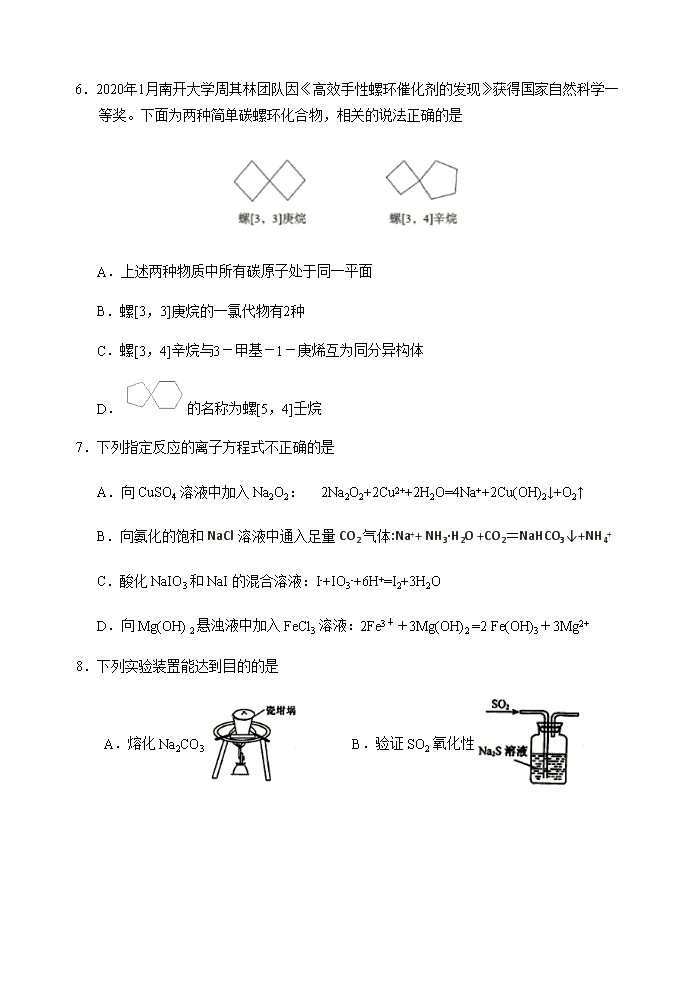
6.2020年1月南开大学周其林团队因《高效手性螺环催化剂的发现》获得国家自然科学一等奖。下面为两种简单碳螺环化合物,相关的说法正确的是
A.上述两种物质中所有碳原子处于同一平面
B.螺[3,3]庚烷的一氯代物有2种
C.螺[3,4]辛烷与3-甲基-1-庚烯互为同分异构体
D.的名称为螺[5,4]壬烷
7.下列指定反应的离子方程式不正确的是
A.向CuSO4溶液中加入Na2O2: 2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑
B.向氨化的饱和NaCl溶液中通入足量CO2气体:Na++ NH3·H2O +CO2=NaHCO3↓+NH4+
C.酸化NaIO3和NaI的混合溶液:I-+IO3-+6H+=I2+3H2O
D.向Mg(OH) 2悬浊液中加入FeCl3溶液:2Fe3++3Mg(OH)2 =2 Fe(OH)3+3Mg2+
8.下列实验装置能达到目的的是
A.熔化Na2CO3 B.验证SO2氧化性
C.实验室制取NH3 D.保存液溴
9.氮及其化合物的转化过程如图所示。下列分析合理的是
A.N2与H2反应生成NH3的原子利用率为100%
B.催化剂a表面发生了极性共价键的断裂和形成
C.在催化剂b表面形成氮氧键时,不涉及电子转移
D.催化剂a、b能提高反应的平衡转化率
10.研究生铁的锈蚀,下列分析不正确的是
序号
①
②
③
实验
现象
8小时未观察到明显锈蚀
8小时未观察到明显锈蚀
1小时观察到明显锈蚀
A.①中,NaCl溶液中溶解的O2不足以使生铁片明显锈蚀
B.②中,生铁片未明显锈蚀的原因之一是缺少H2O
C.③中正极反应:O2+4e−+ 2H2O ==4OH−
D.对比①②③,说明苯能隔绝O2
11.下列说法正确的是
A.向NaHCO3溶液中通入CO2至pH=7,则 c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B.室温下,浓度均为0.1 mol/L的CH3COOH、CH3COONa混合溶液的pH=4,则
c(CH3COO-)-c(CH3COOH)=2×(10-4-10-10) mol/L
C.加水稀释0.1 mol/L醋酸溶液,溶液中增大
D.室温下,NaHA溶液的pH<7,则一定有c(Na+)=c(HA-)+c(H2A)+c(A2-)
12.在3个体积均为4.0 L的恒容密闭容器中,反应 CO2(g)+C(s)2CO(g) ΔH > 0
分别在一定温度下达到化学平衡状态。下列说法正确的是
容器
温度/K
起始时物质的量/mol
平衡时物质的量/mol
n(CO2)
n(C)
n(CO)
n(CO)
I
977
0.56
1.12
0
0.8
II
977
1.12
1.12
0
x
III
1250
0
0
1.12
y
A.977 K,该反应的化学平衡常数值为4
B.达到平衡时,向容器I中增加C的量,平衡正向移动
C.达到平衡时,容器I中CO2的转化率比容器II中的大
D.达到平衡时,容器III中的CO的转化率大于28.6%
第II卷
注意事项:
1.用黑色墨水的钢笔或签字笔将答案写在答题卡上。
2.本卷共4题,共64分。
13.(14分)2019年的化学诺贝尔奖颁给了为锂电池研究作出贡献的三位科学家,其研究的是两种常见锂电池:一种是采用镍钴锰酸锂Li(NiCoMn)O2或镍钴铝酸锂为正极的“三元材料锂电池”;另一种是采用磷酸铁锂(LiFePO4)为正极的电池。请回答下列问题:
(1)利用FeSO4、(NH4)2HPO4、LiOH为原料以物质的量之比1∶1∶1反应生成LiFePO4,该化学反应方程式为_______________________________________。
(2)Mn位于元素周期表的________区(填“s”或“p”或“d”或“ds”或“f”),基态钴原子的未成对电子数为__________,1mol [CoCl (NH3)5] Cl2 中含σ键数目为_____NA。
(3)磷元素可以形成多种含氧酸H3PO4、H3PO2、H3PO3、HPO3,这四种酸中酸性最强的是__________。PO43-的空间构型是__________,中心原子的杂化方式是__________。
(4)PH3是___________分子(填“极性”或“非极性”),其在水中的溶解性比NH3小,原因是___________。
(5)硫化锂Li2S(摩尔质量Mg∙mol-1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如右图。
若硫化锂晶体的密度为ag·cm-3,则距离最近的两个S2-的距离是___________nm。(用含a、M、NA的计算式表示)
14.(17分)布洛芬(Ibuprofen)为非甾体抗炎药,具有镇痛、抗炎作用。其合成路线如下:
请回答下列问题:
(1)A→B的反应类型为_________ B的分子式为_________
(2)C中所含官能团的名称为_____________
(3)苯中混有A,除杂试剂为________________,分离方法为_________
(4)检验D中官能团的化学方程式_________________________反应类型为_________
(5)比E少4个碳原子的E的同系物,其符合下列条件的同分异构体有______种(不考虑立体异构),其中核磁共振氢谱为五组峰的结构简式为__________________
①遇FeCl3溶液显紫色 ②苯环上只有两个互为对位的取代基
③1mol该物质与足量的金属钠反应产生1mol H2 ④双键碳原子上不连羟基
(6)请结合题中所给信息和所学知识以 和CH3CH2OH为原料(其它无机试剂任选)合成
__________________________________________________________________________。
15.(17分)某化学小组在实验室选用下图所示装置 (夹持装置略)采用镁屑与液溴为原料制备无水MgBr2。
已知:①乙醚的熔点为-116.3℃,沸点为34.6℃。
②Mg和Br2反应非常剧烈,放出大量的热;MgBr2具有强吸水性;MgBr2能与乙醚发生反应 MgBr2 +3C2H5OC2H5MgBr2 • 3C2H5OC2H5。
③不考虑氮气与镁的反应
实验主要步骤如下:
I.选用上述部分装置,正确连接,检查装置的气密性。向装置中加入药品。
II.加热装置A,迅速升温至140℃,并保持140℃加热一段时间,停止加热。
III.通入干燥的氮气,使溴分子缓慢进入装置B中,直至完全加入。
IV.装置B中反应完毕后恢复至室温,过滤,将滤液转移至干燥的烧瓶中,在冰水中冷却,析出晶体,再过滤得三乙醚合溴化镁粗产品。
V.用苯洗涤粗产品,过滤,得三乙醚合溴化镁,将其加热至160℃分解得无水 MgBr2。
请回答下列问题:
(1)装置A中使用仪器m的优点是________。
(2)步骤I中所选装置的正确连接顺序是a ________ (填小写字母),装置D的作用是_______。
(3)若加热装置A一段时间后发现忘记加入碎瓷片,应该采取的正确操作是________。
(4)实验中不能用干燥空气代替干燥N2,原因是_____________;
(5)有关步骤V的说法,正确的是__________________;
A.可用95%的乙醇代替苯溶解粗品 B.洗涤晶体可选用0℃的苯
C.加热至160℃的主要目的是除去苯 D.该步骤的目的是除去乙醚和可能残留的溴
(6)为测定产品的纯度(假定杂质不参与反应),可用EDTA (简写为Y4-,无色)标准溶液滴定,以络黑T为指示剂(pH=6.3~11.6时显蓝色,pH>11.6时显橙色)。已知: Mg2+与络黑T形成的配合物(Mg2+-络黑T)呈酒红色,Mg2+与Y4-形成的MgY2-为无色;在pH约为9的缓冲溶液中滴定,反应的离子方程式为:Mg2+ + Y4-=MgY2-, Mg2+-络黑T+Y4- =MgY2- +络黑T。
①判断滴定终点的现象为__________________.
②测定前,先称取0.2500g无水MgBr2产品,溶解后,加人2滴络黑T试液作指示剂,用0. 0500 mol·L-1 EDTA标准溶液滴定至终点,消耗EDTA标准溶液25. 00 mL,则测得无水MgBr2产品的纯度是___________________(以质量分数表示)。
(7)实验中若温度控制不当,装置B中会产生CH2Br—CH2Br。请设计实验验证 CH2Br—CH2Br的存在:从反应后的混合物中分离提纯得到待测样品,________________________
_____________________________。(补全实验操作)
16.(16分)甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g) CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
共价键
C—O
H—O
N—H
C—N
C—H
键能/kJ·mol-1
351
463
393
293
414
则该反应的ΔH=_________kJ·mol-1。
(2)上述反应中所需的甲醇工业上利用水煤气合成CO(g)+2H2(g) CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为_________。
②X轴上a点的数值比b点_________ (填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是________________________________。
(3)工业上可采用CH3OHCO+2H2 来制取高纯度的CO和H2。我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。
甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式 A:CH3OH* →CH3O* +H* Ea= +103.1kJ·mol-1
方式 B:CH3OH* →CH3* +OH* Eb= +249.3kJ·mol-1
由活化能E值推测,甲醇裂解过程主要历经的方式应为_________(填A、B)。
下图为计算机模拟的各步反应的能量变化示意图。
该历程中,放热最多的步骤的化学方程式为____________________________________。
(4)PbI2与金属锂以LiI-Al2O3固体为电解质组成锂碘电池,其结构示意图如下,电池总反应可表示为:2Li+PbI2=2LiI+Pb,则b极上的电极反应式为:_______________。
(5)CH3NH2的电离方程式为CH3NH2+H2OCH3NH3++OH-电离常数为kb,已知常温下pkb=-lgkb=3.4,则常温下向CH3NH2溶液滴加稀硫酸至c(CH3NH2)=c(CH3NH3+)时,溶液pH=____________。
2020年天津市十二重点中学高三毕业班联考(一)
化学参考答案
1
2
3
4
5
6
7
8
9
10
D
C
D
C
A
B
C
B
A
D
11
12
B
C
13.(1)FeSO4+(NH4)2HPO4+LiOH=LiFePO4+(NH4)2SO4+H2O (2分)
(2)3(1分) d (1分) 21(2分)
(3)HPO3(1分)正四面体(1分) sp3(1分)
(4)极性(1分) NH3能与水分子形成氢键,而PH3不能,所以在水中的溶解性PH3小(2分)
(5)(2分)
14. (1)取代反应(1分) C12H16O (1分)
(2)醚键、酯基(2分)
(3)高锰酸钾酸性溶液、NaOH溶液(2分);分液(1分)
(4)(2分),(与银氨溶液反应也可) 氧化反应(1分)
(5)5(2分)(1分)
(6)(4分)
15.(1)使系统内压强相等,便于液体顺利流下(2分)
(2)efbcg(ef可颠倒,bc可颠倒)(2分)防止倒吸(1分)
(3)停止加热,冷却后补加碎瓷片(2分)
(4)防止镁屑与氧气反应生成的MgO阻碍Mg和Br2的反应(2分)
(5)BD(2分)
(6)①当滴加最后一滴EDTA标准溶液时,溶液由酒红色变为蓝色,且半分钟内溶液颜色保持不变(2分)②92%(2分)
(7)取少量样品于试管中,加入NaOH溶液,加热,再加入稀硝酸酸化,滴加AgNO3溶液,有淡黄色沉淀生成,证明有CH2Br-CH2Br。(2分)其它合理答案也可
16.(1)-12 (2分)
(2)①25% (2分)
②小 (2分) 随着Y值的增大,φ(CH3OH)减小,平衡CO(g)+2H2(g) CH3
OH(g)向逆反应方向进行,故Y为温度(2分)
(3)A (2分) CHO*+3H*=CO*+4H*(或CHO*=CO*+H*)(2分)
(4)PbI2+2e-=Pb+2I- 或PbI2+2e-+2Li+=Pb+2LiI(2分)
(5)10.6(2分)