- 313.00 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
题型层级练12 物质结构与性质(选修3)
授课提示:对应学生用书147页
(A级)
1.钛(22Ti)铝合金在航空领域应用广泛。回答下列问题:
(1)基态Ti原子的核外电子排布式为[Ar]________,其中s轨道上总共有________个电子。
(2)六氟合钛酸钾(K2TiF6)中存在[TiF6]2-配离子,则钛元素的化合价是________,配体是________。
(3)TiCl3可用作烯烃定向聚合的催化剂,例如,丙烯用三乙基铝和三氯化钛作催化剂时,可以发生下列聚合反应:
nCH3CH===CH2CH(CH)3—CH2,该反应涉及的物质中碳原子的杂化轨道类型有________,反应涉及的元素中电负性最大的是________。三乙基铝是一种易燃物质,在氧气中三乙基铝完全燃烧所得产物中分子的立体构型是直线形的是________。
(4)钛与卤素形成的化合物熔沸点如表所示:
化合物
熔点/℃
沸点/℃
TiCl4
-25
136.5
TiBr4
39
230
TiI4
150
377
分析TiCl4、TiBr4、TiI4的熔点和沸点呈现一定规律的原因是
________________________________________________________________________
________________________________________________________________________。
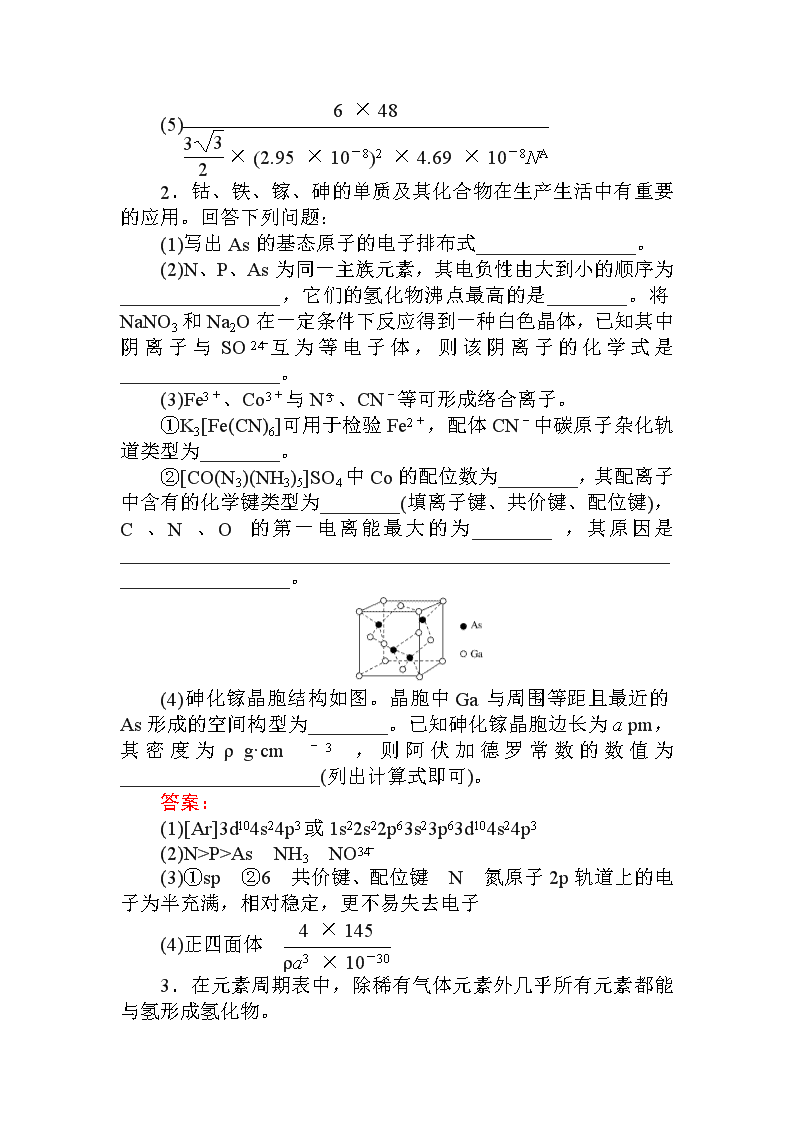
(5)金属钛有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示是钛晶体的一种晶胞结构,晶胞参数a=0.295 nm,c=0.469 nm,则该钛晶体的密度为________g·cm(用NA表示阿伏加德罗常数的值,列出计算式即可)。
解析:
(1)Ti为22号元素,基态Ti原子的核外电子排布式为[Ar]3d24s2或1s22s22p63s23p63d24s2,其中s轨道上共有8个电子。
(2)由化合物中正、负化合价的代数和为0,知钛元素的化合价为+4,配体是F-。
(3)该反应涉及的物质中碳原子的杂化轨道类型有sp3杂化、sp2杂化。同一周期主族元素,从左到右元素的电负性递增,同一主族元素,自上而下元素的电负性递减,故涉及的元素中电负性最大的是Cl。三乙基铝在O2中燃烧生成Al2O3、CO2和H2O,其中分子的立体构型是直线形的是CO2。
(4)三者都是分子晶体,对于组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越大,熔、沸点越高。
(5)该晶胞的底面正六边形的面积S=a2,则该晶胞的体积为a2c=×(2.95×10-8)2×(4.69×10-8)cm3,又该晶胞中含有的钛原子的数目为2×+3+12×=6,则该晶胞的质量为 g,故该钛晶体的密度为 g·cm-3。
答案:
(1)3d24s2 8
(2)+4 F-
(3)sp2、sp3 Cl CO2
(4)TiCl4、TiBr4、TiI4都是分子晶体,而且组成和结构相似,其相对分子质量依次增大,分子间作用力逐渐增大,因而三者的熔点和沸点依次升高
(5)
2.钴、铁、镓、砷的单质及其化合物在生产生活中有重要的应用。回答下列问题:
(1)写出As的基态原子的电子排布式________________。
(2)N、P、As为同一主族元素,其电负性由大到小的顺序为________________,它们的氢化物沸点最高的是________。将NaNO3和Na2O在一定条件下反应得到一种白色晶体,已知其中阴离子与SO互为等电子体,则该阴离子的化学式是________________。
(3)Fe3+、Co3+与N、CN-等可形成络合离子。
①K3[Fe(CN)6]可用于检验Fe2+,配体CN-中碳原子杂化轨道类型为________。
②[CO(N3)(NH3)5]SO4中Co的配位数为________,其配离子中含有的化学键类型为________(填离子键、共价键、配位键),C、N、O的第一电离能最大的为________,其原因是________________________________________________________________________。
(4)砷化镓晶胞结构如图。晶胞中Ga与周围等距且最近的As形成的空间构型为________。已知砷化镓晶胞边长为a pm,其密度为ρ g·cm-3,则阿伏加德罗常数的数值为____________________(列出计算式即可)。
答案:
(1)[Ar]3d104s24p3或1s22s22p63s23p63d104s24p3
(2)N>P>As NH3 NO
(3)①sp ②6 共价键、配位键 N 氮原子2p轨道上的电子为半充满,相对稳定,更不易失去电子
(4)正四面体
3.在元素周期表中,除稀有气体元素外几乎所有元素都能与氢形成氢化物。
(1)氨气是共价型氢化物。工业上常用氨气和醋酸二氨合铜{[Cu(NH3)2]Ac}的混合液来吸收一氧化碳(醋酸根简写为Ac-)。反应方程式为[Cu(NH3)2]Ac+CO+NH3[Cu(NH3)3CO]Ac。
①请写出基态Cu原子的电子排布式:________________________。
②氨水溶液中各元素原子的第一电离能从大到小的排列顺序为________,理由是
________________________________________________________________________
________________________________________________________________________。
其中NH3应为________分子(填“极性”或“非极性”)。
③醋酸分子中的两个碳原子的杂化方式分别是________。
④生成物[Cu(NH3)3CO]Ac中所含化学键类型有________(填序号)。
a.离子键 b.金属键
c.共价键 d.配位键
(2)某离子型氢化物化学式为XY2,晶胞结构如图所示,其中6个Y原子()用阿拉伯数字1~6标注。
①已知1、2、3、4号Y原子在晶胞的上、下面上。则5、6号Y原子均在晶胞________(填“侧面”或“内部”)。
②根据以上信息可以推知,XY2晶体的熔、沸点________(填“>”“=”或“<”)固态氨的沸点。
③若该晶胞的边长为a nm,密度为ρ g·cm-3,XY2的摩尔质量为M g·mol-1,则阿伏加德罗常数可表示为________________________________(用含a、ρ、M的代数式表示)。
解析:
(1)①铜元素为29号元素,原子核外有29个电子,所以其核外电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1。②氨水中含氢、氮、氧三种元素,同主族元素,从上至下第一电离能逐渐减小,同周期元素,从左至右第一电离能呈增大趋势,但第Ⅴ
A族元素的2p能级因为是半充满状态,结构稳定,第一电离能反常,大于第ⅥA族元素的第一电离能,所以第一电离能从大到小的顺序为N>O>H;氨分子是三角锥型结构,是极性分子。③甲基中碳原子形成4个σ键,杂化轨道数目为4,采用sp3杂化。④铜离子和氨分子有配位键,氨分子中有共价键,[Cu(NH3)3CO]+和Ac-之间形成离子键,所以选acd。
(2)①X在8个顶点和体心,晶胞中一共含有2个X,则由氢化物化学式XY2,可知该晶胞中含有4个Y,又1、2、3、4号Y原子在晶胞上、下面上,则实际为2个Y原子,则5、6号Y原子均在晶胞内部。②XY2晶体为离子晶体,固态氨为分子晶体,所以XY2晶体的熔、沸点高于固态氨的熔、沸点。③晶胞中含有2个XY2,所以有关系式:(a×10-7 cm)3ρ g·cm-3 NA mol-1×=M g·mol-1,则NA=。
答案:
(1)①[Ar]3d104s1或1s22s22p63s23p63d104s1
②N>O>H 同周期元素,从左至右第一电离能呈增大趋势,但第ⅤA族元素的2p能级处于半充满状态,结构稳定,第一电离能反常,大于第ⅥA族元素 极性 ③sp3和sp2 ④acd
(2)①内部 ②> ③
(B级)
4.A、B、C、D是四种前三周期元素,且原子序数逐渐增大,这四种元素的基态原子的未成对电子数和电子层数相等。
请回答下列问题:
(1)D元素的基态原子的价电子排布式是:______________。
(2)A、B、C三种元素可以形成化合物A4B2C2,它是厨房调味品之一。1 mol A4B2C2中含有________mol σ键,其中B原子采用的杂化方式为:
________________________________________________________________________
________________________________________________________________________。
(3)元素F的原子序数是介于B和C之间的,元素B、C、F的电负性的大小顺序是:________;B、C、F的第一电离能的大小顺序是:________________(由大到小,用元素符号填空)。
(4)随着科学的发展和大型实验装置(如同步辐射和中子源)的建成,高压技术在物质研究中发挥越来越重要的作用。高压不仅会引发物质的相变,也会导致新类型化学键的形成。近年来就有多个关于超高压下新型晶体的形成与结构的研究报道。NaCl晶体在50~300 GPa的高压下和Na或Cl2反应,可以形成不同组成、不同结构的晶体。如图给出其中三种晶体的晶胞(大球为氯原子,小球为钠原子),写出A、B、C对应晶体的化学式。
A________;B________;C________。
(5)磷化硼是一种受到高度关注的耐磨涂料。它可用作金属的表面保护层。磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成。合成磷化硼的化学方程式为:BBr3+PBr3+3H2高温,BP+6HBr。
①分别画出三溴化硼分子和三溴化磷分子的结构________、________。
磷化硼晶体中磷原子作面心立方最密堆积,硼原子填入部分四面体空隙中。磷化硼的晶胞示意图如图。
②已知磷化硼的晶胞参数a=478 pm,计算晶体中硼原子和磷原子的最小核间距(dB-P)(写出计算式,不要求计算结果)________________________________。
答案:
(1)3s23p3 (2)7 sp2、sp3
(3)O>N>C N>O>C
(4)NaCl3 Na3Cl Na2Cl
(5)①
②dB-P=a=×478 pm或dB-P==
eq f(1,4)a≈207 pm
5.研究发现,在CO2低压合成甲醇反应(CO2+3H2―→CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为________________。元素Mn与O中,第一电离能较大的是________,基态原子核外未成对电子数较多的是________。
(2)CO2和CH3OH分子中C原子的杂化形式分别为________和________。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为________________,原因是
________________________________________________________________________
________________________________________________________________________。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在________。
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为________nm。MnO也属于NaCl型结构,晶胞参数为a′=0.448 nm,则r(Mn2+)为________nm。
解析:
(1)Co为27号元素,Co的基态原子核外电子排布式为:1s22s22p63s23p63d74s2或[Ar]3d74s2;金属性越强,第一电离能越小,而金属性:Mn>O,故第一电离能较大的为O。Mn原子的价电子排布式为3d54s2,根据洪特规则,有5个未成对电子,而O原子的价电子排布式为2s22p4,仅有2个未成对电子,故基态原子核外未成对电子数较多的是Mn;
(2)根据价层电子对互斥理论,CO2中C原子价层电子对数为2,为sp杂化,而CH3OH中C原子的价层电子对数为4,为sp3杂化;
(3)影响分子晶体沸点的因素有范德华力和氢键,H2O与CH3OH均为极性分子,H2O中氢键比甲醇多,故H2O的沸点高,CO2与H2均为非极性分子,CO2相对分子质量较大,范德华力大,沸点更高;
(4)Mn (NO3)2为离子化合物,Mn2+与NO之间是离子键,根据NO的结构式,N与O之间存在双键,故除了σ键还存在离子键、π键;
(5)由题意知在MgO中,阴离子作面心立方堆积,氧离子沿晶胞的面对角线方向接触,所以a=2r(O2-),r(O2-)=0.148 nm;MnO的晶胞参数比MgO更大,说明阴离子之间不再接触,阴阳离子沿坐标轴方向接触,故2[r(Mn2+)+r(O2-)]=a′,r(Mn2+)=0.076 nm。
答案:
(1)1s22s22p63s23p63d74s2或[Ar]3d74s2 O Mn
(2)sp sp3
(3)H2O>CH3OH>CO2>H2 水含氢键比甲醇中多;CO2与H2均为非极性分子,CO2相对分子质量较大,范德华力大
(4)离子键、π键
(5)0.148 0.076
6.金属互化物是指固相金属间化合物拥有两种或两种以上的金属元素,如Cu9 Al4、Cu5 Zn8等。回答下列问题:
(1)铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)大于锌的第二电离能,其主要原因是
________________________________________________________________________
________________________________________________________________________。
电离能/kJ·mol-1
I1
I2
铜
746
1 958
锌
906
1 733
(2)金属Na、Mg、Al的熔点由高到低的顺序是________,原因是________________________________________________________________________
________________________________________________________________________。
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2,1 mol (SCN)2分子中含有σ键的数目为________;SCN-中C原子采取的杂化方式为________,SCN-的空间构型为________。类卤素(SCN)2对应的酸有两种,理论推测硫氰酸(S—H—C≡N)的沸点低于异硫氰酸(N—H=C=S)的沸点,其原因是
________________________________________________________________________
________________________________________________________________________。
(4)铜与金形成的金属互化物结构如图所示,其晶胞棱长为a pm,晶胞中Cu与Au原子个数比为__________,其中原子坐标参数A为(0,0,0),B为(,,0),则C原子的坐标参数为________________,该金属互化物的密度为________g·cm-3(用含a、NA的代数式表示)。
解析:
(1)Cu是29号元素,原子核外电子数为29,基态原子核外电子排布式为1s22s22p63s23p63d104s1,Zn的核外电子排布式为1s22s22p63s23p63d104s2,Cu比Zn更容易失去一个电子,所以Cu第一电离能比Zn的小。Cu失去第一个电子变为Cu+后,核外电子排布式为[Ar]3d10,第二个电子在3d全满轨道上,Zn失去1个电子后,核外电子排布式为[Ar]3d104s1,3d全满比4s半满能量低,结构也更稳定,所以铜的第二电离能较大。
(2)金属晶体中金属阳离子半径越小,所带电荷数越多,金属键越强。离子半径:Na+>Mg2+>Al3+,而电荷数:Na+Mg>Na。
(3)(SCN)2的结构式为N≡C—S—S—C≡N,根据(SCN)2
的结构可知分子中有3个单键和2个碳氮三键,单键为σ键,每个三键含有1个σ键、2个π键,1个(SCN)2分子含有5个σ键,故1 mol(SCN)2分子中含有σ键的数目为5NA。SCN-可能的结构为—S—C≡N或—N=C=S,这两种结构都是直线形的构型,C都采取sp杂化。异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键。
(4)晶胞中Cu原子数目为6×=3,Au原子数目为8×=1,晶胞质量为 g,晶胞棱长为a pm=a×10-10 cm,则晶胞体积为(a×10-10 cm)3,该金属互化物的密度ρ==g÷(a×10-10cm)3= g·cm-3。
答案:
(1)Cu失去第一个电子变为Cu+后,核外电子排布为[Ar]3d10,是能量较低的稳定结构,所以铜的第二电离能较大
(2)Al>Mg>Na 离子半径:Na+>Mg2+>Al3+,而电荷数:Na+”“<”或“=”)NiO,原因是
________________________________________________________________________
________________________________________________________________________。
(2)航母螺旋桨主要用铜合金制造。含铜废液可以利用铜萃取剂M,通过如下反应实现铜离子的富集,进行回收。
①M所含元素的电负性由大到小的顺序为________(用元素符号表示)。
②上述反应中断裂和生成的化学键有________(填序号)。
A.共价键 B.配位键
C.金属键 D.范德华力
(3)航母舰艇底部涂有含Cu2O的防腐蚀涂料。已知Cu2O的晶胞结构如图所示。
①该晶胞结构中铜原子的配位数是________。
②已知该晶体的密度为d g·cm-3,阿伏加德罗常数的值为NA,则该立方晶胞的参数是________ pm。
解析:
(1)①硅原子最外层有4个电子,价层电子数为3s23p2,其价层电子的轨道表示式为
②Fe3+的价电子排布式为3d5,处于半充满状态,而Fe2+的价电子排布式为3d6,故Fe3+比Fe2+稳定。③两离子晶体的阴离子均为O2-,阳离子所带电荷相同,但离子半径r(Fe2+)>r(Ni2+),故FeO的晶格能较小,熔点较低。
(2)①M中含有C、H、O、N四种元素,元素的非金属性越强,对应的电负性越大,即电负性:O>N>C>H。②反应过程中断裂和生成的化学键有共价键和配位键。
(3)①由题图可知,该晶胞中黑球为Cu,白球为O,晶胞中与Cu等距离且最近的O有2个,即该晶胞中Cu原子的配位数为2。②由均摊法可知该晶胞内含4个Cu原子,O原子数目为1+8×1/8=2,即晶胞内含Cu2O数目为2,设该立方晶胞的参数为x,则x3·d g·cm-3=×144 g,解得x= cm= ×1010 pm。
答案:
(1)①
②Fe3+的价电子排布式为3d5,处于半充满状态,结构稳定 ③< FeO和NiO的阴离子相同,阳离子所带电荷相同,但r(Fe2+)>r(Ni2+),所以FeO的晶格能较小,熔点较低
(2)①O>N>C>H ②AB (3)①2 ② ×1010