- 124.00 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
九台区师范、实验高中2018-2019学年度第一学期期中考试
高二化学试题
可能用到的原子量:H-1 Na-23 O-16
说明:本试题答题时间90分钟,满分100分。
第Ⅰ卷(选择题,共60分)
一、选择题(每小题3分,共60分。每小题只有一个选项符合题意)。
1.室温下,柠檬水溶液的pH是3,其中的c(OH-)是( )
A.0.1mol/L B.1×10-3 mol/L C.1×10-7 mol/L D.1×10-11 mol/L
2.某反应的反应过程中能量变化如图 所示(图中E1 表示正反应的活化能,E2 表示逆反应的活化能)。下列有关叙述正确的是( )
A.该反应为放热反应
B.催化剂能改变该反应的焓变
C.催化剂能降低该反应的活化能
D.逆反应的活化能大于正反应的活化能
3.甲溶液的pH是4,乙溶液的pH是5,甲溶液与乙溶液的c(H+)之比为( )
A. 10:1 B. 1:10 C. 2:1 D. 1:2
4.下列化学方程式中,属于水解反应的是( )
A.H2O+H2OH3O++OH- B.HCO3-+OH-H2O+CO32-
C.CO2+H2OH2CO3 D.CO32-+H2OHCO3-+OH-
5.下列热化学方程式中,△H能正确表示物质的燃烧热的是( )
A. CO(g) +1/2O2(g) =CO2(g) △H=-283.0 kJ/mol
B. C(s) +1/2O2(g) =CO(g) △H=-110.5 kJ/mol
C. H2(g) +1/2O2(g)=H2O(g) △H=-241.8 kJ/mol
D. 2C8H18(l) +25O2(g)=16CO2(g)+18H2O(l) △H=-11036 kJ/mol
6.已知某溶液中仅存在OH-、 H+ 、NH4+、 CI- 四种离子,其浓度大小有如下关系,其中一定不正确的是 ( )
A. B.
C. D.
7.下表中物质的分类组合正确的是( )
选项
A
B
C
D
强电解质
NaCl
H2SO4
CaCO3
HNO3
弱电解质
HF
BaSO4
HClO
HI
非电解质
C2H5OH
CS2
Cl2
SO2
8.将4molA气体和2molB气体在2 L的容器中混合,并在一定条件下发生如下反应:
2A(g)+B(g) 2C(g)。若经2 s后测得C的浓度为0.6mol·L-1,现有下列几种说法:
①用物质A表示的反应的平均速率为0.3 mol·L-1·s-1 ;
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1;
③2s时物质A的转化率为30% ;
④2s时物质B的浓度为1.4mol·L-1。
其中正确的是( )
A. ①③ B.①④ C.②③ D.③④
9.下列事实不能证明甲酸(HCOOH,一元酸)为弱酸的是( )
A. 0.1mol/L甲酸的pH为2.3
B. 将pH=2的甲酸稀释100倍后,溶液的pH小于4
C. 温度升高,溶液的导电能力增强
D. 等体积等浓度的甲酸和HCl与足量的锌反应,产生等量的氢气
10.对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是( )
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)=3v正(H2O)
11.在密闭容器中,一定条件下进行如下反应:NO(g)+CO(g)1/2N2(g)+CO2 (g)△H=-373.2KJ/mol,平衡后,为提高NO的转化率和该反应的速率,可采取的措施是( )
A.加催化剂同时升高温度 B.加催化剂同时增大压强
C.升高温度同时充入N2 D.降低温度同时增大压强
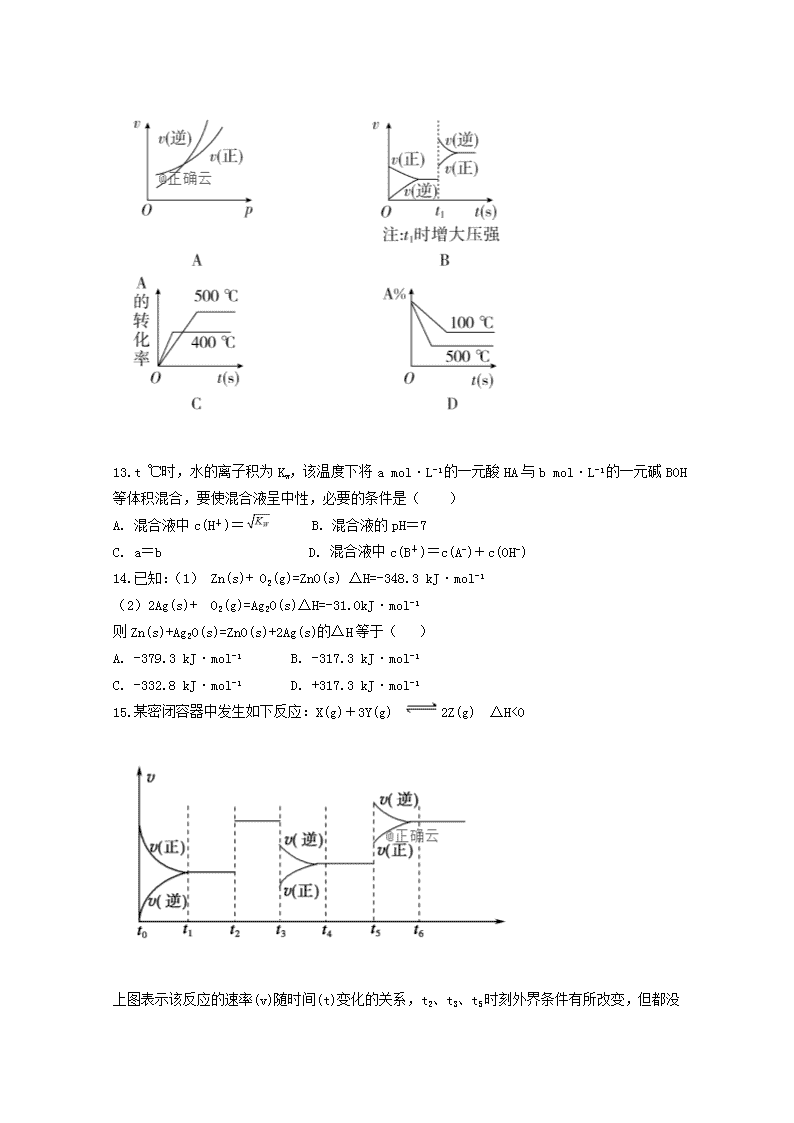
12.对于可逆反应A(g)+2B(g)2C(g)(正反应吸热),下列图象正确的是( )
13.t ℃时,水的离子积为Kw,该温度下将a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,要使混合液呈中性,必要的条件是( )
A. 混合液中c(H+)= B. 混合液的pH=7
C. a=b D. 混合液中c(B+)=c(A-)+c(OH-)
14.已知:(1) Zn(s)+ O2(g)=ZnO(s) △H=-348.3 kJ·mol-1
(2)2Ag(s)+ O2(g)=Ag2O(s)△H=-31.0kJ·mol-1
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H等于( )
A. -379.3 kJ·mol-1 B. -317.3 kJ·mol-1
C. -332.8 kJ·mol-1 D. +317.3 kJ·mol-1
15.某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g) ΔH<0
上图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5
时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
A.t2时加入了催化剂 B.t3时降低了温度
C.t5时增大了压强 D.t4~t5时间内转化率最低
16.一定温度下,在密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如表所示,下列说法
不正确的是( )
物质
X
Y
Z
W
初始浓度/mol·L-1
0.5
0.5
0
0
平衡浓度/mol·L-1
0.1
0.1
0.4
0.4
A.反应达到平衡时,X的体积分数为10%
B.该温度下反应的平衡常数K=16
C.保持温度不变增大压强,反应速率加快,平衡向正反应方向移动
D.若X、Y的初始浓度均为0.8 mol·L-1,则达到平衡时,W的浓度为0.64 mol·L-1
17.室温下,0.1 mol·L-1的HA溶液中c(H+)/c(OH-)=1010,下列有关说法中正确的是( )
A.溶液的pH=4
B.加蒸馏水稀释后,c(HA)/c(A-)减小
C.向体积和pH均相等的HA溶液与盐酸中加入足量锌,盐酸中产生的气体多
D.在NaA溶液中存在浓度关系:c(H+)>c(OH-)
18.某温度下,相同pH 值的盐酸和醋酸溶液分别加水稀释,平衡pH 值随溶液体积变化的曲线如图所示。据图判断正确的是( )
A. II 为盐酸稀释时pH 值变化曲线
B. b 点溶液的导电性比c 点溶液的导电性强
C. a 点Kw的数值比c点Kw的数值大
D. b点酸的总浓度大于a 点酸的总浓度
19.等体积等物质的量浓度的MOH强碱溶液和HA弱酸溶液混合后,混合溶液中有关离子浓度关系
正确的是( )
A. C(M+)>C(OH-)>C(A-)>C(H+) B. C(M+)>C(A-)>C(H+)>C(OH-)
C. C(M+)>C(A-)>C(OH-)>C(H+) D. C(M+)+ C(H+)>C(A-)+ C(OH-)
20.物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其中pH值依次为8、9、10
则HX、HY、HZ的酸性由强到弱的顺序是 ( )
A.HX、HZ、HY B.HZ、HY 、HX
C.HX、HY 、HZ D.HY 、HZ、HX
第Ⅱ卷(非选择题,每空2分,共40分)
二、非选择题
21.实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验。请你完成下列填空:
步骤一:配制250mL 0.10mol/L NaOH标准溶液。
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作3次,记录数据如下。
实验
编号
NaOH溶液的浓度
(mol/L)
滴定完成时,消耗NaOH溶液的体积(mL)
待测盐酸溶液的体积(mL)
1
0.10
20.02
20.00
2
0.10
20.00
20.00
3
0.10
19.98
20.00
(1)步骤一需要用托盘天平称量氢氧化钠固体的质量为__________g,配制标准溶液除用到玻璃棒和烧杯,还需要的玻璃仪器有________________。
(2)步骤二中量取20.00mL的稀盐酸用到的仪器是____________,判断滴定终点的现象是_______________________________________。
(3)根据上述数据,可计算出该盐酸的浓度为______________________。
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏高的有_______。
A. 配制标准溶液定容时,加水超过刻度
B. 锥形瓶水洗后直接装待测液
C. 酸式滴定管水洗后未用待测稀盐酸溶液润洗
D. 滴定到达终点时,仰视读出滴定管读数;
E. 碱式滴定管尖嘴部分有气泡,滴定后消失
22.已知A(g)+B(g)C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃
700
800
830
1 000
1 200
平衡常数
1.7
1.1
1.0
0.6
0.4
回答下列问题:
(1)该反应的平衡常数表达式K=________,ΔH=________(填“<”、“>”或“=”)0。
(2) 830 ℃时,向一个5 L的密闭容器中充入0.20 mol A和0.80 mol B,如反应初始6 s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。则6 s时c(A)=________mol·L-1
,C的物质的量为________mol;若反应经一段时间后,达到平衡时A的转化率为________,如果这时向该密闭容器中再充入1 mol 氩气,平衡时A的转化率为________。
(3)判断该反应是否达到平衡的依据为________。
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
(4)1 200 ℃时,反应C(g)+D(g)A(g)+B(g)的平衡常数的值为________。
23.Ⅰ.已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,回答下列问题:
(1)该溶液中c(H+)=___________。
(2)HA的电离平衡常数K=______________。
(3)由HA电离出的c(H+)约为水电离出的c(H+)的________倍。
Ⅱ.室温下,pH = 12的NaOH溶液100 mL ,欲使它的pH降为11。
(1)如果加入蒸馏水,就加入__________mL。
(2)如果加入pH = 10的NaOH溶液,应加入_________ mL。
(3)如果加入0.008 mol/L HCl溶液,应加入___________ mL。
高二化学期中试题参考答案
一.选择题:(每题3分,共60分)
1-----5 DCADA 6----10 AAADA
11---15 BDABA 16---20 CBBCC
二.非选择题:(每空2分,共40分)
21、(12分)
(1) 1.0 ; 250mL容量瓶,胶头滴管
(2) 酸式滴定管 ; 最后一滴NaOH溶液加入时,溶液颜色恰好由无色变为(浅)红色,且半分钟内不褪色
(3) 0.10mol/L
(4) ADE
22、(16分)
(1) c(C)c(D) ; <
c(A)c(B)
(2) 0.022 ; 0.09 ; 80% ; 80%
(3) c
(4) 2.5
23、(12分)
Ⅰ. (1) 1.0×10-4 mol/L ; 1×10-7 ; 106
Ⅱ. (1) 900 ; 1000 ; 100