- 524.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学平衡表格及图像题
一、单选题
1.在密闭容器中,反应X2(g)+Y2(g) 2XY(g) ΔH<0达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的图像分析正确的是( )
A. 图Ⅰ是加入适当催化剂的变化情况 B. 图Ⅲ是升高温度的变化情况
C. 图Ⅲ是增大压强的变化情况 D. 图Ⅱ是扩大容器体积的变化情况
2.汽车尾气净化的主要反应原理为2NO(g)+2CO(g)2CO2(g)+N2(g)。将1.0 mol NO、0.8 mol CO充入2 L恒容密闭容器,分别在T1℃和T2℃下测得n(CO2)随时间(t)的变化曲线如下图所示。下列说法正确的是
A. 该反应是吸热反应
B. T1℃时,K=0.9
C. T2℃时,0~2s内的平均反应速率v(N2)=0.075 mol/(L·s)
D. T1℃时,向平衡体系中加入1 mol NO,再次平衡时NO转化率大于40%
3.如图是可逆反应A+2B2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此推断错误的是
A. 正反应是放热反应
B. A、B一定都是气体
C. D一定不是气体
D. C可能是气体
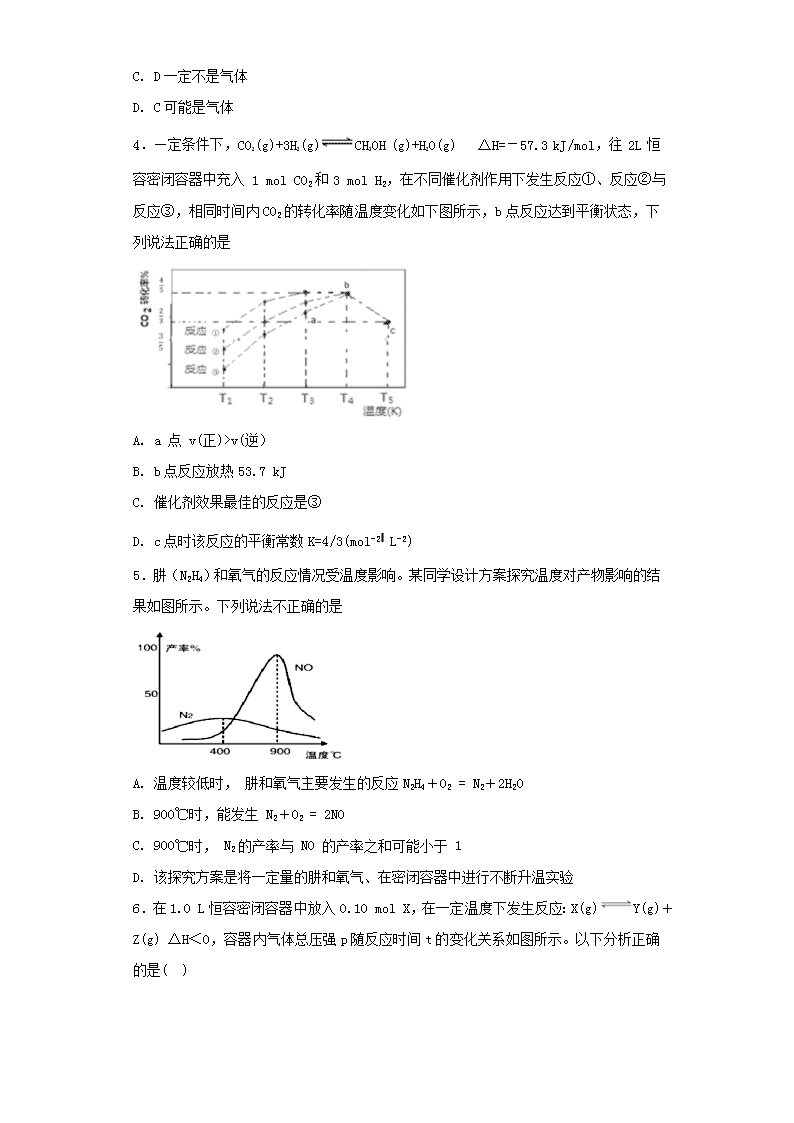
4.—定条件下,CO2(g)+3H2(g)CH3OH (g)+H2O(g) △H=-57.3 kJ/mol,往 2L 恒容密闭容器中充入 1 mol CO2和3 mol H2,在不同催化剂作用下发生反应①、反应②与反应③,相同时间内CO2的转化率随温度变化如下图所示,b点反应达到平衡状态,下列说法正确的是
A. a 点 v(正)>v(逆)
B. b点反应放热53.7 kJ
C. 催化剂效果最佳的反应是③
D. c点时该反应的平衡常数K=4/3(mol-2L-2)
5.肼(N2H4)和氧气的反应情况受温度影响。某同学设计方案探究温度对产物影响的结果如图所示。下列说法不正确的是
A. 温度较低时, 肼和氧气主要发生的反应N2H4+O2 = N2+2H2O
B. 900℃时,能发生 N2+O2 = 2NO
C. 900℃时, N2的产率与 NO 的产率之和可能小于 1
D. 该探究方案是将一定量的肼和氧气、在密闭容器中进行不断升温实验
6.在1.0 L恒容密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)Y(g)+Z(g) ΔH<0,容器内气体总压强p随反应时间t的变化关系如图所示。以下分析正确的是( )
A. 该温度下此反应的平衡常数K=3.2
B. 从反应开始到t1时的平均反应速率v(X)= mol·L-1·min-1
C. 欲提高平衡体系中Y的百分含量,可加入一定量的X
D. 其他条件不变,再充入0.1 mol气体X,平衡正向移动,X的转化率减少
7.在体积均为1.0L的两个恒容密闭容器中加入足量的相同质量的固体B,再分别加入0.1mol A和0.2molA,在不同温度下反应A(g) +B(s)2C(g)达到平衡,平衡时A的物质的量浓度c( A)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )
A. 反应 A(g)+ B(s)2C(g) △S>0、△H<0
B. A的转化率:a(状态Ⅱ)>a(状态Ⅲ)
C. 体系中c(C)∶c(C,状态Ⅱ)>(C,状态Ⅲ)
D. 化学平衡常数:K (状态Ⅰ) =K (状态Ⅲ)>K(状态Ⅱ)
8.如图是一定温度和压强下,反应aX+bYcZ的速率—时间图象,下列叙述正确的是
A. 该反应从正反应开始
B. a∶c=1∶2
C. 开始时,X的浓度为0,逆反应速率最小
D. 两条曲线相交的点P表示反应达到化学平衡
9.利用CO和H2在催化剂的作用下合成甲醇,发生如下反应:CO(g)+2H2(g)CH3OH(g)。在体积一定的密闭容器中按物质的量之比1∶2充入CO和H2
,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化情况如图1所示。现有两个体积相同的恒容密闭容器甲和乙,向甲中加入1mol CO和2 molH2,向乙中加入2 molCO和4molH2, 测得不同温度下CO的平衡转化率如图2所示。下列说法正确的是
A. 该反应的ΔH> 0; P1> P2 B. 反应速率B点高于D点
C. A、C两点的平衡常数相同 D. M、L两点中,CH3OH的体积分数相同,且p(M)= 2p(L)
10.向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl—,降低对电解的影响,反应原理如下:
Cu(s)+Cu2+(aq)2Cu+(aq) ΔH1=a kJ·mol-1
Cl—(aq)+Cu+(aq)CuCl(s) ΔH2=b kJ·mol-1
实验测得电解液pH对溶液中残留c(Cl—)的影响如图所示。下列说法正确的是
A. 溶液pH越大,Ksp(CuCl)增大
B. 向电解液中加入稀硫酸,有利于Cl-的去除
C. 反应达到平衡增大c(Cu2+),c(Cl—)减小
D. Cu(s)+ Cu2+(aq)+Cl—(aq)CuCl(s)的ΔH=(a+2b) kJ·mol-1
11.在恒容密闭容器中将CO2 与含少量CO的H2混合生成甲醇,反应为CO2(g)+3H2(g)CH3OH(g)+H2O(g)。下图中是按分别为①1: 4和②1: 6 两种投料比时,CO2的平衡转化率随温度变化的曲线。
下列有关说法正确的是
A. 按投料比①时,CO2的平衡转化率随温度变化的曲线对应的是图中的曲线I
B. 图中a点对应的H2的转化率等于30%
C. 图中b点对应的平衡常数K的值大于c点
D. 的数值,a点比c点小
12.汽车尾气中NO产生的反应为:N2(g)+O2(g)⇌2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.下列叙述正确的是
A. 温度T下,该反应的平衡常数
B. 温度T下,随着反应的进行,混合气体的密度减小
C. 曲线b对应的条件改变可能是加入了催化剂
D. 若曲线b对应的条件改变是温度,可判断该反应的△H<0
13.一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)CO(g)+3H2(g),设起始=Z,在恒压下,平衡时 (CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
A. 该反应的焓变ΔH>0
B. 图中Z的大小为a>3>b
C. 图中X点对应的平衡混合物中=3
D. 温度不变时,图中X点对应的平衡在加压后 (CH4)减小
14.温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应:2NO2(g)2NO(g)+O2(g)相关数据如下表所示。下列说法错误的是( )
容器
编号
物质的起始浓度
(mol·L-1)
物质的平衡浓度
(mol·L-1)
c(NO2)
c(NO)
c(O2)
c(O2)
Ⅰ
0.6
0
0
0.2
Ⅱ
0.3
0.5
0.2
Ⅲ
0
0.5
0.35
A. 容器Ⅰ中发生反应的平衡常数为0.8 B. 容器Ⅱ中发生反应的起始阶段有v正>v逆
C. 达到平衡时,容器Ⅲ中>1 D. 达到平衡时,容器Ⅰ与容器Ⅲ中的总压强之比为16∶17
15.一定温度下(T2>T1),在3个体积均为2.0L的恒容密闭容器中反应2NO(g)+Cl2(g)= 2ClNO(g) (正反应放热)达到平衡,下列说法正确的是
容器
温度/
(℃)
物质的起始浓度/mol·L-1
物质的平衡浓度/ mol·L-1
c(NO)
c(Cl2)
C(ClNO).v
C(ClNO)
Ⅰ
T1
0.20
0.10
0
0.04
Ⅱ
T2
.020
0.10
0.20
cl
Ⅲ
T3
0
0
0.20
C2
A. 达到平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为1:2
B. 达到平衡时,容器Ⅲ中ClNO的转化率小于80%
C. 达到平衡时,容器Ⅱ中c(ClNO)/C(NO)比容器Ⅰ中的大
D. 若温度为T1,起始时向同体积恒容密闭容器中充入0.20molNO(g).、0.2mo1Cl2(g)和0.20molClNO(g),则该反应向正反应方向进行
16.700℃时,H2(g)+CO2(g) H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示。其中甲经2min达平衡时,v (H2O)为0.025 mol/(L·min),下列判断不正确的是( )
起始浓度
甲
乙
丙
C(H2)/mol/L
0.1
0.2
0.2
C(CO2)/mol/L
0.1
0.1
0.2
A. 平衡时,乙中CO2的转化率大于50%
B. 当反应平衡时,丙中c(CO2)是甲中的2倍
C. 温度升至800℃,上述反应平衡常数为25/16,则正反应为吸热反应
D. 其他条件不变,若起始时向容器乙中充入0.10mol/L H2和0.20 mol/L CO2,到达平衡时c (CO)与乙不同
17.已知:N2(g)+3H2(g)2NH3(g)ΔH=-92.4kJ/mol起始反应物为N2和H2物质的量之比为1:3,且总物质的量不变,在不同压强和濫度下,反应达到平衡时体系中NH3的物质的量分数如下表:
温度
物质的量分数
压强
400℃
450℃
500℃
600℃
20MPa
0.387
0.274
0.189
0.088
30MPa
0.478
0.359
0.260
0.129
下列说法正确的是
A. 体系中NH3的物质的量分数越大,则正反应速率越大
B. 反应达到平衡时,N2和H2的转化率之比均为1
C. 反应达到平衡时,放出的热量均为92.4kJ
D. 600℃,30MPa下反应达到平衡时,生成NH3的物质的量最多
18.在1L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)M(g)+N(s),所得实验数据如下表,下列说法不正确的是
实验编号
温度/℃
起始时物质的量/mol
平衡时物质的量/mol
n(X)
n(Y)
n(M)
n(N)
①
800
0.10
0.40
0.080
0.080
②
800
0.20
0.80
a
a
③
900
0.10
0.15
0.06
0.06
下列说法不正确的是:
A. 正反应为放热反应
B. 实验①中,5min达平衡,用X表示的平均反应速率v(X)=0.016mol/(L•min)
C. 实验②中,该反应的平衡常数K=12.5
D. 实验②中,达到平衡时,a大于0.16
19.TK时,向2.0L恒容密闭容器中充入0.10molCOCl2,发生反应COCl2(g)Cl2(g)+CO(g)经过一段时间后反应达到平衡。反应过程中测得的部分数据见下表,下列说法正确的是:
t/s
0
2
4
6
8
n(Cl2)/mol
0
0.030
0.039
0.040
0.040
下列说法正确的是
A. TK时该反应的化学平衡常数为1/75
B. 反应在前2s的平均速度v(CO)=0.015mol·L-1·s-
C. 保持其他条件不变,升高温度,平衡时c(Cl2)=0.022 mol•L-1,则反应的△H<0
D. 平衡后向上还容器中再充入0.10molCOCl2,平衡正向移动,COCl2的转化率增大
二、多选题
20.一定温度下,在三个容积均为1.0L的恒容密闭容器中发生反应:
CH3OH(g)+CO(g) CH3COOH(g) △H<0。下列说法正确的是
容器编号
温度/K
物质的起始浓度/mol/L
物质的平衡浓度/mol/L
c(CH3OH)
c(CO)
c(CH3COOH)
c(CH3COOH)
I
530
0.50
0.50
0
0.40
II
530
0.20
0.20
0.40
III
510
0
0
0.50
A. 达平衡时,容器I与容器II中的总压强之比为3:4
B. 达平衡时,容器II中比容器I中的大
C. 达平衡时,容器Ⅲ中的正反应速率比容器I中的大
D. 达平衡时,容器I中CH3OH 转化率与容器III中CH3COOH 转化率之和小于1
21.Boderlscens研究反应:H2(g)+I2(g) 2HI(g) △H<0.温度T时,在两个体积均为1L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数ω(HI)与反应时间t的关系如下表:
研究发现上述反应中其中为常数。下列说法正确的是
A. 温度为T时该反应的
B. 容器I中前20 min的平均速率v(HI)=0.0125mol.L-1.min-1
C. 若起始时,向容器I中加入物质的量均为0.l mol的H2、I2、HI,反应逆向进行
D. 若两容器中 且 则x的值一定为1
22.一定温度下,在3个体积均为1.0L的恒容密闭容器中反应2SO2(g)+O2(g)2SO3(g)达到平衡。下列说法正确的是
容器
温度/K
物质的起始浓度/mol/L
物质的平衡浓度/mol/L
SO2或SO3平衡转化率
c(SO2)
c(O2)
c(SO3)
c(SO3)
I
723
0.2
0.1
0
0.16
a1
II
723
0.4
0.2
0
a2
III
823
0
0
0.2
a3
A. 达到平衡时,a1+a3>1
B. 达到平衡时,容器中的压强: PII>PI>PIII
C. 达到平衡时,容器III中的逆反应速率比容器I中的大
D. 若起始时,向容器I中充入0.16molSO2、0.04molO2和0.16molSO3,则此时反应向逆反应方向进行
23.一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g)N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如下图所示。下列说法正确的是
容器
温度/℃
起始物质的量/mol
NO (g)
CO (g)
甲
T1
0.20
0.20
乙
T1
0.30
0.30
丙
T2
0.20
0.20
A. 该反应的正反应为吸热反应
B. 达到平衡时,乙中CO2的体积分数比甲中的大
C. T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)<v(逆)
D. T2℃时,若起始时向丙中充入0.06mol N2和0.12 mol CO2,则达平衡时N2的转化率大于40%
24.温度为T时.向2.0 L恒容密闭容器中充入1.0 mol PCl5,发生反应PCl5 (g)PCl3(g)+Cl2(g),经过一段时间后达到平衡,反应过程中测定的部分数据列于下表。下列说法正确的是
t/s
0
50
150
250
350
n(PCl3)/mol
0
0.16
0.19
0.20
0.20
A. 在前50s,PCl3的平均反应速率 v(PCl3)=0.0032mol/(L·s)
B. 达到平衡时,容器中的压强是起始时的1.2倍
C. 相同温度下,起始时向容器中充入1.0mo PCl5、0.20 mo1 PCl3和0.20 mo1 Cl2,反应达到平衡前v(正)>v(逆)
D. 相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
25.在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应:X(g)+Y(g) 2Z(g) ΔH<0。一段时间后达到平衡,反应过程中测定的数据如下表:下列说法正确的是
t/min
2
4
7
9
n(Y)/mol
0.12
0.11
0.10
0.10
A. 反应前2 min的平均速率v(Z)=2.0×10-3 mol·L-1·min-1
B. 其他条件不变,降低温度,反应达到新平衡前:v(逆)>v(正)
C. 保持其他条件不变,起始时向容器中充入0.32 mol气体X和0.32 mol 气体Y,到达平衡时,n(Z)=0.24 mol
D. 该温度下此反应的平衡常数:K=1.44
26.在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2 mol A和1 mol B,发生反应:2A(g) + B(g)2D(g) △H=Q kJ·mol–1。相关条件和数据见下表:
实验编号
实验Ⅰ
实验Ⅱ
实验Ⅲ
反应温度/℃
700
700
750
达平衡时间/min
40
5
30
n(D)平衡/ mol
1.5
1.5
1
化学平衡常数
K1
K 2
K 3
下列说法正确的是
A. K 3>K 2=K 1
B. 实验Ⅱ可能使用了催化剂
C. 实验Ⅲ达平衡后容器内的压强是实验Ⅰ的倍
D. 实验Ⅲ达平衡后,恒温下再向容器中通入1 mol A和1 mol D,平衡不移动
三、综合题
27.甲烷、甲醇都是清洁能源。
(1)已知下列热化学方程式
①CO2(g)+3H2(g)=CH3OH(g) +H2O (g)△H= -49.0 kJ/mol
②CH4(g)+2O2(g)=2H2O(g) +CO2(g) △H= -802.3 kJ/mol
③2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ/mol
④H2O(g)=H2O(l) △H= -44.0 kJ-mol
则CH4(g)+1/2O2(g)=CH3OH(g) △H =____________。
(2)工业上合成甲醇的另一种方法是2H2(g)+CO(g) CH3OH(g) △H。
一定温度下在3个体积均为1.0 L的恒容密闭容器中发生上述反应,相关物理量见下表:
容器
温度/K
物质的起始浓度/mol•L-1
物质的平衡浓度/mol.L-1
c(H2)
c(CO)
c(CH3OH)
c(CH3OH)
I
400
0.20
0.10
0
0.080
II
400
0.40
0.20
0
III
500
0
0
0.10
0.025
①该反应的△H______0(填“>”或“<”)。
②达到平衡时,容器I中c(CH3OH)_____0.16mol/L(填“>” “<” 或“=”)。
③400 K 时该反应的平衡常数K=________。
(3)文献报道某课题组利用CO2催化缺化制甲烷的研究过程如下:
反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4。CH4、HCOOH、H2 的产量和镍粉用量的关系如下图所示(仪改变镍粉用量,其他条件不变)。研究人员根据实验结果得出结论:HCOOH 是CO2转化为CH4 的中间体,即:
①写出产生H2的反应方程式_________。
②由图可知,镍粉是_______(填字母)。
a.反应I的催化剂 b.反应II 的催化剂
c.反应I和II的催化剂 d.不是催化剂
③当镍粉用量从1mmol增加到10mmol,反应速率的变化情况是______(填字母)。
a.反应1的速率增加,反应II的速率不变
b.反应I的速率不变,反应II的速率增加
c.反应I、II的速率均不变
d.反应I、II的速率均增加,且反应I的速率增加得快
e.反应I、II的速率均增加,且反应II 的速率增加得快
f.反应I的速率减小,反应II的速率增加
28.氢在生活、生产、科研中发挥着重要的作用。
Ⅰ.工业上利用吸热反应C(s) +2H2O(g)CO2(g)+2H2(g)来制备氢气。一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应,相关数据如下表:
容器
容积/L
温度/L
起始量/mol
平衡量/mol
C(s)
H2O(g)
H2(g)
甲
2
T1
3
4
3.2
乙
1
T2
1.5
2
1.2
(l)T1_______T2 (填“>”、“ =”或“<”)。
(2)T1时达到平衡后再加入lmolH2O(g),达到新平衡后H2(g)的物质的量分数__________(填“增大”、“ 不变”或“减小”);T2时,若起始时乙容器中加入1.5molC(s)、1.2molH2O(g)、0.5molCO2(g)、1.4molH2(g),此时v(正)________v(逆)(填“大 于”、“ 等 于” 或“小于”)。
Ⅱ.CO(g)和H2(g)在一定条件下可合成甲醇:CO(g)+2H2(g)CH3OH(g) △H
(3)该反应能量变化曲线如图所示,下列叙述正确的是___________。
A.该反应的△H>0
B.该反应的活化能为419kJ
C.使用催化剂后反应速率加快,△H 不变
D.若改变条件使平衡向正反应方向移动,则CO 的转化率可能增大,可能不变,也可能减小
(4)反应分別在230℃、250℃、270℃进行时,CO的平衡转化率与的关系如图所示。
①230℃对应的曲线是_________________,依据是________________。
②向容积为1L的密闭容器中投入1nolCO、3molH2,在上述某温度下进行反应,平衡后测得=,则反应温度为_____________,平衡常数K=_________________。
29.镓是一种低熔点高沸点的稀有金属,有“电子工业脊梁”的美誉,被广泛应用到光电子工业和微波通信工业;镓(Ga)与铝位于同一主族,金属镓的熔点是29.8℃,沸点是2403℃。
(1)工业上利用Ga(l)与NH3(g)在1000℃高温下合成半导体固体材料氮化镓(GaN),同时生成氢气,每生成lmol H2时放出10.3 kJ热量。写出该反应的热化学方程式__________________。
(2)在密闭容器中,充入一定量的Ga与NH3发生反应,实验测得反应平衡体系中NH3的体积分数与压强P和温度T的关系曲线如图1所示。
① 图1中A点和C点化学平衡常数的大小关系是:KA_____KC,(填“<”、“=”或“>”),理由是__________________________________________________。
② 该反应在T1和P6条件下至3min时达到平衡,此时改变条件并于D点处重新达到平衡,H2的浓度随反应时间的变化趋势如图2所示(3~4 min的浓度变化未表示出来),则改变的条件为__________(仅改变温度或压强中的一种)。
(3)若用压强平衡常数Kp表示,此时B点对应的Kp=__________(用含P6的式子表示)(Kp为压强平衡常数,用平衡分压代替平衡浓度计算,气体平衡分压=总压×气体体积分数)
(4)电解精炼法提纯镓的具体原理如下:以粗镓(含Zn、Fe、Cu杂质)为阳极,以高纯镓为阴极,以NaOH溶液为电解质。在电流作用下使粗镓溶解进入电解质溶液,并通过某种离子迁移技术到达阴极并在阴极放电析出高纯镓。
①已知离子氧化性顺序为:Zn2+<Ga3+<Fe2+<Cu2+。电解精炼镓时阳极泥的成分是_________。
②阳极溶解生成的Ga3+与NaOH溶液反应生成GaO2-,写出GaO2-在阴极放电的电极反应式是_____________。
参考答案
1.B
2.C
3.B
4.A
5.D
6.D
7.C
8.B
9.B
10.C
11.D
12.A
13.A
14.D
15.C
16.D
17.B
18.A
19.A
20.BD
21.AD
22.AC
23.BD
24.BC
25.CD
26.BD
27. -125.9kJ/mol < > 2.5×103( L/mol)2 3Fe+4H2O Fe3O4+4H2 c e
28. > 减小 小于 CD X
对于放热反应,其它条件不变时,温度越低反应物的转化率越高 250℃ 5.625
39. 2Ga(l)+2NH3(g)=2GaN(s)+3H2(g) ΔH=-30.9 kJ·mol-1 < 由第1问可知该反应为放热反应,其他条件一定时,温度升高, 平衡逆向移动,此时NH3的体积分数越大而K值减小 减小压强 Fe、Cu GaO2- + 3e- + 2H2O = Ga+4OH-