- 819.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题13 元素及其化合物知识的综合应用
2020年高考真题
1.(2020年新课标Ⅱ)化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
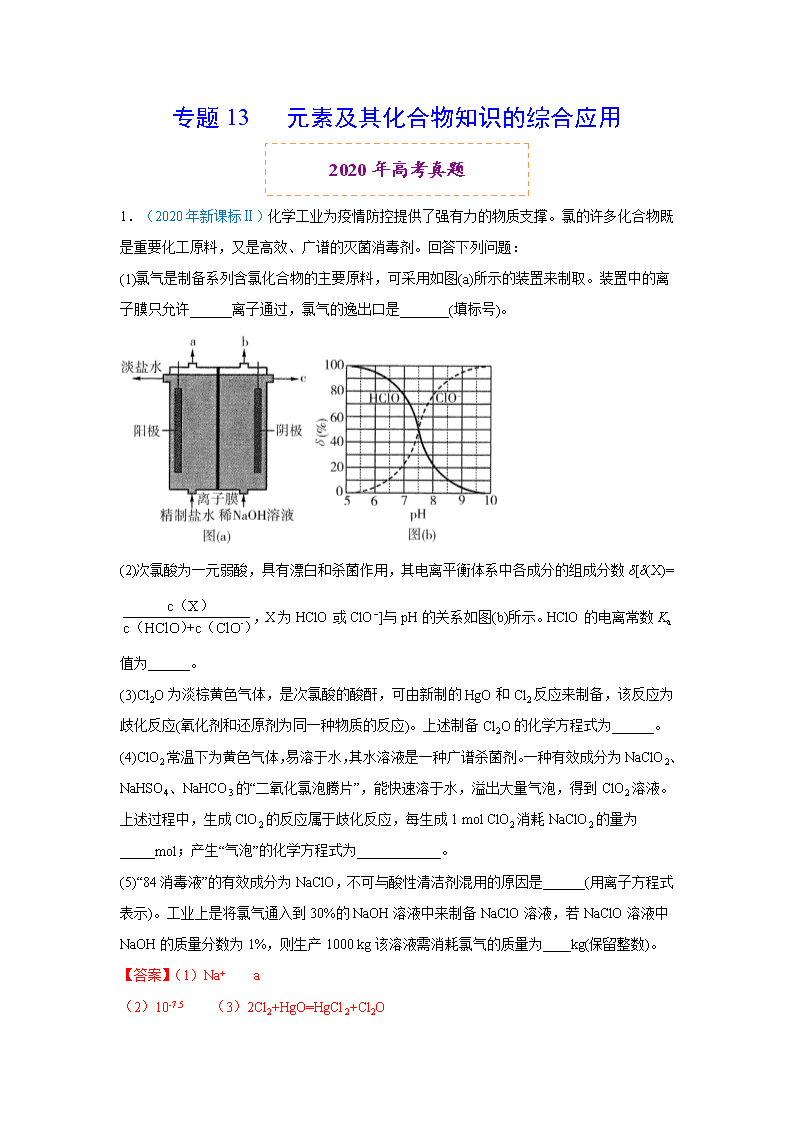
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许______离子通过,氯气的逸出口是_______(填标号)。
(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)=,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为______。
(3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为______。
(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为_____mol;产生“气泡”的化学方程式为____________。
(5)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是______(用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000 kg该溶液需消耗氯气的质量为____kg(保留整数)。
【答案】(1)Na+ a
(2)10-7.5 (3)2Cl2+HgO=HgCl2+Cl2O
(4)1.25 NaHCO3+NaHSO4=CO2↑+Na2SO4+H2O
(5)ClO-+Cl-+2H+=Cl2↑+ H2O 203
【解析】
【分析】(1)电解饱和食盐水,阳极产生氯气,阳离子移向阴极室;
(2)由图pH=7.5时,c(HClO)=c(ClO-),HClO的Ka==c(H+);
(3)Cl2歧化为Cl2O和Cl-;
(4)根据5ClO2-+4H+=4ClO2+Cl-+2H2O,计算每生成1molClO2,消耗的NaClO2;碳酸氢钠和硫酸氢钠反应生成硫酸钠、水和二氧化碳;
(5)“84”中的NaClO、NaCl和酸性清洁剂混合后发生归中反应;根据NaOH质量守恒计算;
【详解】(1)电解饱和食盐水,反应的化学方程式为2NaCl+2H2O 2NaOH+Cl2↑+H2↑,阳极氯离子失电子发生氧化反应生成氯气,氯气从a口逸出,阴极氢离子得到电子发生还原反应生成氢气,产生OH-与通过离子膜的Na+在阴极室形成NaOH,故答案为:Na+;a;
(2)由图pH=7.5时,c(HClO)=c(ClO-),HClO的Ka==c(H+)=10-7.5;故答案为:10-7.5;
(3)Cl2歧化为Cl2O和Cl-,HgO和氯气反应的方程式为:2Cl2+HgO=HgCl2+Cl2O,故答案为:2Cl2+HgO=HgCl2+Cl2O;
(4)5ClO2-+4H+=4ClO2+Cl-+2H2O,每生成1molClO2,消耗NaClO2为 =1.25mol;碳酸氢钠和硫酸氢钠反应生成硫酸钠、水和二氧化碳,方程式为:NaHCO3+NaHSO4=Na2SO4+H2O+CO2↑,故答案为:1.25mol;NaHCO3+NaHSO4=Na2SO4+H2O+CO2↑;
(5)“84”中的NaClO、NaCl和酸性清洁剂混合后发生归中反应,离子方程式为:ClO-+Cl-+2H+=Cl2↑+H2O;设氯气为xkg,则消耗的NaOH为kg,原氢氧化钠质量为+1000Kg×0.01,由NaOH质量守恒:原溶液为1000Kg-x,则Kg+1000Kg×0. 01=(1000Kg-x)×0.3,解得x=203Kg;故答案为:ClO-+Cl-+2H+=Cl2↑+H2O;203。
2.(2020年江苏卷)实验室由炼钢污泥(简称铁泥,主要成份为铁的氧化物)制备软磁性材料α-Fe2O3。
其主要实验流程如下:
(1)酸浸:用一定浓度的H2SO4溶液浸取铁泥中的铁元素。若其他条件不变,实验中采取下列措施能提高铁元素浸出率的有___________(填序号)。
A.适当升高酸浸温度
B.适当加快搅拌速度
C.适当缩短酸浸时间
(2)还原:向“酸浸”后的滤液中加入过量铁粉,使Fe3+完全转化为Fe2+。“还原”过程中除生成Fe2+外,还会生成___________(填化学式);检验Fe3+是否还原完全的实验操作是______________。
(3)除杂:向“还原”后的滤液中加入NH4F溶液,使Ca2+转化为CaF2沉淀除去。若溶液的pH偏低、将会导致CaF2沉淀不完全,其原因是___________[,]。
(4)沉铁:将提纯后的FeSO4溶液与氨水-NH4HCO3混合溶液反应,生成FeCO3沉淀。
①生成FeCO3沉淀的离子方程式为____________。
②设计以FeSO4溶液、氨水- NH4HCO3混合溶液为原料,制备FeCO3的实验方案:__。
(FeCO3沉淀需“洗涤完全”,Fe(OH)2开始沉淀的pH=6.5)。
【答案】(1)AB
(2)H2 取少量清液,向其中滴加几滴KSCN溶液,观察溶液颜色是否呈血红色
(3)pH偏低形成HF,导致溶液中F-浓度减小,CaF2沉淀不完全
(4)①或 ②在搅拌下向FeSO4溶液中缓慢加入氨水-NH4HCO3混合溶液,控制溶液pH不大于6.5;静置后过滤,所得沉淀用蒸馏水洗涤2~3次;取最后一次洗涤后的滤液,滴加盐酸酸化的BaCl2溶液,不出现白色沉淀
【解析】
【分析】铁泥的主要成份为铁的氧化物,铁泥用H2SO4溶液“酸浸”得到相应硫酸盐溶液,向“酸浸”后的滤液中加入过量铁粉将Fe3+还原为Fe2+;向“还原”后的滤液中加入NH4F使Ca2+转化为CaF2沉淀而除去;然后进行“沉铁”生成FeCO3,将FeCO3沉淀经过系列操作制得α—Fe2O3;据此分析作答。
【详解】(1)A.适当升高酸浸温度,加快酸浸速率,能提高铁元素的浸出率,A选;
B.适当加快搅拌速率,增大铁泥与硫酸溶液的接触,加快酸浸速率,能提高铁元素的浸出率,B选;
C.适当缩短酸浸时间,铁元素的浸出率会降低,C不选;
答案选AB。
(2)为了提高铁元素的浸出率,“酸浸”过程中硫酸溶液要适当过量,故向“酸浸”后的滤液中加入过量的铁粉发生的反应有:Fe+2Fe3+=3Fe2+、Fe+2H+=Fe2++H2↑,“还原”过程中除生成Fe2+外,还有H2生成;通常用KSCN溶液检验Fe3+,故检验Fe3+是否还原完全的实验操作是:取少量清液,向其中滴加几滴KSCN溶液,观察溶液颜色是否呈血红色,若不呈血红色,则Fe3+还原完全,若溶液呈血红色,则Fe3+没有还原完全,故答案为:H2,取少量清液,向其中滴加几滴KSCN溶液,观察溶液颜色是否呈血红色。
(3)向“还原”后的滤液中加入NH4F溶液,使Ca2+转化为CaF2沉淀,Ksp(CaF2)=c(Ca2+)·c2(F-),当Ca2+完全沉淀(某离子浓度小于1×10-5mol/L表明该离子沉淀完全)时,溶液中c(F-)至少为mol/L=×10-2mol/L;若溶液的pH偏低,即溶液中H+浓度较大,H+与F-形成弱酸HF,导致溶液中c(F-)减小,CaF2沉淀不完全,故答案为:pH偏低形成HF,导致溶液中F-浓度减小,CaF2沉淀不完全。
(4)①将提纯后的FeSO4溶液与氨水—NH4HCO3混合溶液反应生成FeCO3沉淀,生成FeCO3的化学方程式为FeSO4+NH3·H2O+NH4HCO3=FeCO3↓+(NH4)2SO4+H2O[或FeSO4+NH3+NH4HCO3=FeCO3↓+(NH4)2SO4],离子方程式为Fe2+++NH3·H2O=FeCO3↓++H2O(或Fe2+++NH3=FeCO3↓+),答案为:Fe2+++NH3·H2O=FeCO3↓++H2O(或Fe2+++NH3=FeCO3↓+)。
②根据题意Fe(OH)2开始沉淀的pH=6.5,为防止产生Fe(OH)2沉淀,所以将FeSO4溶液与氨水—NH4HCO3混合溶液反应制备FeCO3沉淀的过程中要控制溶液的pH不大于6.5;FeCO3沉淀需“洗涤完全”,所以设计的实验方案中要用盐酸酸化的BaCl2溶液检验最后的洗涤液中不含 ;则设计的实验方案为:在搅拌下向FeSO4溶液中缓慢加入氨水—NH4HCO3混合溶液,控制溶液pH不大于6.5;静置后过滤,所得沉淀用蒸馏水洗涤2~3次;取最后一次洗涤后的滤液,滴加盐酸酸化的BaCl2
溶液,不出现白色沉淀,故答案为:在搅拌下向FeSO4溶液中缓慢加入氨水—NH4HCO3混合溶液,控制溶液pH不大于6.5;静置后过滤,所得沉淀用蒸馏水洗涤2~3次;取最后一次洗涤后的滤液,滴加盐酸酸化的BaCl2溶液,不出现白色沉淀。
3.(2020年江苏卷)次氯酸钠溶液和二氯异氰尿酸钠(C3N3O3Cl2Na)都是常用的杀菌消毒剂。 NaClO可用于制备二氯异氰尿酸钠.
(1)NaClO溶液可由低温下将Cl2缓慢通入NaOH溶液中而制得。制备 NaClO的离子方程式为__________;用于环境杀菌消毒的NaClO溶液须稀释并及时使用,若在空气中暴露时间过长且见光,将会导致消毒作用减弱,其原因是__________________。
(2)二氯异氰尿酸钠优质品要求有效氯大于60%。通过下列实验检测二氯异氰尿酸钠样品是否达到优质品标准。实验检测原理为
准确称取1.1200g样品,用容量瓶配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液20.00mL。
①通过计算判断该样品是否为优质品_______。(写出计算过程, )
②若在检测中加入稀硫酸的量过少,将导致样品的有效氯测定值____________(填“偏高”或“偏低”)。
【答案】(1) NaClO溶液吸收空气中的CO2后产生HClO,HClO见光分解
(2)①
根据物质转换和电子得失守恒关系:
得
氯元素的质量:
该样品的有效氯为:
该样品的有效氯大于60%,故该样品为优质品
②偏低
【解析】(1)由题意可知,氯气通入氢氧化钠中产生次氯酸钠,同时产生氯化钠,反应的离子方程式为:;次氯酸钠溶液长期暴露在空气中会吸收空气中的二氧化碳气体,因次氯酸酸性比碳酸弱,因此次氯酸钠可以与二氧化碳在水中反应产生HClO,HClO具有不稳定性,在受热或见光条件下会发生分解反应,产生HCl和O2,从而是次氯酸钠失效;
(2)①由题中反应可知,在酸性条件产生HClO,HClO氧化碘离子产生碘单质,碘单质再用硫代硫酸钠滴定,结合反应转化确定物质之间的关系为:, ,根据物质转换和电子得失守恒关系:得n(Cl)=0.5=,
氯元素的质量:m(Cl)= =0.03550g,该样品中的有效氯为: =63.39%,
该样品中的有效氯大于60%,故该样品为优质品。
②如果硫酸的用量过少,则导致反应不能充分进行,产生的HClO的量偏低,最终导致实验测得的有效氯含量会偏低。
4.(2020年7月浙江选考)Ⅰ.化合物Ⅹ由四种短周期元素组成,加热X,可产生使湿润的红色石蕊试纸变蓝的气体Y,Y为纯净物;取,用含的盐酸完全溶解得溶液A,将溶液A分成和两等份,完成如下实验(白色沉淀C可溶于溶液):
请回答:
(1)组成X的四种元素是N、H和_______(填元素符号),X的化学式是_________。
(2)溶液B通入过量得到白色沉淀C的离子方程式是______________。
(3)写出一个化合反应(用化学方程式或离子方程式表示)_____________。要求同时满足:
①其中一种反应物的组成元素必须是X中除N、H外的两种元素;
②反应原理与“”相同。
Ⅱ.某兴趣小组为验证浓硫酸的性质进行实验,如图。实验中观察到的现象有:锥形瓶内有白雾,烧杯中出现白色沉淀。请回答:
(1)将浓硫酸和浓盐酸混合可产生气体的原因是________。
(2)烧杯中出现白色沉淀的原因是_____________。
【答案】Ⅰ.(1)
(2)
(3)或
Ⅱ.(1)吸收浓盐酸中的水分且放热导致挥发
(2)气体会将带出,与作用生成
【解析】
【分析】根据题干可知,加热X可产生能使湿润的红色石蕊试纸变蓝的纯净物气体Y,故Y为NH3,由实验流程图中分析可知,结合B中通入过量的CO2产生能溶于NaOH溶液的白色沉淀C,故C为Al(OH)3,则D为Al2O3,E是AgCl,结合图中数据利用原子守恒,可以计算出各自元素的物质的量,求出X的化学式,再根据物质性质进行解答。
【详解】Ⅰ.(1)由分析可知,Y为NH3,由实验流程图中分析可知,结合B中通入过量的CO2产生能溶于NaOH溶液的白色沉淀C,故C为Al(OH)3,则D为Al2O3,E是AgCl,利用原子守恒可知:A1溶液中含有N原子的物质的量为:,Al原子的物质的量为:,A2溶液中含有的Cl-的物质的量为: ;
故一半溶液中含有的H原子的物质的量为:,故X中含有四种元素即N、H、Al、Cl,其个数比为:,故X的化学式为:AlCl3NH3;
(2)根据分析(1)可知,溶液B中通入过量的CO2所发生的离子方程式为:;
(3)结合题给的两个条件,再分析化合物X(AlCl3NH3)是NH3和AlCl3通过配位键结合成的化合物,不难想到类似于NH3和H2O反应,故可以很快得出该反应的离子方程式为AlCl3+Cl-= 或者AlCl3+NH3=AlCl3NH3;
Ⅱ.(1)由于浓硫酸具有吸水性且浓硫酸稀释是个放热过程,而且HCl的挥发性随浓度增大而增大,随温度升高而增大,从而得出用浓硫酸和浓盐酸混合制备HCl的原理是浓硫酸吸收浓盐酸中的水分且放热,使浓盐酸的挥发性增强,使HCl挥发出来;
(2)浓硫酸虽然难挥发,但也会随HCl气流而带出少量的H2SO4分子,与Ba(NO3)2反应生成硫酸钡白色沉淀。
2020届高考模拟试题
5.(北京市海淀区2020届高三二模)
金属铬常用于提升特种合金的性能。工业上以铬铁矿(主要成份为FeO·Cr2O3,含有少量Al2O3)为原料制备金属铬的流程如下图。下列说法不正确的是( )
A.①中需持续吹入空气作氧化剂 B.②中需加入过量稀硫酸
C.③中发生了置换反应 D.溶液A为橙色
【答案】B
【解析】A.在铬铁矿中Cr元素化合价为+3价,反应后变为Na2CrO4中的+6价,化合价升高,被氧化,因此①中需持续吹入空气作氧化剂,A正确;B.Al(OH)3是两性氢氧化物,能够与硫酸发生反应产生可溶性Al2(SO4)3,因此②中加入的稀硫酸不能过量,B错误;C.Cr2O3与Al在高温下反应产生Cr和Al2O3,反应物是单质和化合物,生成物也是单质与化合物,因此③中反应类型为置换反应,C正确;D.Na2CrO4在酸性溶液中发生反应: 2CrO42-+2H+Cr2O72-+H2O,反应产生Cr2O72-使溶液显橙色,D正确;故合理选项是B。
6.(2020年6月福建省普通高中学业水平合格性考试)某化学兴趣小组为制取NH3并探究其性质,按下图装置进行实验。(制取氨气的反应原理:2NH4Cl+Ca(OH)2CaCl2+2NH3+2H2O,部分夹持仪器已略去)
(实验探究)(1)装置(I)中仪器a的名称是_____。
(2)装置(Ⅱ)中可用_________(填“碱石灰”或“食盐”)作干燥剂。
(3)实验进行一段时间后,装置(Ⅲ)中干燥的红色石蕊试纸不变色,然后滴加水,观察到试纸颜色变为___(填“白色”或“蓝色”)原因是氨水呈____(填“碱性”或“酸性”)。
(4)装置(Ⅲ)中胶头滴管若改装浓盐酸,实验进行一段时间后,滴加浓盐酸,观察到瓶内充满_______(填“白烟”或“白雾”),写出NH3与HCl反应生成NH4Cl的化学方程式:_________。
(5)装置(IV)中稀硫酸的作用是___________。
(6)用0.1 mol NH4Cl与足量Ca(OH)2反应,理论上可生成NH3的物质的量是____mol。
(实验拓展)(7)已知:2NH3+3CuO3Cu+N2+3H2O,若把装置(Ⅲ)换为如图装置,当实验进行一段时间后,观察到黑色固体变为____(填“白色”或“红色”),在这过程中NH3表现出__(填“还原性”或“氧化性”)。
(知识应用)(8)氨气是一种重要的化工原料。写出它的一种用途:__________。
【答案】(1)酒精灯 (2)碱石灰 (3)蓝色 碱性
(4)白烟 NH3 + HCl= NH4Cl
(5)吸收多余的氨气
(6)0.1 (7)红色 还原性 (8)制化肥
【解析】(1)装置(I)中根据仪器a的构造可知为酒精灯。
(2)装置(Ⅱ)中的目的是干燥氨气,食盐不具有吸水性不可用,碱石灰为固体氢氧化钠和生石灰的混合物,具有很好的吸水性,可用于干燥氨气。
(3)实验进行一段时间后,装置(Ⅲ)中干燥的红色石蕊试纸不变色,然后滴加水,因氨气可与水反应产生一水合氨,一水合氨为弱碱电离产生氢氧根离子显碱性,红色石蕊试纸遇碱会变蓝色。
(4)装置(Ⅲ)中胶头滴管若改装浓盐酸,实验进行一段时间后,滴加浓盐酸,氯化氢与氨气反应产生固体氯化铵,在试剂瓶中可以看到白烟,相应的反应为:NH3+HCl=NH4Cl。
(5)氨气是有毒气体挥发到空气中污染环境,因此装置(IV)中稀硫酸的作用是吸收多余的氨气,防止污染空气。
(6)用0.1 mol NH4Cl与足量Ca(OH)2反应,根据元素守恒可知,理论上可生成NH3的物质的量是0.1mol。
(7)2NH3+3CuO3Cu+N2+3H2O,把装置(Ⅲ)换为如图装置,当实验进行一段时间后,观察到黑色的氧化铜固体变为红色铜单质,在这过程中NH3转变成N2
化合价升高被氧化,表现出还原性。
(8)氨气是一种重要的化工原料,可跟酸反应产生铵盐做氮肥使用。
7.(安徽省六安市第一中学2020届高三下学期第八次模拟)工业上以铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)为原料制取铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示:
请回答下列问题:
(1)试剂I为___;试剂Ⅱ为___;滤渣a的化学式为___。
(2)证明铁元素已全部转化为滤渣b的实验方法是___。
(3)滤液Ⅱ中通入足量CO2进行酸化,从而得到固体c,若用盐酸进行酸化是否可以?___,请说明理由:___。
(4)由固体d制取铵明矾溶液的化学方程式为___,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)蒸发浓缩、冷却结晶、___。
(5)NH4Al(SO4)2溶液呈___(“酸性”、“碱性”或“中性”),原因是___(用离子方程式表示)。
(6)若NH4Al(SO4)2溶液、NH4HCO3溶液和NH4Cl溶液中的NH4+的物质的量浓度相等,则三种铵盐溶液的浓度从小到大的顺序为___。
【答案】(1)盐酸(或稀硫酸等) NaOH溶液(或KOH溶液等) SiO2
(2)取少量滤液Ⅱ于小试管中,向小试管中滴加KSCN溶液,若溶液不变红,说明Fe3+已全部转化为红褐色滤渣b
(3)不可以 通入足量CO2进行酸化的目的是使滤液Ⅱ中的AlO2-转化为Al(OH)3,而Al(OH)3能溶于盐酸,不易控制加入盐酸的量,故不能用盐酸进行酸化
(4)Al2O3+4H2SO4+2NH3=2NH4Al(SO4)2+3H2O 过滤洗涤干燥
(5)酸性 NH4++H2ONH3·H2O+H+,Al3++3H2OAl(OH)3+3H+
(6)c[NH4Al(SO4)2]<c(NH4Cl)<c(NH4HCO3)
【解析】
【分析】根据铝土矿的成分,Al2O3为两性氧化物,Fe2O3属于碱性氧化物,SiO2属于酸性氧化物,SiO2不与盐酸或稀硫酸等酸反应,结合图中转化关系可知,红褐色滤渣b为Fe(OH)3
,则试剂Ⅱ为NaOH溶液或KOH溶液等强碱溶液均可;进而推知滤渣a和试剂I。据此解答。
【详解】(1)由图中转化关系可知,红褐色滤渣b为Fe(OH)3,则试剂Ⅱ为NaOH溶液或KOH溶液等强碱溶液均可;进而推知滤渣a为SiO2,试剂I为盐酸或稀硫酸。答案为:盐酸(或稀硫酸等);NaOH溶液(或KOH溶液等);SiO2;
(2)可通过检验滤液Ⅱ中是否还含有Fe3+,来证明Fe3+是否已全部转化为Fe(OH)3,具体方法为:取少量滤液Ⅱ于小试管中,向小试管中滴加KSCN溶液,若溶液不变红,说明Fe3+已全部转化为红褐色滤渣b。答案为:取少量滤液Ⅱ于小试管中,向小试管中滴加KSCN溶液,若溶液不变红,说明Fe3+已全部转化为红褐色滤渣b;
(3)由上面的分析可知,滤液Ⅱ中含有AlO2-,通入足量CO2进行酸化,AlO2-可转化为Al(OH)3,CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-,若改用盐酸进行酸化,反应过程中生成的Al(OH)3会溶于盐酸,不易控制加入盐酸的量,故不能用盐酸进行酸化。答案为:不可以;通入足量CO2进行酸化的目的是使滤液Ⅱ中的AlO2- 转化为Al(OH)3,而Al(OH)3能溶于盐酸,不易控制加入盐酸的量,故不能用盐酸进行酸化;
(4)根据流程图,固体c为Al(OH)3,固体d为Al2O3,固体d与稀硫酸、氨气反应生成铵明矾,化学反应方程式为:Al2O3+4H2SO4+2NH3=2NH4Al(SO4)2+3H2O。从铵明矾溶液中获得铵明矾晶体的操作依次为蒸发浓缩、冷却结晶、过滤、洗涤、干燥。答案为:Al2O3+4H2SO4+2NH3=2NH4Al(SO4)2+3H2O;过滤、洗涤、干燥;
(5)NH4Al(SO4)2溶液呈酸性,因为NH4+和Al3+均能水解使溶液呈酸性,NH4++H2ONH3·H2O+H+,Al3++3H2OAl(OH)3+3H+。答案为:酸性;NH4++H2ONH3·H2O+H+,Al3++3H2OAl(OH)3+3H+;
(6)NH4Al(SO4)2溶液中,Al3+水解产生的H+对NH4+的水解起抑制作用,使NH4+的水解程度减弱,溶液中NH4+的量较多,而NH4HCO3中,HCO3-的水解产生的OH-对NH4+的水解起促进作用,使NH4+的水解程度增大,溶液中NH4+的量较少,因此,若溶液中的NH4+的物质的量浓度相等,三种铵盐溶液的浓度从小到大的顺序为:c[NH4Al(SO4)2]<c(NH4Cl)<c(NH4HCO3)。答案为:c[NH4Al(SO4)2]<c(NH4Cl)<c(NH4HCO3)。
【点睛】判断几种物质的浓度关系时,我们可利用它们所含共同离子的浓度进行判断。一方面比较起始量,另一方面比较变化量,利用平衡量逆推物质的起始浓度。即变化量越大,平衡量越小,则所需起始量应越大。
8.(重庆市巴蜀中学2020届高考适应性月考一)铝(熔点660℃
)是一种应用广泛的金属,工业上用(熔点2045℃)和冰晶石()混合熔融后电解制得。请回答下列问题:
(1)铝属于活泼金属却能在空气中稳定存在,其原因是__________,冶金工业上常用金属铝作还原剂冶炼钒、铬、锰等金属,请写出铝与V2O5在高温下反应的化学方程式:___________。
(2)将液和溶液混合制取。该实验用于盛装NaF溶液的试剂瓶_________(填“能”或“不能”)用玻璃瓶,原因是_______。
(3)下列关于铝元素的叙述不正确的是__________(填序号)。
A.铝是人类最早使用的金属
B.镁铝合金既可完全溶于过量的盐酸,又可完全溶于过量的NaOH溶液
C.氢氧化铝是一种两性氢氧化物,既能溶于盐酸又能溶于NaOH溶液
D.铝是人体必需的微量元素之一,因此在生活中人们应尽量使用铝制炊具和餐具更有利于身体健康
(4)某工厂排放出有毒物质NOCl,它遇水就会生成。NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为_________,水源中的对人类健康会产生危害,为了降低水源中的浓度,有研究人员建议在碱性条件下用铝粉将还原为N2,此时铝主要以的形式存在于溶液中,请写出该反应的离子方程式:__________,当该反应转移5mol电子时,产生的在标况下的体积约为_______L。
【答案】(1)铝的表面可以形成一层致密的氧化铝薄膜,保护铝不被进一步氧化
(2)不能 会水解产生氢氟酸,氢氟酸会腐蚀玻璃
(3)ABD
(4) 11.2L
【解析】(1)铝的表面可以形成一层致密的氧化铝薄膜,保护铝不被进一步氧化,因此可以在空气中稳定存在,铝作还原剂冶炼金属,自身变成氧化铝,可以类比氧化铁的铝热反应:;
(2)根据“有弱就水解,越弱越水解”的规律,
会水解产生氢氟酸,氢氟酸本身会腐蚀玻璃,因此不能用玻璃瓶来盛放;
(3)A.尽管铝是地壳中含量最高的金属元素,但是提炼铝的方法是近两三个世纪才发现的,铝的大规模使用是上个世纪七十年代才开始的,A项错误;
B.铝和强酸强碱均能反应,但是镁只能和盐酸反应,不能和氢氧化钠溶液反应,因此镁不溶于烧碱溶液,B项错误;
C.是一种两性氢氧化物,既能溶于盐酸得到又能溶于烧碱得到,C项正确;
D.过多摄入对人体实际上是有害的,因此我们应减少铝制餐具的使用,并且在使用时避免接触强酸或强碱性的食品,D项错误;
答案选ABD;
(4)既然各原子均满足8电子稳定结构,氮要形成3个共价键,氧要形成2个共价键,氯只能形成1个共价键,不难发现应写成的形式,1个铝失3个电子,1个氮得5个电子,写出反应方程式:,根据方程式不难看出转移电子数与生成氮气数之比为10:1,故当转移5mol电子时生成0.5mol氮气,这些氮气在标况下的体积为。
9.(百校联考2020届高考考前冲刺必刷卷一)含硫化合物多为重要的化工原料。请回答下列问题:
I.多硫化物是含多硫离子(Sx2-)的化合物,可用作废水处理剂、硫化剂等。
(1)Na2S2的电子式为___。
(2)Na2S5(易溶于水)在酸性条件下可生成H2S和S,该反应的离子方程式为___。
(3)黄铁矿(FeS2)是工业上制硫酸的重要原料,在氧气中煅烧生成Fe2O3和SO2,其煅烧的化学方程式为___。
II.焦亚硫酸钠(Na2S2O5)是一种食品抗氧化剂,易溶于水。
(4)焦亚硫酸钠(Na2S2O5)中硫元素的化合价为___。
(5)向某些饮料中添加少量焦亚硫酸钠(Na2S2O5),可降低饮料中溶解氧的含量,发生反应的离子方程式为___。
(6)向饱和碳酸钠溶液中通入过量SO2可制得焦亚硫酸钠,发生反应的化学方程式为___。
III.硫代硫酸钠(Na2S2O3)是一种重要的滴定试剂,常用来滴定溶液中的含碘量。
(7)为测定某碘水中I2的浓度(假设碘水中的碘元素均以碘单质形式存在),取该碘水200.00mL,加入淀粉溶液作为指示剂,滴加0.01mol·L-1硫代硫酸钠标准液,发生反应:I2+2S2O32-=S4O62-+2I-,当___(填实验现象),即为终点。平行滴定3次,标准液的平均用量为20.00mL,则该碘水中I2的浓度为___mg·L-1。
【答案】(1) (2)S52−+2H+=H2S↑+4S↓
(3)4FeS2+11O22Fe2O3+8SO2 (4)+4
(5)S2O52−+O2+H2O=2SO42−+2H+ (6)Na2CO3+2SO2=Na2S2O5+CO2
(7)滴入最后一滴硫代硫酸钠标准液,溶液由蓝色变为无色,且30s内不再变蓝 127
【解析】
【分析】Ⅰ.(1)Na2S2 是离子化合物,是钠离子和过硫根离子构成;
(2)Na2S5(易溶于水)在酸性条件下可生成H2S和S;
(3)黄铁矿(FeS2)是工业上制硫酸的重要原料,在氧气中煅烧生成Fe2O3和SO2;
Ⅱ.(4)元素化合价倒数和为0计算得到元素的化合价;
(5)向某些饮料中添加少量焦亚硫酸钠(Na2S2O5),可降低饮料中溶解氧的含量,Na2S2O5被氧气氧化得到硫酸钠和硫酸;
(6)向饱和碳酸钠溶液中通入过量SO2可制得焦亚硫酸钠;
Ⅲ.取该碘水200.00mL,加入淀粉溶液作为指示剂,滴加0.01mol•L-1硫代硫酸钠标准液,发生反应:I2+2S2O32-=S4O62-+2I-,反应终点的现象是滴入最后一滴溶液,蓝色变为无色且半分钟不变,结合化学方程式定量关系计算。
【详解】Ⅰ.(1)Na2S2的电子式为;
(2)Na2S5(易溶于水)在酸性条件下可生成H2S和S,反应的离子方程式为S52−+2H+=H2S↑+4S↓;
(3)黄铁矿(FeS2)是工业上制硫酸的重要原料,在氧气中煅烧生成Fe2O3和SO2,反应的化学方程式:4FeS2+11O22Fe2O3+8SO2;
Ⅱ.(4)焦亚硫酸钠(Na2S2O5)中,钠元素化合价+1价,氧元素化合价−2价,化合价代数和为0计算得到硫元素的化合价为+4;
(5)向某些饮料中添加少量焦亚硫酸钠(Na2S2O5),可降低饮料中溶解氧的含量,Na2S2O5被氧气氧化得到硫酸钠和硫酸,反应的离子方程式:S2O52−+O2+H2O=2SO42−+2H+;
(6)向饱和碳酸钠溶液中通入过量SO2
可制得焦亚硫酸钠,反应的化学方程式:Na2CO3+2SO2=Na2S2O5+CO2;
Ⅲ.碘水加入淀粉变蓝色,当消耗完碘单质后溶液变为无色,滴定终点的现象是:当滴入最后一滴硫代硫酸钠标准液后,溶液由蓝色变为无色且半分钟不再变蓝说明反应达到终点,发生反应:I2+2S2O32−=S4O62−+2I−,2×c(I2) ×V(I2)=c(S2O32−)×V(S2O32−),c(I2)==0.0005mol/L,0.0005mol/L×127 g/mol×2×1000mg/g=127mg/L。
10.(福建省2020届高三化学总复习专题训练)化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等离不开化学。
(1)普通玻璃是常见的硅酸盐产品,其主要成分的化学式为Na2CaSi6O14,以氧化物形式可表示为______。
(2)缺铁性贫血患者补充的铁,通常为硫酸亚铁的形式,而硫酸铁则没有这种药效.当用硫酸亚铁制成药片时外表要包有一层特殊的糖衣,这层糖衣的作用是______.若在酸性的硫酸亚铁溶液中通入氧气,也能得到棕黄色溶液,请写出此反应的离子方程式______.检验棕黄色溶液是否有Fe2+,可选用的试剂为______(填字母)。
A.稀硝酸B.浓硫酸C.KSCN溶液D.酸性高锰酸钾溶液
(3)从降低成本和减少环境污染的角度考虑,制取硫酸铜最好的方法是______(填字母)。
A.铜和浓硫酸反应 B.铜和稀硫酸反应
C.氧化铜和硫酸反应 D.铜与Fe2(SO4)3溶液反应
(4)实验室用硫酸铜晶体配制一定物质的量浓度的硫酸铜溶液,下列操作将使所配溶液物质的量浓度偏高的是______(填字母)。
A.所用的硫酸铜晶体已经部分风化失水
B.移液时不小心溅出少许溶液
C.容量瓶查漏后未经干燥就直接使用
D.定容时俯视容量瓶刻度线
E.未洗涤烧杯和玻璃棒
【答案】(1)Na2O•CaO•6SiO2
(2)防止Fe2+被氧化 4Fe2++O2+4H+=4Fe3++2H2O D
(3)C (4)AD
【解析】(1)硅酸盐由盐的书写改写为氧化物的形式为:活泼金属氧化物·较活泼金属氧化物·二氧化硅·水的顺序书写,则Na2CaSi6O14,以氧化物形式可表示为Na2O•CaO•6SiO2
,故答案为:Na2O•CaO•6SiO2;
(2)亚铁易被氧化,当用硫酸亚铁制成药片时外表要包有一层特殊的糖衣,这层糖衣的作用是防止Fe2+被氧化;酸性条件下,亚铁离子与氧气反应生成铁离子和水,其反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O,二价铁离子被氧化产物为三价铁离子,所以加入稀硝酸、浓硫酸、KSCN溶液都不能检验二价铁离子存在,二价铁离子具有还原性,能够使酸性高锰酸钾褪色,所以可以选择高锰酸钾检验二价铁离子,故选D,
故答案为:防止Fe2+被氧化; 4Fe2++O2+4H+=4Fe3++2H2O;D;
(3)A、铜和浓硫酸反应的方程式为:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O,该反应中产生有毒气体二氧化硫,所以对环境有污染,不符合“绿色化学”理念,且硫酸的利用率不高,故A不符合题意;
B、铜和稀硫酸不发生反应,不能制得硫酸铜,故B不符合题意;
C、氧化铜和硫酸反应的方程式为:CuO+H2SO4=CuSO4+H2O,没有污染物,且硫酸的利用率100%,符合“绿色化学”和“降低成本”理念,故C符合题意;
D、铜与Fe2(SO4)3溶液反应反应方程式为Cu+Fe2(SO4)3=CuSO4+2FeSO4,该反应虽有硫酸铜生成,但同时生成硫酸亚铁,不能得到纯净硫酸铜,故D不符合题意;
故答案为:C;
(4)A、所用的硫酸铜晶体已经部分风化失水,导致实际秤取的硫酸铜物质的量偏大,溶液浓度偏高,故A选;
B、移液时不小心溅出少许溶液,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故B不选;
C、容量瓶查漏后未经干燥就直接使用,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故C不选;
D、定容时俯视容量瓶刻度线,导致溶液体积偏小,溶液浓度偏高,故D选;
E、未洗涤烧杯和玻璃棒,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故E不选;
故选:AD。
相关文档
- 2020届高考化学一轮复习重要的烃 2021-08-2421页
- 年高考化学一轮精品讲练析第12讲《2021-08-2418页
- 2020届一轮复习人教版 石油 2021-08-246页
- 2020届高考化学一轮复习有机合成的2021-08-2416页
- 2020届一轮复习人教版 石油 2021-08-246页
- 2020届一轮复习人教版 石油 2021-08-239页
- 2021版高考化学一轮复习核心素养微2021-08-236页
- 2018届二轮复习高考第Ⅱ卷得分方略2021-08-2325页
- 广东省2021版高考化学一轮复习第九2021-08-2361页
- 2020版高考一轮复习化学通用版学案2021-08-0611页