- 1.18 MB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
兰州一中2017-2018-1学期12月考试试题
高二化学
说明:本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分100分,考试时间100分钟。答案写在答题卡上,交卷时只交答题卡。
第Ⅰ卷(共48分)
选择题(每小题只有一个选项符合题意,每题2分,共48分)
1.常温常压下,2N2O5(g)=4NO2(g)+O2(g) △H=+56.8kJ/mol能自发进行的原因是
A.是吸热反应 B.是放热反应
C.是熵减少的反应 D.熵增大效应大于焓变效应
2.T ℃时,某NaOH溶液中c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T ℃),测得混合溶液的部分pH如表中所示:
序号
NaOH溶液的体积/mL
盐酸的体积/mL
溶液的pH
①
20.00
0.00
8
②
20.00
20.00
6
假设溶液混合前后的体积变化忽略不计,则c为
A.3 B.4 C.5 D.6
3.臭氧是理想的烟气脱硝剂,其脱硝反应为 2NO2(g,红棕色)+O3(g) N2O5(g,无色)+O2(g)。下列有关说法正确的是
A. 达到平衡时v正(NO2)∶v逆(N2O5)=1∶2
B. 达到平衡时,c(NO2)∶c(O3)∶c(N2O5)=2∶1∶1
C. 达到平衡时,v正=v逆=0
D. 达到平衡时,混合气体的颜色不再变化
4.下面均是正丁烷与氧气反应的热化学方程式(25°,101kPa):
①
②[.
③
④
由此判断,正丁烷的燃烧热是
A. B. C. D.
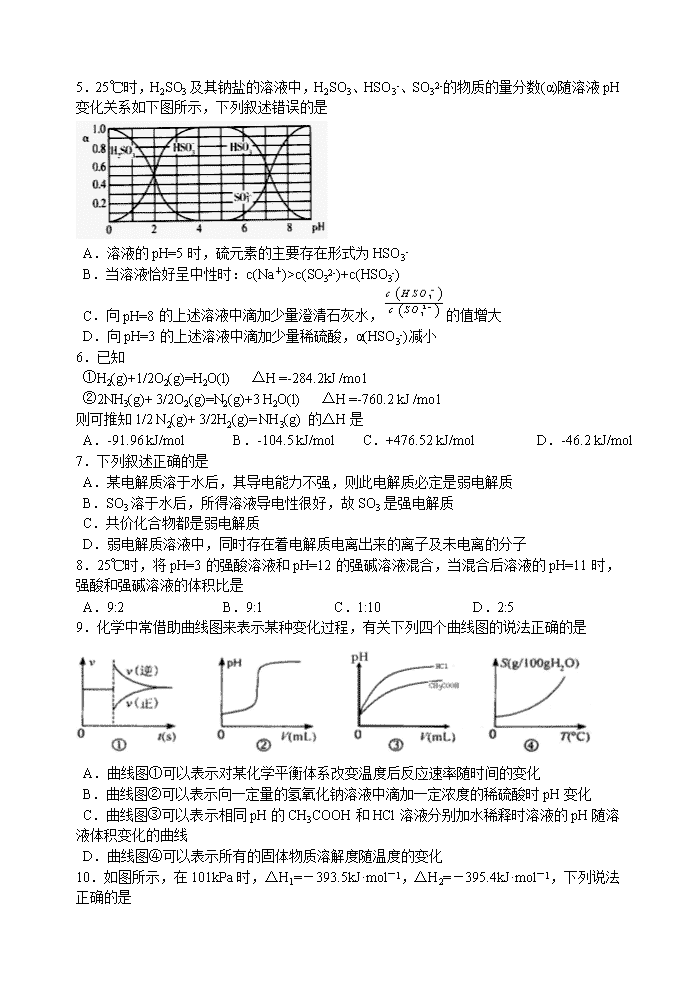
5.25℃时,H2SO3及其钠盐的溶液中,H2SO3、HSO3-、SO32-的物质的量分数(α)随溶液pH变化关系如下图所示,下列叙述错误的是
A.溶液的pH=5时,硫元素的主要存在形式为HSO3-
B.当溶液恰好呈中性时:c(Na+)>c(SO32-)+c(HSO3-)
C.向pH=8的上述溶液中滴加少量澄清石灰水,的值增大
D.向pH=3的上述溶液中滴加少量稀硫酸,α(HSO3-)减小
6.已知
①H2(g)+1/2O2(g)=H2O(l) △H =-284.2kJ /mo1
②2NH3(g)+ 3/2O2(g)=N2(g)+3 H2O(l) △H =-760.2 kJ /mo1
则可推知1/2 N2(g)+ 3/2H2(g)= NH3(g) 的△H是
A.-91.96 kJ/mol B.-104.5 kJ/mol C.+476.52 kJ/mol D.-46.2 kJ/mol
7.下列叙述正确的是
A.某电解质溶于水后,其导电能力不强,则此电解质必定是弱电解质
B.SO3溶于水后,所得溶液导电性很好,故SO3是强电解质
C.共价化合物都是弱电解质
D.弱电解质溶液中,同时存在着电解质电离出来的离子及未电离的分子
8.25℃时,将pH=3的强酸溶液和pH=12的强碱溶液混合,当混合后溶液的pH=11时,强酸和强碱溶液的体积比是
A.9:2 B.9:1 C.1:10 D.2:5
9.化学中常借助曲线图来表示某种变化过程,有关下列四个曲线图的说法正确的是
A.曲线图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化
B.曲线图②可以表示向一定量的氢氧化钠溶液中滴加一定浓度的稀硫酸时pH变化
C.曲线图③可以表示相同pH的CH3COOH和HCl溶液分别加水稀释时溶液的pH随溶液体积变化的曲线
D.曲线图④可以表示所有的固体物质溶解度随温度的变化
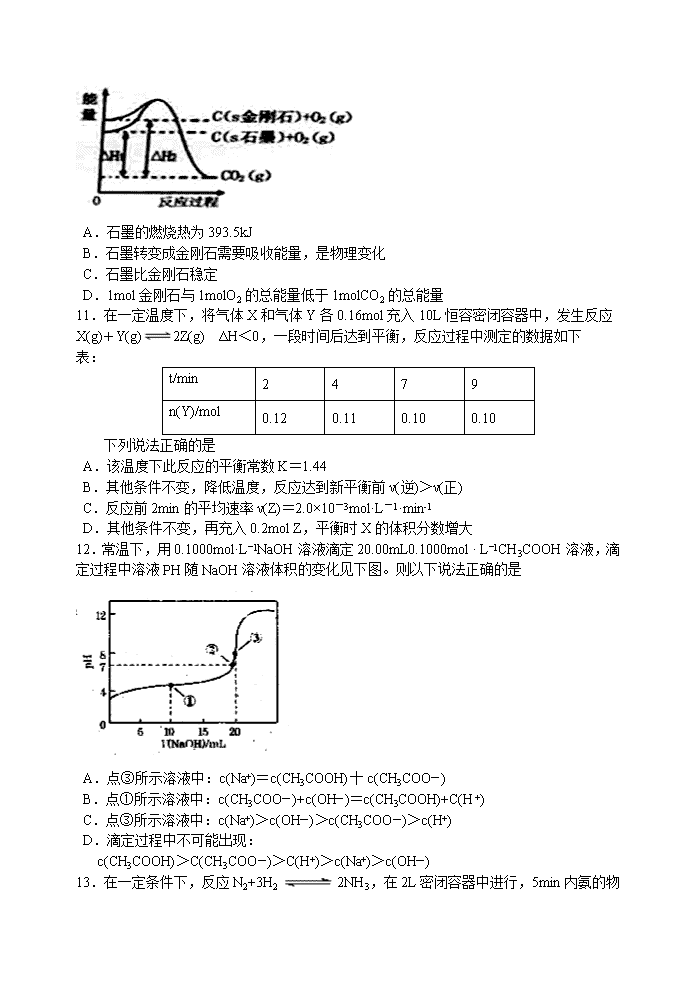
10.如图所示,在101kPa时,△H1=-393.5kJ·mol-1,△H2=-395.4kJ·mol-1,下列说法正确的是
A.石墨的燃烧热为393.5kJ
B.石墨转变成金刚石需要吸收能量,是物理变化
C.石墨比金刚石稳定
D.1mol金刚石与1molO2的总能量低于1molCO2的总能量
11.在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g)2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下
表:
t/min
2
4
7
9
n(Y)/mol
0.12
0.11
0.10
0.10
下列说法正确的是
A.该温度下此反应的平衡常数K=1.44
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正)
C.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
D.其他条件不变,再充入0.2mol Z,平衡时X的体积分数增大
12.常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol · L-1CH3COOH溶液,滴定过程中溶液PH随NaOH溶液体积的变化见下图。则以下说法正确的是
A.点③所示溶液中:c(Na+)=c(CH3COOH)十c(CH3COO―)
B.点①所示溶液中:c(CH3COO―)+c(OH―)=c(CH3COOH)+C(H+)
C.点③所示溶液中:c(Na+)>c(OH―)>c(CH3COO―)>c(H+)
D.滴定过程中不可能出现:
c(CH3COOH)>C(CH3COO―)>C(H+)>c(Na+)>c(OH―)
13.在一定条件下,反应N2+3H22NH3,在2L密闭容器中进行,5min
内氨的物质的量增加了1mol,则反应速率为
A. υ(H2)= 0.3 mol/(L·min) B. υ(N2)=0.2mol/(L·min)
C. υ(NH3)=0.2 mol/(L·min) D. υ (NH3)=0.1mol/(L·min)
14.对于反应2SO2(g)+O2(g)2SO3(g) △H<0 ,能增大正反应速率的措施是
A. 降低体系温度 B. 增大容器容积 C. 移去部分SO3 D. 通入大量O2[]
15.为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂过滤后,再加入适量的盐酸,这种试剂是
A. NH3•H2O B. NaOH C. Na2CO3 D. MgCO3
16.对四支分别盛有无色溶液的试管,进行如下操作,结论正确的是
操作
现象
结论
A
滴加氯水和CCl4,振荡、静置
下层溶液显紫红色
原溶液中有I-
B
滴加BaCl2溶液
生成白色沉淀
原溶液中一定有SO42-
C
向10mL 0.2mol/LNaOH溶液中先滴入2滴0.1mol/LMgCl2溶液,再滴加2滴0.1mol/LFeCl3溶液
先有白色沉淀生成,加入FeCl3溶液后,又有红褐色沉淀生成
在相同的温度下的Ksp: Mg(OH)2>Fe(OH)3
D
滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口
试纸不变蓝
原溶液中一定无NH4+
17.已知Ksp(AB2)=4.2×10-8,Ksp(AC)=3.0×10-15,在AB2、AC均为饱和的混合液中,测
得c(B-)=1.6×10-3 mol·L-1,则溶液中c(C2-)为
A.1.8×10-13 mol·L-1 B.7.3×10-13 mol·L-1 C.2.3 mol·L-1 D.3.7 mol·L-1
18.下列有关说法正确的是
A. 复分解型离子反应的实质是离子间重新组合使某些离子的浓度或数目减少
B. 电解质与非电解质的本质区别在于是否在溶于水后能否导电
C. CO2 、NH3的水溶液均能导电,所以CO2 、NH3是电解质
D. H++OH-=H2O可以表示所有强酸与强碱反应的离子方程式
19.用水稀释0.1mol·L-1氨水时,溶液中随着水量的增加而减小的是
A. c(OH-)/c(NH3·H2O) B. c(NH3·H2O)/ c(OH-)
C. c(H+)和c(OH-)的乘积 D. OH-的物质的量
20.草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/LNaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A.V(NaOH)=0时,c(H+)=1×10-2mol/L
B.V(NaOH)<10mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4- )[]
C.V(NaOH)=10 mL时,c(H+)=1×10-7mol/L
D.V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4- )
21.下列判断错误的是
①反应NH3(g)+HCl(g)===NH4Cl(s)在室温下可自发进行,则该反应的ΔH>0
②CaCO3(s)===CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<0
③一定温度下,反应MgCl2(l)===Mg(l)+Cl2(g)的ΔH>0、ΔS>0
④常温下,反应C(s)+CO2(g)===2CO(g)不能自发进行,则该反应的ΔH>0
A. ①③ B. ②③ C. ②④ D. ①②
22.在一个不导热的密闭反应器中,只发生两个反应:
A(g)+B(g)2C(g) △H < 0
X(g)+3Y(g)2Z(g) △H > 0
进行相关操作且达到平衡,下列叙述正确的是
A.等压时,通入惰性气体,C的物质的量增大
B.等压时,通入X气体,反应器中温度不变
C.等容时,通入惰性气体,各反应速率不变
D.等容时,通入X气体,Y的物质的量浓度增大
23.下列叙述正确的是
A.已知I3-I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大
B.室温下向10mL pH =3的醋酸溶液中加水稀释后,溶液中减小
C.室温时ka(HF)=3.6×10-4,ka(CH3COOH)=1.75×10-5,0.1 mol /L的NaF溶液与
0.1 mol /L的CH3COOK溶液相比,一定有c(Na+) -c(F-)<c(K+)-c(CH3COO-)成立
D.在25℃时,将amol/L的氨水与0.01 mol/L的盐酸等体积混合,充分反应后溶液中
c(NH4+)=c(Cl-),则25℃时NH3 • H2O的电离常数Kb=
24.下列实验事实不能用平衡移动原理解释的是
A. B.
C. D.
第Ⅱ卷 非选择题(共52分)
25.(8分)回答下列问题:
(1)下列物质中 ①Cu ②液态SO2 ③CH3COOH ④NaHCO3 ⑤Ba(OH)2溶液 ⑥熔融NaCl ⑦稀氨水 ⑧BaSO4 ⑨H2O。属于强电解质的是 (填序号),属于弱电解质的是 (填序号);
(2)25 ℃时,向pH均为1的盐酸和醋酸溶液中分别加水,
随加水量的增多,两溶液pH的变化如图所示,则符合盐酸
pH变化的曲线是 ;
(3)现有25℃、pH=13的Ba(OH)2溶液,与某浓度
盐酸溶液按体积比(碱与酸之比)1:9混合后,所得溶
液pH=11(假设混合溶液的体积等于混合前两溶液的体
积和),该盐酸溶液的pH= .
26.(12分)物质在水溶液中有不同的性质。按要求回答下列问题:[]
(1)Na2SO3溶液显碱性,其原因是______________________________(用离子方程式表示),该溶液中各离子浓度由大到小的顺序为______________________。
(2)室温下向10mL氨水溶液中加水稀释后,下列量增大的有__________(填编号,下同),减小的有______ _____。
a.溶液中氢氧离子浓度 b.氨水的电离程度c.水的离子积常数 d.c(H+)/ c(NH3·H2O)
(3)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。NaClO2变质可分解为NaClO3和NaCl。取等质量已变质和未变质的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量 (填“相同”或“不相同”),其原因是 。
27.(10分)有pH=4的盐酸、硫酸、醋酸三瓶溶液:(以下用>、<、=表示)
(1)设三种溶液的物质的量浓度依次为c1、c2、c3,则其关系是 。
(2)取相同体积的三种酸分别加入蒸馏水稀释到pH=6,需水的体积依次为V1、V2、V3,则其关系是 。
(3)完全中和体积和物质的量浓度均相同的Ba(OH)2溶液时,需三种酸的物质的量依次为n1、n2、n3,则其关系是 。
(4)取同体积的酸的溶液分别加入足量的锌粉,反应开始放出H2的速率依次为v1、v2、v3,则其关系是 ;反应过程中放出H2的速率依次为va、vb、vc,则其关系是 。
28.(8分)某温度(T)下的溶液中,c(H+)=10-xmol·L-1,
c(OH-)=10-ymol·L-1,x与y的关系如图所示,请回答下列
问题:
(1) 此温度下,水的离子积KW为________,则该温
度T________25℃(填“>”、“<”或“=”),pH=7的溶
液显________性(填“酸”、“碱”或“中”)。
(1) 若将此温度(T)下,pH=11的苛性钠溶液a L与pH=1的
稀硫酸b L混合(假设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比。①若所得混合液为中性,则a:b=______;,②若所得混合液的pH=2,则a:b=______。
29.(14分)某学生用0.1000 mol·L-1的NaOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.移取20 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准NaOH溶液注入碱式滴定管至刻度0以上2~3 cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)______________________________。
(2)上述B步骤操作的目的是_______________________________________。
(3)实验中用左手控制活塞,眼睛注视 ___________________,直至滴定终点。判断到达终点的现象是________________________________。
(4)某学生根据3次实验分别记录有关数据如下表:
滴定
次数
待测溶液的体积(mL)
0.100 0 mol·L-1NaOH的体积(mL)
滴定前刻度
滴定后刻度
溶液体积(mL)
第一次
20.00
0.00
26.11
26.11
第二次
20.00
1.56
30.30
28.74
第三次
20.00
0.22
26.31
26.09
依据上表数据列式计算该盐酸溶液的物质的量浓度为
(5)用0.1000 mol·L-1 NaOH溶液滴定0.1000 mol·L-1盐酸,如达到滴定的终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05 mL),继续加水至50 mL,所得溶液的pH等于____________
(6)下列哪些操作会使测定结果偏高 (填序号)。
A.锥形瓶中溶液的颜色刚刚由无色变为浅红色即停止滴定
B.碱式滴定管用蒸馏水洗净后立即注入标准液
C.滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
E.实验中,用待盛装的溶液润洗锥形瓶
兰州一中2017-2018-1学期12月考试试题高二化学参考答案
1.D2.B3.D4.A5.C6.D7.D8.A9.C10.C11.A12.A13.D14.D15.D16.A
17.A18.A19.B20.D21.D22.C 23.CD24.C
25.(1)④⑥⑧ ③⑨ (2)A (3)2
26.(1)SO32-+H2OHSO3-+OH-;(写一步即可得分)
c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
(2) b,d;a;(3)相同 Fe2+与变质前后的NaClO2反应,最后的还原产物都是NaCl,根据电子守恒消耗的Fe2+物质的量应相同
27.(1)c2<c1<c3或c3>c1>c2 (2)V1=V2<V3 (3)n1=n3>n2 (4)v1=v2=v3 va=vb<vc
28.1×10-13 > 碱 10:1 9:2
29.(1)ABDCEF或BDCEAF (2)除去附在滴定管壁上的水,防止水稀释标准溶液
(3)锥形瓶中溶液的颜色变化 溶液的颜色由无色变浅红且保持半分钟内不褪色
(4)0.1305mol/L (5) 10 (6)B、C、E