- 394.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
陕西省安康中学2020届高三第三次模拟考试
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 K 39
一、选择题(每小题6分,共42分)
7.在2019年9月25日,北京大兴国际机场正式投运。下列说法不正确的是( )
A.机场航站楼使用的隔震支座由橡胶和钢板相互粘结而成,属于新型无机材料
B.机场航站楼使用的玻璃为无机非金属材料
C.机场航站楼采用的钢铁属于合金材料
D.机场高速采用了新型自融冰雪路面技术,减少了常规融雪剂使用对环境和桥梁结构所造成的破坏
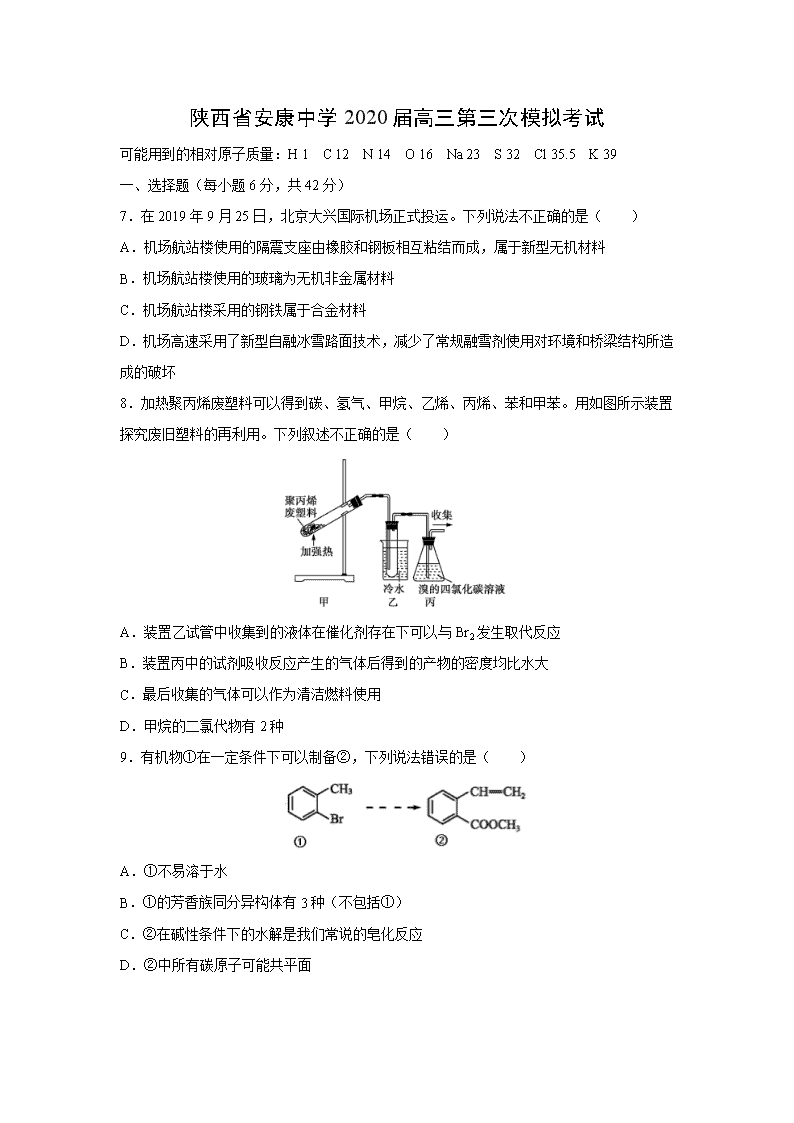
8.加热聚丙烯废塑料可以得到碳、氢气、甲烷、乙烯、丙烯、苯和甲苯。用如图所示装置探究废旧塑料的再利用。下列叙述不正确的是( )
A.装置乙试管中收集到的液体在催化剂存在下可以与Br2发生取代反应
B.装置丙中的试剂吸收反应产生的气体后得到的产物的密度均比水大
C.最后收集的气体可以作为清洁燃料使用
D.甲烷的二氯代物有2种
9.有机物①在一定条件下可以制备②,下列说法错误的是( )
A.①不易溶于水
B.①的芳香族同分异构体有3种(不包括①)
C.②在碱性条件下的水解是我们常说的皂化反应
D.②中所有碳原子可能共平面
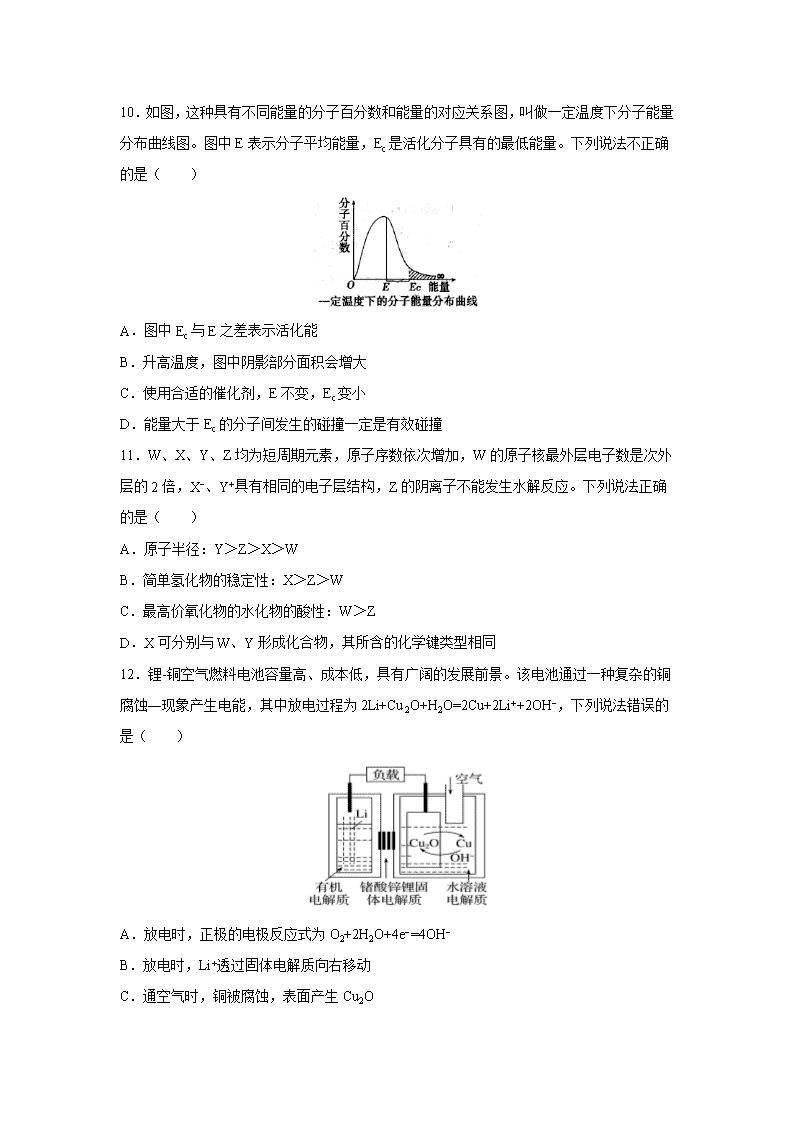
10.如图,这种具有不同能量的分子百分数和能量的对应关系图,叫做一定温度下分子能量分布曲线图。图中E表示分子平均能量,Ec是活化分子具有的最低能量。下列说法不正确的是( )
A.图中Ec与E之差表示活化能
B.升高温度,图中阴影部分面积会增大
C.使用合适的催化剂,E不变,Ec变小
D.能量大于Ec的分子间发生的碰撞一定是有效碰撞
11.W、X、Y、Z均为短周期元素,原子序数依次增加,W的原子核最外层电子数是次外层的2倍,X−、Y+具有相同的电子层结构,Z的阴离子不能发生水解反应。下列说法正确的是( )
A.原子半径:Y>Z>X>W
B.简单氢化物的稳定性:X>Z>W
C.最高价氧化物的水化物的酸性:W>Z
D.X可分别与W、Y形成化合物,其所含的化学键类型相同
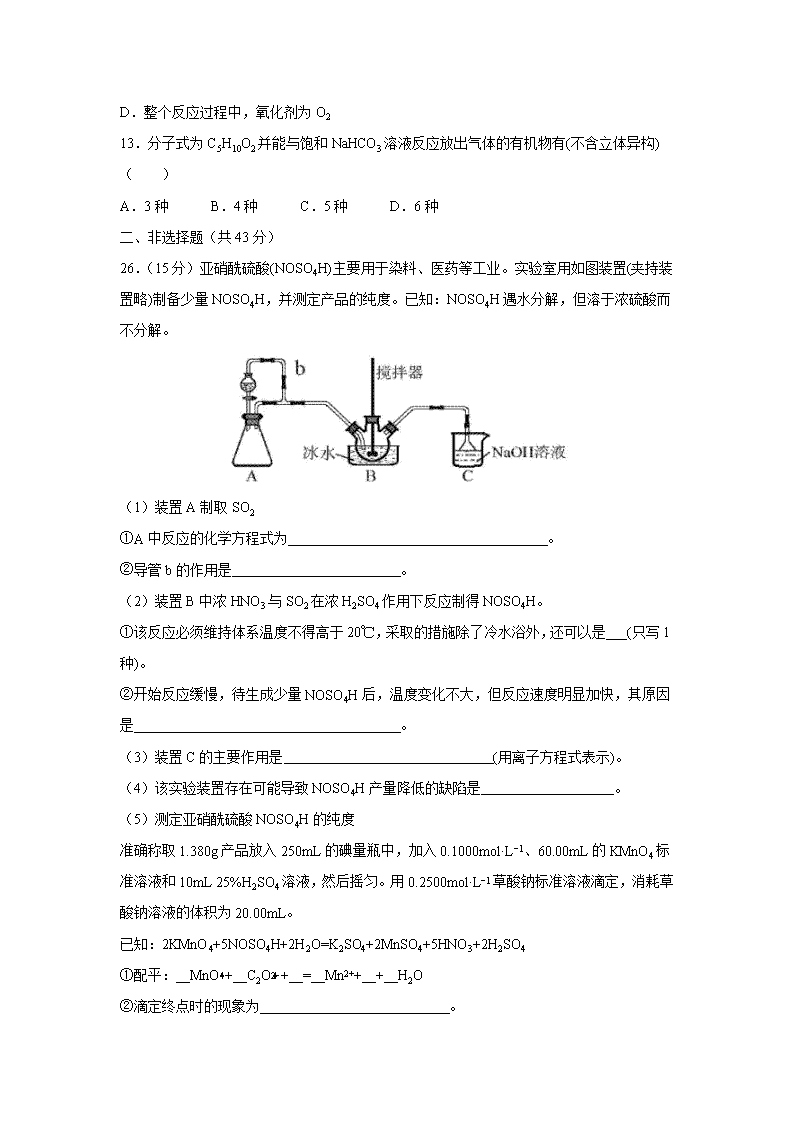
12.锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀―现象产生电能,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH−,下列说法错误的是( )
A.放电时,正极的电极反应式为O2+2H2O+4e−=4OH−
B.放电时,Li+透过固体电解质向右移动
C.通空气时,铜被腐蚀,表面产生Cu2O
D.整个反应过程中,氧化剂为O2
13.分子式为C5H10O2并能与饱和NaHCO3溶液反应放出气体的有机物有(不含立体异构) ( )
A.3种 B.4种 C.5种 D.6种
二、非选择题(共43分)
26.(15分)亚硝酰硫酸(NOSO4H)主要用于染料、医药等工业。实验室用如图装置(夹持装置略)制备少量NOSO4H,并测定产品的纯度。已知:NOSO4H遇水分解,但溶于浓硫酸而不分解。
(1)装置A制取SO2
①A中反应的化学方程式为 。
②导管b的作用是 。
(2)装置B中浓HNO3与SO2在浓H2SO4作用下反应制得NOSO4H。
①该反应必须维持体系温度不得高于20℃,采取的措施除了冷水浴外,还可以是___(只写1种)。
②开始反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速度明显加快,其原因是 。
(3)装置C的主要作用是 (用离子方程式表示)。
(4)该实验装置存在可能导致NOSO4H产量降低的缺陷是 。
(5)测定亚硝酰硫酸NOSO4H的纯度
准确称取1.380g产品放入250mL的碘量瓶中,加入0.1000mol·L−1、60.00mL的KMnO4标准溶液和10mL 25%H2SO4溶液,然后摇匀。用0.2500mol·L−1草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4
①配平:__MnO+__C2O+__=__Mn2++__+__H2O
②滴定终点时的现象为 。
③亚硝酰硫酸的纯度= 。(精确到0.1%)[M(NOSO4H)=127g·mol−1]
27.(14分)为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)已知:①N2(g)+O2(g)2NO(g) ΔH=+180.5kJ/mol;
②CO的燃烧热为283.0kJ/mol。
则2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH=________kJ/mol。
(2)在恒温、恒容条件下,将2.0mol NO和1.0mol CO充入一个容积为2L的密闭容器中发生上述反应,反应过程中部分物质的物质的量(n)变化如图所示。
①N2在0~9min内的平均反应速率v(N2)=________mol/(L·min);
②第9min时氮气的产率为________;
③第12min时改变的反应条件可能为_______(填字母代号);
A.升高温度 B.加入NO C.加催化剂 D.减小压强 E.降低温度
④若在第24min将NO与N2的浓度同时增加到原来的2倍,化学平衡______移动(填“向正反应方向”、“逆反应方向”或“不”)。
(3)若将反应容器改为恒温容积可变的恒压密闭容器,压强为P=3.0MPa,反应物加入的物质的量不变,达到平衡时CO的转化率为50%,该温度下此反应平衡常数Kp=______。
28.(14分)废旧锌锰电池含有锌、锰元素,主要含有ZnO、ZnMn2O4、MnO、Mn2O3、Mn3O4、MnO2。利用废旧锌锰电池回收锌和制备二氧化锰、硫酸的工艺流程如图:
回答下列问题:
(1)步骤②“粉碎”的主要目的是 。
(2)步骤③“酸浸”发生了一系列反应:
ZnO+H2SO4=ZnSO4+H2O;MnO+H2SO4=MnSO4+H2O;
ZnMn2O4+2H2SO4=ZnSO4+MnSO4+2H2O+MnO2;
MnO2+H2SO4+H2C2O4=MnSO4+2CO2↑+2H2O。
推测Mn2O3与硫酸反应的离子方程式为 。
(3)如图分别表示“酸浸”时选用不同浓度硫酸和草酸对 Zn、Mn 浸出率的影响。
①为保证Zn、Mn的浸出率均大于90%,步骤③需控制的c(H2SO4)=____mol/L。H2C2O4浓度对 Mn的浸出率影响程度大于Zn,其原因是 。
②假设“酸浸”所得溶液中Zn2+、Mn2+浓度相等。当 c(H2C2O4)>0.25mol/L时,Zn、Mn的浸出率反而下降、且Zn的浸出率下降先于Mn,其原因可能是_____(填序号)。
a.随着反应进行c(H+)降低
b.Zn2+、Mn2+与C2O生成沉淀
c.溶解度:ZnC2O4<MnC2O4
(4)步骤⑤用惰性电极电解ZnSO4、MnSO4的混合溶液,除生成Zn、MnO2、H2SO4外,还可能生成H2、O2或其混合物。
①生成MnO2的电极反应式为 。
②若n(H2)∶n(O2)=2∶1,则参加反应的n(Zn2+)∶n(Mn2+)=______。
③该工艺流程中可循环利用的物质是________。
三、选考题(共15分,请考生从以下题中任选一题作答,如果多做,则按所做的第一题计分。)
35.【化学——选修3:物质结构与性质】(15分)
钛及其化合物在化工、医药、材料等领域有着广泛的应用。
(1)基态钛原子的价电子排布式为_____________,与钛同周期的元素中,基态原子的未成对电子数与钛相同的有____________种。
(2)钛比钢轻、比铝硬,是一种新兴的结构材料,钛的硬度比铝大的原因是______________
_____________________________________________________。
(3)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1∶5,则该配合离子的化学式为___________。
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如下图所示。
①组成M的元素中,电负性最大的是_________(填名称)。
②M中碳原子的杂化方式为____________。
③M中不含________(填代号)。
a.π键 b.σ键 c.离子键 d.配位键
(5)金红石(TiO2)是含钛的主要矿物之一。其晶胞结构(晶胞中相同位置的原子相同)如图所示。
①A、B、C、D 4种微粒,其中氧原子是________(填代号)。
②若A、B、C的原子坐标分别为A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,____,___);钛氧键的键长d=______(用代数式表示)。
36.【化学——选修5:有机化学基础】(15分)
如图中的Ⅰ是某抗肿瘤药物的中间体,B的核磁共振氢谱有3组峰,C的分子式为C7H8O,D分子中有两个相同且处于相邻位置的含氧官能团,E的相对分子质量比D大34.5。
已知:RCHO+R1CH2CHORCH=C(R1)CHO+H2O。
请回答下列问题:
(1)C的名称是______,B的结构简式为_________,D转化为E的反应类型是____________。
(2)I中官能团的名称为___________,I的分子式为________。
(3)写出E转化为F的化学方程式____________________________________________。
(4)X是G酸化后的产物,X有多种芳香族同分异构体,符合下列条件且能发生银镜反应的同分异构体有_________种(不包括X),写出核磁共振氢谱有4组峰的物质的结构简式____________。
①遇FeCl3溶液发生显色反应 ②苯环上有两种类型的取代基
(5)参照上述流程,以乙醇为原料(其他无机试剂自选)可制取2﹣丁烯酸,写出相应的合成路线______________________________________。
【参考答案】
7. 【答案】A
【解析】A.橡胶属于有机高分子材料,钢板属于合金材料,它们都不属于新型无机材料,A不正确;B.玻璃的主要成分为硅酸盐,属于无机非金属材料,B正确;C.钢铁是铁碳的合金,属于合金材料,C正确;D.常规融雪剂主要成分为氯化镁等,会腐蚀水泥路面和桥梁,新型自融冰雪路面技术可减少对路面及桥梁的影响,D正确;故选A。
8. 【答案】D
【解析】A.装置乙试管中收集到的液体物质是苯和甲苯,两种物质的分子中都含有苯环,在催化剂存在下可以与Br2发生取代反应,A正确;B.加热聚丙烯废塑料得到的不饱和烃乙烯、丙烯可以与Br2发生加成反应,产生1,2-二溴乙烷和1,2-二溴丙烷,它们都是液体物质,难溶于水,密度比水大,B正确;C.加热聚丙烯废塑料可以得到碳、氢气、甲烷、乙烯、丙烯、苯和甲苯,气体物质有氢气、甲烷、乙烯、丙烯,液体物质有苯和甲苯,其中苯和甲苯经冷水降温恢复至常温下的液态留在小试管中;气体中乙烯、丙烯与溴的四氯化碳溶液反应变为液体,剩余气体为氢气、甲烷,燃烧产生H2O、CO2,无污染,因此可作为清洁燃料使用,C正确;D.甲烷是正四面体结构,分子中只有一种H原子,其二氯代物只有1种,D错误;故合理选项是D。
9. 【答案】C
【解析】A.根据①分子结构可以看出,它属于溴代烃,是难溶于水的,故A正确;B.Br和甲基处在苯环的相间,相对的位置,Br取代在甲基上,共有三种,故B正确;C.皂化反应仅限于油脂与氢氧化钠或氢氧化钾混合,得到高级脂肪酸的钠/钾盐和甘油的反应,故C错误;D.苯环和双键都是平面结构,可能共面,酯基中的两个碳原子,一个采用sp2杂化,一个采用sp3杂化,所有碳原子可能共面,故D正确;答案选C。
10. 【答案】D
【解析】A.E表示分子的平均能量,Ec是活化分子具有的最低能量,能量等于或高于Ec的分子可能产生有效碰撞,活化分子具有的最低能量Ec与分子的平均能量E之差叫活化能,A正确;B.当温度升高时,气体分子的运动速度增大,不仅使气体分子在单位时间内碰撞的次数增加,更重要的是由于气体分子能量增加,使活化分子百分数增大,阴影部分面积会增大,B正确;C.催化剂使活化能降低,加快反应速率,使用合适的催化剂,E不变,Ec
变小,C正确;D.E表示分子的平均能量,Ec是活化分子具有的最低能量,能量等于或高于Ec的分子可能产生有效碰撞,D错误;故答案为:D。
11. 【答案】B
【解析】W原子的最外层电子数是次外层的2倍,则W为碳(C);X−、Y+具有相同的电子层结构,则X为氟(F),Y为钠(Na);Z 的阴离子不能发生水解反应,则Z为氯(Cl)。A.比较原子半径时,先看电子层数,再看最外层电子数,则原子半径Na>Cl>C>F,A错误;B.非金属性F>Cl>C,所以简单氢化物的稳定性X>Z>W,B正确;C.非金属性C