- 2.82 MB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1
专题 9 化学能与热能
1.(2019·江苏)氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确
的是
A.一定温度下,反应2H2(g)+O2(g) 2H2O(g)能自发进行,该反应的ΔH<0
B.氢氧燃料电池的负极反应为O2+2H2O+4e− 4OH−
C.常温常压下,氢氧燃料电池放电过程中消耗11.2 L H2,转移电子的数目为6.02×1023
D.反应 2H2(g)+O2(g) 2H2O(g)的ΔH 可通过下式估算:
ΔH=反应中形成新共价键的键能之和−反应中断裂旧共价键的键能之和
【答案】A
【解析】体系能量降低和混乱度增大都有促使反应自发进行的倾向,该反应属于混乱度减小
的反应,能自发说明该反应为放热反应,即∆H<0,故 A 正确;B.氢氧燃料电池,氢气作负
极,失电子发生氧化反应,中性条件的电极反应式为:2H2 − 4e− =4H+,故 B 错误;C.常温
常压下,Vm≠22.L/mol,无法根据气体体积进行微粒数目的计算,故 C 错误;D.反应中,应
该如下估算:∆H=反应中断裂旧化学键的键能之和− 反应中形成新共价键的键能之和,故 D
错误;故选 A。
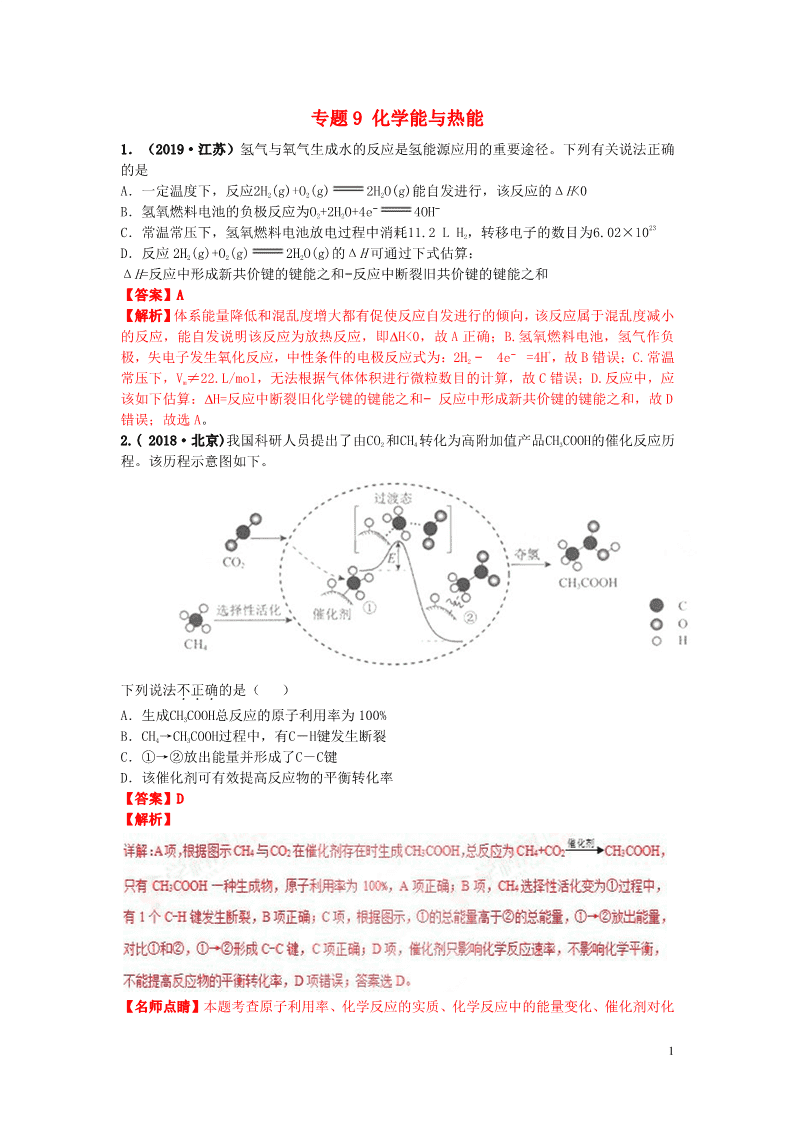
2.( 2018·北京)我国科研人员提出了由CO2 和CH4 转化为高附加值产品CH3COOH的催化反应历
程。该历程示意图如下。
下列说法不正确...的是( )
A.生成CH3COOH总反应的原子利用率为 100%
B.CH4→CH3COOH过程中,有C―H键发生断裂
C.①→②放出能量并形成了C―C键
D.该催化剂可有效提高反应物的平衡转化率
【答案】D
【解析】
【名师点睛】本题考查原子利用率、化学反应的实质、化学反应中的能量变化、催化剂对化
2
学反应的影响,解题的关键是准确分析示意图中的信息。注意催化剂能降低反应的活化能,
加快反应速率,催化剂不能改变ΔH、不能使化学平衡发生移动。
3.(2018·江苏)下列说法正确的是( )
A.氢氧燃料电池放电时化学能全部转化为电能
B.反应 4Fe(s)+3O2(g) 2Fe2O3(s)常温下可自发进行,该反应为吸热反应
C.3 mol H2 与 1 mol N2 混合反应生成NH3,转移电子的数目小于 6×6.02×1023
D.在 酶催化淀粉水解反应中,温度越高淀粉水解速率越快
【答案】C
【解析】
【名师点睛】本题考查燃料电池中能量的转化、化学反应自发性的判断、可逆的氧化还原反
应中转移电子数的计算、蛋白质的变性和酶的催化特 点。弄清化学反应中能量的转化、化
学反应自发性的判据、可逆反应的特点、蛋白质的性质和酶催化的特点是解题的关键。
4.( 2016·海南)油酸甘油酯(相对分子质量 884)在体内代谢时可发生如下反应:
C57H104O6(s)+80O2(g)=57CO2(g)+52H2O(l)已知燃烧 1kg该化合物释放出热量 3.8×104kJ。油酸
甘油酯的燃烧热 △H为( )
A.3.8×104kJ·mol-1
B.-3.8×104kJ·mol-1
C.3.4×104kJ·mol-1
D.-3.4×104kJ·mol-1
【答案】D
【解析】】燃烧热指的是燃烧 1mol 可燃物生成稳定的氧化物所放出的热量。燃烧 1kg 油酸
甘油酯释放出热量 3.8×104kJ,则燃烧 1 mol 油酸甘油酯释放出热量为 3.4×104kJ,则得油
酸甘油酯的燃烧热△H=-3.4×104kJ·mol-1
【名师点睛】考纲明确要求:了解化学能与热能的相互转化。了解吸热反应、放热反应、反
应热等概念。根据考纲的这一要求将化学反应中的物质变化和能量变化综合起来考查将成为
一种热门的题型,同时注意到由于能源日益匮乏,因此有关燃烧热、中和热、盖斯定律等问
题必将成为今后命题的重点。新课程背景下的高考热化学方程式试题大多是一些思路型题
型,题目变化较多,但思路变化却较少,主干知识依然是重点考查的内容。此类试题比较贴
近当前的教学实际,虽然形式上有各种各样的变化,但只要学会了基础题型的解题思路和应
对策略,缜密分析、逐层递解,再经过一些变化演绎,就可以准确解答相关题型。此外,通
过此类题型的解题策略探究还有利于培养学生科学素养、创新精神和灵活运用所学知识综合
解决实际问题的能力。
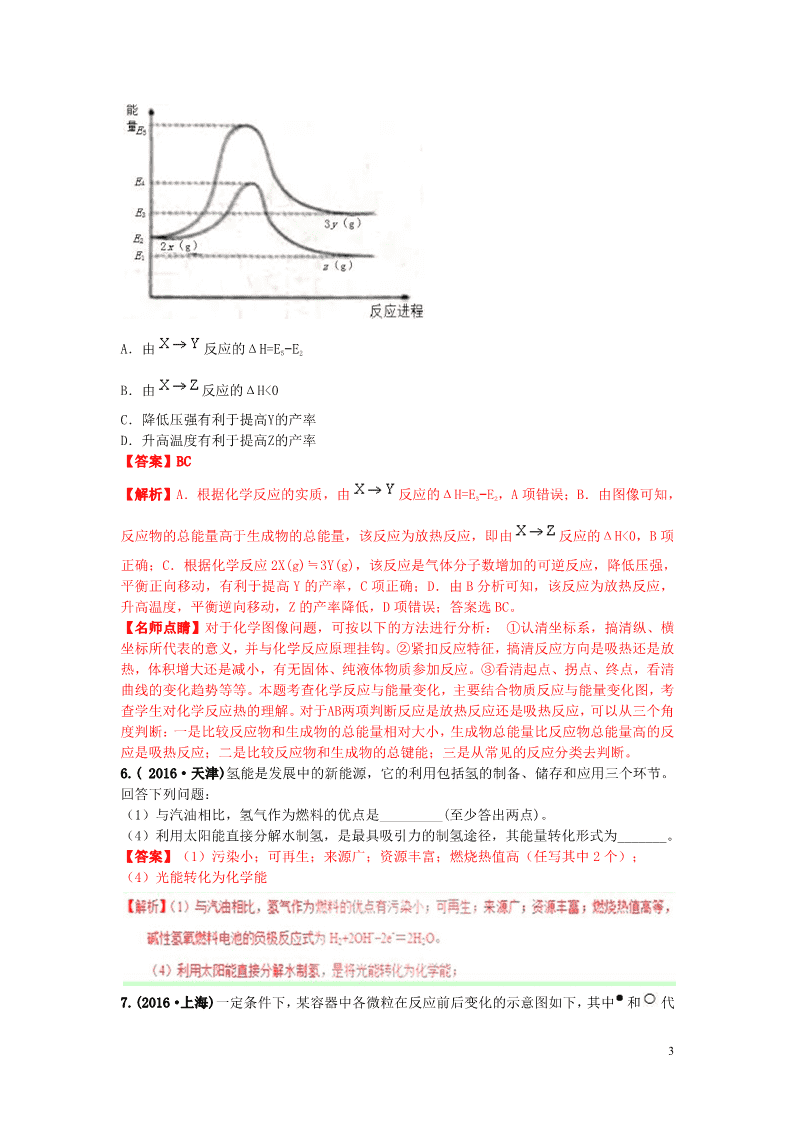
5.(2016·海南)由反应物X转化为Y和Z的能量变化如图所示。下列说法正确的是( )
3
A.由 反应的ΔH=E5−E2
B.由 反应的ΔH<0
C.降低压强有利于提高Y的产率
D.升高温度有利于提高Z的产率
【答案】BC
【解析】A.根据化学反应的实质,由 反应的ΔH=E3−E2,A 项错误;B.由图像可知,
反应物的总能量高于生成物的总能量,该反应为放热反应,即由 反应的ΔH<0,B 项
正确;C.根据化学反应 2X(g)≒3Y(g),该反应是气体分子数增加的可逆反应,降低压强,
平衡正向移动,有利于提高 Y 的产率,C 项正确;D.由 B 分析可知,该反应为放热反应,
升高温度,平衡逆向移动,Z 的产率降低,D 项错误;答案选 BC。
【名师点睛】对于化学图像问题,可按以下的方法进行分析: ①认清坐标系,搞清纵、横
坐标所代表的意义,并与化学反应原理挂钩。②紧扣反应特征,搞清反应方向是吸热还是放
热,体积增大还是减小,有无固体、纯液体物质参加反应。③看清起点、拐点、终点,看清
曲线的变化趋势等等。本题考查化学反应与能量变化,主要结合物质反应与能量变化图,考
查学生对化学反应热的理解。对于AB两项判断反应是放热反应还是吸热反应,可以从三个角
度判断:一是比较反应物和生成物的总能量相对大小,生成物总能量比反应物总能量高的反
应是吸热反应;二是比较反应物和生成物的总键能;三是从常见的反应分类去判断。
6.( 2016·天津)氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。
回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是_________(至少答出两点)。
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_______。
【答案】(1)污染小;可再生;来源广;资源丰富;燃烧热值高(任写其中 2 个);
(4)光能转化为化学能
7.(2016·上海)一定条件下,某容器中各微粒在反应前后变化的示意图如下,其中 和 代
4
表不同元素的原子。
关于此 反应说法错误的是( )
A.一定属于吸热反应
B.一定属于可逆反应
C.一定属 于氧化还原反应
D.一定属于分解反应
【答案】A
【名师点睛】化学试题的呈现方式形式多样,可采用文字、数据、图表、示意图等多种方式
的融合,增加试题信息的广度,考查学生从不同呈现方式中提取有用信息、加工信息,并利
用信息进行思考或推理的能力。这些信息蕴含着解决试题的重要思路、数据和方法,如物质
性质、物质形态、反应条件、反应产物、结构特征以及变化趋势等。这就要求考生通过“现
场独立自学”的方式,从中概括抽象出新的知识或发现数据之间的关系,同时与学过的知识
相组合,形成较全面的网络化的知识体系,将这些知识体系进一步应用到新的知识情境中,
从而解决问题。这种试题培养和考查了考生自主学习和独立思考的能力。本题利用分子模型
示意图考查了四种基本反应类型与氧化还原反应、可逆反应、吸(放)热反应的区别与联系,
注意示意图中隐藏的信息:反应前只有一种分子,反 应后既有新生成的化合物分子,又有
新生成的单质分子,还有未反应的反应物分子,结合各种反应类型的本质特征回答即可。
8.(2015·全国I)(3)已知反应 2HI(g) ===H2(g) + I2(g)的ΔH= +11kJ·mol-1,1mol H2(g)、
1mol I2(g)分子中化学键断裂时分别需要吸收 436kJ、151kJ的能量,则 1molHI(g)分子中化
学键断裂时需吸收的能量为__________kJ。
【答案】(3)299
【解析】(3)键能一般取正值来运算,ΔH=E(反应物键能总和)-E(生成物键能总和);
设 1molHI(g)分子中化学键断裂时需吸收的能量为xkJ,代入计算:+11=2x-(436+151),
解得x=299;
9.( 2015·北京)最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化
学键的过程。反应过程的示意图如下:
5
下列说法中正确的是( )
A.CO和O生成CO2 是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2
D.状态Ⅰ →状态Ⅲ表示CO与O2 反应的过程
【答案】C
10.( 2015·上海)已知H2O2 在催化剂作用下分解速率加快,其能量随反应进程的
变化如下图所示。下列说法正确的是( )
A.加入催化剂,减小了反应的热效应
B.加入催化剂,可提高H2O2 的平衡转化率
C.H2O2 分解的热化学方程式:H2O2 → H2O + O2 + Q
D.反应物的总能量高于生成物的总能量
【答案】D
【解析】A.加入催化剂,减小了反应的活化能,使反应在较低的温度下发生,但是反应的
热效应不变,错误。B.加入催化剂,可提高H2O2 的分解的反应速率,该反应不是可逆反应,
而且催化剂不能是平衡
11.( 2015·江苏)下列说法正确的是( )
A.分子式为C2H6O的有机化合物性质相同
6
B.相同条件下,等质量的碳按a、b两种途径完全转化,途径a比途径b放出更多热能
途径a:C CO+H2 CO2+H2O
途径b:C CO2
C.在氧化还原反应中,还原剂失去电子总数等于氧化剂得到电子的总数
D.通过化学变化可以直接将水转变为汽油
【答案】C
【解析】A、C2H6O可以是CH3CH2OH,也可以是CH3OCH3,化学性质不同,故A错误;B、根据盖斯
定律,反应热只跟始态和终态有关,跟反应过程无关,始态和终态不变,反应热不变,等质
量C生成CO2,放出热量相同,故B错误;C、氧化还原反应中,得失电子数目守恒,故C正确;
D、违背了化学变化的元素守恒,故D错误。
12.( 2015·海南)己知丙烷的燃烧热△H=-2215kJ·mol-1,若一定量的丙烷完全燃烧后生成
1.8g水,则放出的热量约为( )
A.55 kJ B.220 kJ C. 550 kJ D.1108 kJ
【答案】A
13.(2014·全国 II)室温下,将 1mol 的 CuSO4·5H2O(s)溶于水会使溶液温度降低,热效
应为ΔH1,将 1mol 的 CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O 受热
分解的化学方程式为:CuSO4·5H2O(s) CuSO4(s) +5H2O( ),热效应为ΔH3。则下列
判断正确的是
A.ΔH2>Δ H3 B.ΔH1<ΔH3C.ΔH1+ΔH3=ΔH2 D.ΔH1+ΔH2=ΔH3
【答案】B
【解析】根据题意,发生反应的热化学方程式为:CuSO4·5H2O(s)溶于水(溶液温度降低,
该过程为吸热过程):CuSO4·5H2O(s) Cu2+( )+SO4
2-( )+5H2O( ) ΔH1>0
CuSO4(s)溶于水会(使溶液温度升高,该过程为放热过程)
CuSO4(s) Cu2+( )+SO4
2-( ) ΔH2<0
CuSO4 ·5H2O(s)受热分解的热化学方程式为 CuSO4 ·5H2O(s) CuSO4(s) +5H2O( )
ΔH3 根据盖斯定律可知:ΔH3=ΔH1-ΔH2>0
A、根据上述分析,ΔH2<0,ΔH3>0,所以 A 错误;B、ΔH3=ΔH1-ΔH2(ΔH2<0),所以ΔH3>
ΔH1,B 正确;C、ΔH3=ΔH1-ΔH2,C 错误;D、ΔH1+ΔH2<ΔH3,D 错误。
14.(2014·全国 I)已知分解 1mol H2O2 放出热量 98KJ。在含有少量 I 的溶液中,H2O2 分
解的机理为:H2O2+ I H2O+IO H2O2+ IO H2O+O2+ I
下列有关该反应的说法正确的是( )
7
A.反应速率与 I 浓度有关 B.IO 也是该反应的催化剂
C.反应活化能等于 98KJ mol-1 D.
【答案】A
【解析】决定化反应速率的主要是慢反应,所以 I-浓度越大,则整个反应速率越快,A 正确、
B 错误;98KJ·mol-1 是该反应的△H,活化能不能确定,C 错误;把两个方程式处理得到:
2H2O2=2H2O+O2,v(H2O2)=v(H2O)=2v(O2),D 错误。
15.(2014·重庆)已知 C(s)+H2O(g)=CO(g)+H2(g) ΔH=akJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-220kJ·mol-1
H-H、O=O 和 O-H 键的键能分别为 436、496 和 462kJ·mol-1,则 a 为( )
A.-332 B.-118 C.+350 D.+130
【答案】D
【解析】设两个热化学方程式分别为①②,根据盖斯定律②-①×2 得:2H2(g)+O2(g)=2H2O(g)
△H=-(220+2a)KJ/mol,则有:2×436+496-4×462= -(220+2a),则 a=+130,答案选 D。
16.(2014·上海)1,3-丁二烯和 2-丁炔分别与氢气反应的热化学方程式如下:
CH2=CH—CH=CH2(g) + 2H2(g) → CH3CH2CH2CH3(g) + 236.6 kJ
CH3-C≡C-CH3(g) + 2H2(g) → CH3CH2CH2CH3(g) + 272.7 kJ
由此不能判断
A.1,3-丁二烯和 2-丁炔稳定性的相对大小
B.1,3-丁二烯和 2-丁炔分子储存能量的相对高低
C.1,3-丁二烯和 2-丁炔相互转化的热效应
D.一个碳碳叁键的键能与两个碳碳双键键能之和的大小
【答案】D
【解析】根据盖斯定律可得 CH2=CH—CH=CH2(g) →CH3-C≡C-CH3(g) —36.1kJ,这说明 1,3-
丁二烯(CH2=CH—CH=CH2(g))转化为 2-丁炔(CH3-C≡C-CH3(g))是吸热反应,故在质量相
等的前提下,1,3-丁二烯(CH2=CH—CH=CH2(g))的能量要低于 2-丁炔(CH3-C≡C-CH3(g))
的能量,1,3-丁二烯(CH2=CH—CH=CH2(g))的稳定性要低于 2-丁炔(CH3-C≡C-CH3(g)),
通过上述分子可知 ABC 均正确。
17.(2014·海南)某反应过程能量变化如图所示,下列说法正确的是
A、反应过程 a 有催化剂参与
B、该反应为放热反应,热效应等于△H
C、改变催化剂,可改变该反应的活化能
D、有催化剂的条件下,反应的活化能等于 E1+E2
【答案】BC
【解析】A、由图可知,反应过程 a 需要的活化能比 b 要高,所以 a 没有催化剂参与,A 错
8
误;B、由图可知,该反应中,反应物的总能量大于生成物的总能量,所以该反应属于放热
反应,反应的热效应等于反应物与生成物能量之差,即△H,B 正确;C、使用催化剂,改变
了反应进行的途径,降低了反应的活化能,C 正确。
18.(2014·海南)标准状况下,气态分子断开 1mol 化学键的焓变称为键焓。已知 H—H,H
—O,和 O==O 键的键焓△H 分别为 436KJ/mol,463KJ/mol,495KJ/mol,下列热化学方程式
正确的是( )
A、H2O(g)==H2(g)+1/2O2(g) △H =—485KJ/mol
B、H2O(g)==H2(g)+1/2O2(g) △H = + 485KJ/mol
C、2 H2(g) + O2(g)==2 H2O(g) △H = + 485KJ/mol
D、2 H2(g) + O2(g)==2 H2O(g) △H =—485KJ/mol
【答案】D
【解析】根据“H—H,H—O,和 O==O 键的键焓△H 分别为 436KJ/mol,463KJ/mol,495KJ/mol”,
可以计算出 2mol H2 和 1mol O2 完全反应生成 2mol H2O(g)产生的焓变是 436KJ/mol×
2+495KJ/mol×1—463KJ/mol×4= —485KJ/mol,所以该过程的热化学方程式为 2 H2(g) +
O2(g)=2 H2O(g) △H = —485KJ/mol,D 正确。
19.(2014·北京)NH3 经一系列反应可以得到 HNO3,如下图所示。
(3)III 中,将 NO2( )转化为 N2 O4( ),再制备浓硝酸。
①已知:2NO2( ) N2O4( )△H1
2NO2( ) N2O4( ) △H2
下列能量变化示意图中,正确的是(选填字母)_______________。
A B C
②N2O4 与 O2、H2O 化合的化学方程式是___ ______________。
【答案】(3)①A ②2N2O4+O2+2H2O=4HNO3
【解析】(3)①降低温度,NO2(g)转变为 N2O4(l),则ΔH2<0,反应物能量高于生成物能量,C
错误;N2O4(g)转变为 N2O4(l)需要放出热量,所以 NO2(g)转变为 N2O4(g)比 NO2(g)转变为 N2O4(l)
放出的热量少,B 错误,所以正确的图示为 A;②N2O4、O2 和 H2O 反应生成硝酸的反应方程式
为 2N2O4+ O2+2H2O===4HNO3。
20.(2014·浙江)煤炭燃烧过程中会释放出大量的 SO2,严重破坏生态环境。采用一定的
9
脱硫技术可以把硫元素以 CaSO4 的形式固定,从而降低 SO2 的排放。但是煤炭燃烧过程中产
生的 CO 又会与 CaSO4 发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g) CaO(s) + SO2(g) + CO2(g) ΔH1=218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g) CaS(s) + 4CO2(g) ΔH2= -175.6kJ·mol-1(反应Ⅱ)
请回答下列问题:
⑴反应Ⅰ能自发进行的条件是。
⑶假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意
图正确的是。
A B C D
【答案】(1)高温 (3)C
【解析】(1)由△G=△H-T△S<0 时自发,△H>0,则 T 要大,故应选择高温。(2)根据固
体的浓度为常数,则反应的平衡常数为 Kp= ;(3)反应 I 为吸热反应,产物的能
量高于反应物,反应Ⅱ放热,产物的能量低于反应物,反应Ⅰ的速率(v1)大于反应Ⅱ的速率
(v2),反应Ⅰ的活化能低。
21.(2012·全国 I)光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温
下 CO 与 Cl2 在活性炭催化下合成。
(2)工业上利用天然气(主要成分为 CH4)与 CO2 进行高温重整制备 CO,已知 CH4、H2 和 CO 的燃
烧热(△H)分别为 —890.3 KJ·mol-1、—285.8 KJ·mol-1、—283.0 KJ·mol-1,则生成 1 m3(标
准状况)CO 所需热量为;
【答案】(2)5.52×103 KJ;
【解析】CH4、H2 和 CO 的燃烧热分别为 890.3 KJ·mol-1、285.8 KJ·mol-1、283.0 KJ·mol-1,
这样很多同学在计算反应热的时候更容易出错。因为反应为 CH4 + CO2 = 2CO + 2H2 △H = 反
应物的燃烧热 - 产物的燃烧热 = + 247.3 KJ/mol,也就是生成 2mol CO,需要吸热 247.3 KJ,
那么要得到 1 立方米的 CO,放热为(1000/22.4)×247.3/2=5.52×103 KJ。
22.(2012·全国 I)反应 A+B →C(△H <0)分两步进行 ① A+B→X (△H >0) ② X
→C(△H <0)下列示意图中,能正确表示总反应过程中能量变化的是
10
【答案】D
【解析】由反应 A+B →C(△H <0)分两步进行 ① A+B→X (△H >0) ② X→C(△H <
0)可以看出,A+B →C(△H <0)是放热反应,A 和 B 的能量之和 C,由① A+B→X (△H
>0)可知这步反应是吸热反应,X→C(△H <0)是放热反应,故 X 的能量大于 A+B;A+B
的能量大于 C,X 的能量大于 C,答案:D。
【点评】本题为图像题,主要考察了物质的能量分析应用,化学反应的能量变化、分析。
23.(2012·江苏)某反应的反应过程中能量变化如右图所示(图中 E1 表示正反应的活化能,
E2 表示逆反应的活化能)。下列有关叙述正确的是
A.该反应为放热反应
B.催化剂能改变反应的焓变
C.催化剂能降低反应的活化能
D.逆反应的活化能大于正反应的活化能
【答案】C
【解析】本题属于化学反应与能量的考查范畴,虽然《2012 年江苏考试说明》中没有提及
“活化能”这一概念,但《选修四》课本第 3 页的绪言中就有这些内容,新课程标准中也有
“活化能”这一概念。看来高三复习一定注意要抓课本、抓基础,抓《考试说明》的同时,
适当兼顾新课程标准,不能急功近利、顾此失彼。
24.(2012·浙江)下列说法正确的是:
A.在 100 ℃、101 kPa 条件下,液态水的气化热为 40.69 kJ·mol-1,则 H2O(g) H2O(l)
的ΔH = 40.69 kJ·mol-1
B.已知 MgCO3 的 Ksp = 6.82 × 10-6,则所有含有固体 MgCO3 的溶液中,都有 c(Mg2+) = c(CO3
2-),
且 c(Mg2+) · c(CO3
2-) = 6.82 × 10-6
C.已知:
共价键 C-C C=C C-H H-H
键能/ kJ·mol-1 348 610 413 436
则可以计算出反应 的ΔH 为-384 kJ·mol-1
D.常温下,在 0.10 mol·L-1 的 NH3·H2O 溶液中加入少量 NH4Cl 晶体,能使 NH3·H2O 的电离
度降低,溶液的 pH 减小
【答案】D
【解析】A 选项中,H2O(g)→H2O(l)是放出热量,则 H2O(g) H2O(l) 的ΔH=-40.69
kJ·mol-1。A 错;B 选项中,难溶电解质 MgCO3 在溶液中的溶解平衡是建立在一定条件下的,
溶度积是难溶解的固相与溶液中相应离子达到平衡时的离子浓度的乘积,只与温度有
关。在一定温度下,MgCO3 达到溶解平衡状态时,是 c(Mg2+)和 c(CO3
2-)保持不变,不是相等,
此时,Ksp( MgCO3)=c(Mg2+)×c(CO3
2-),25℃时 Ksp = 6.82 × 10-6,所以 B 错; C 选项中,
苯 环 上 碳 原 子 间 的 键 是 介 于 单 键 与 双 键 之 间 的 一 种 特 殊 的 键 , 则 反 应
的焓变不能用 C-C 和 C=C 的键能来计算,C 错;D 选项,
常温下,NH3·H2O 溶液中存在着下列电离平衡:NH3·H2O NH4
++OH―,加入少量 NH4Cl 晶
体,由于同离子效应,使平衡向左(逆向)移动,抑制了 NH3·H2O 的电离,从而使 NH3·H2O
11
的电离度降低,溶液的 pH 减小,D 正确。
25.(2012·重庆)已知断裂 1mol 化学键所需的能量(kJ):N≡N 为 942、O=O 为 500、N-N
为 154,则断裂 1molN-H 键所需的能量(KJ)是
A.194 B.391 C.516. D.658
【答案】C
【解析】由图知 N2H4(g)+O2(g)=N2(g)+2H20(g) △H=-534KJ/mol,可设断裂 1molN-H 键所
需能量为 xKJ,154KJ+4xKJ+500KJ-2752KJ=-534KJ 可求得 x=391,故选 B。
26.(2012·浙江)(3)实验测得该反应的ΔH = 50.5 kJ·mol-1,活化能 Ea = 90.4 kJ·mol-1。
下列能量关系图合理的是。
(4)该反应的ΔS0(填“>”、“<”或“=”)。在(填“较高”或“较低”)温度下
有利于该反应自发进行。
【答案】(3)D(4)> 较高
【解析】(3)由实验测得该反应的ΔH = 50.5 kJ·mol-1,可知该反应是吸热反应,则反应
物的总能量低于生成物的总能量。可排除能量关系图B和C,又依据活化能Ea = 90.4 kJ·mol-1,
Ea-ΔH<50.5kJ·mol-1, 能量关系图A中, Ea-ΔH.>50.5 kJ·mol-1,Ea与ΔH的比例不对。而
能量关系图D是合理的。(4)由于该反应是一个分解反应,所以是一个混乱度增加(熵增)
的反应,ΔS >0;而该反应又是一个吸热反应,ΔH>0,所以该反应应在较高温度下有利
于自发进行。
考点二:热化学方程式的书写及盖斯定理
27.(2019·全国Ⅱ)环戊二烯( )是重要的有机化工原料,广泛用于农药、橡胶、
塑料等生产。回答下列问题:
12
(1)已知: (g) (g)+H2(g) ΔH1=100.3 kJ·mol −1 ①
H2(g)+ I2(g) 2HI(g) ΔH2=−11.0 kJ·mol −1 ②
对于反应: (g)+ I2(g) (g)+2HI(g) ③ ΔH3=_______kJ·mol −1。
【答案】(1)89.3
【解析】(1)根据盖斯定律①− ②,可得反应③的ΔH=89.3kJ/mol.
28.(2019·全国Ⅲ)近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也
随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:
(2)Deacon 直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+ Cl2(g) ΔH1=83 kJ·mol− 1
CuCl(s)+ O2(g)=CuO(s)+ Cl2(g) ΔH2=− 20 kJ·mol− 1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=− 121 kJ·mol− 1
则 4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=_________ kJ·mol− 1。
【答案】(2)− 116
【解析】(2)根据盖斯定律知,(反应 I+反应 II+反应 III)×2 得
∆H=(∆H1+∆H2+∆H3)×2=− 116kJ·mol− 1。
29.(2019·北京)氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。
(1)甲烷水蒸气催化重整是制高纯氢的方法之一。
①反应器中初始反应的生成物为 H2 和 CO2,其物质的量之比为 4∶1,甲烷和水蒸气反应的方
程式是______________。
②已知反应器中还存在如下反应:
i.CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1
ii.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2
iii.CH4(g)=C(s)+2H2(g) ΔH3……
iii 为积炭反应,利用ΔH1 和ΔH2 计算ΔH3 时,还需要利用__________反应的ΔH。
【答案】(1)① CH4 + 2H2O= 4H2 + CO2 ②C(s)+CO2(g)=2CO(g)
【解析】(1)①由于生成物为 H2 和 CO2,其物质的量之比为 4:1,反应物是甲烷和水蒸气,
因而反应方程式为 CH4 + 2H2O= 4H2 + CO2;
②ⅰ− ⅱ可得 CH4(g)+CO2(g)=2CO(g)+2H2(g),设为ⅳ,用ⅳ− ⅲ可得 C(s)+CO2(g)=2CO(g),
因为还需利用 C(s)+CO2(g)=2CO(g)反应的焓变。
30.(2019·天津)Ⅰ.硅粉与 在 300℃时反应生成 气体和 ,放出
热量,该反应的热化学方程式为________。 的电子式为_______。
Ⅱ.将 氢化为 有三种方法,对应的反应依次为:
①
13
②
③
(4)反应③的 ______(用 , 表示)。温度升高,反应③的平衡常数 ______
(填“增大”、“减小”或“不变”)。
【答案】
Ⅰ.
Ⅱ.(4) 减小
【解析】I.参加反应的物质是固态的 Si、气态的 HCl,生成的是气态的 SiHCl3 和氢气,反
应条件是 300℃,配平后发现 SiHCl3 的化学计量数恰好是 1,由此可顺利写出该条件下的热
化学方程式:Si(s)+3HCl(g) SiHCl3(g)+H2(g) ∆H=− 225kJ·mol− 1;SiHCl3 中硅
与 1 个 H、3 个 Cl 分别形成共价单键,由此可写出其电子式为: ,注意别漏标 3 个
氯原子的孤电子对;
II.(4)将反应①反向,并与反应②直接相加可得反应③,所以∆H3=∆H2− ∆H1,因∆H2<0、∆
H1>0,所以∆H3 必小于 0,即反应③正反应为放热反应,而放热反应的化学平衡常数随着温度
的升高而减小。
31.(2017·全国I)近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具
有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。
通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为___________、
______________,制得等量H2 所需能量较少的是_____________。
【答案】(2)H2O(l)=H2(g)+ O2(g) ΔH=+286 kJ/mol
H2S(g)=H2(g)+S(s) ΔH=+20 kJ/mol 系统(II)
14
32.(2017·全国II)丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制 1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+ O2(g)= C4H8(g)+H2O(g) ΔH2=−119 kJ·mol−1
③H2(g)+ O2(g)= H2O(g) ΔH3=−242kJ·mol−1
反应①的ΔH1 为________kJ·mol−1。
【答案】(1)+123
【解析】(1)根据盖斯定律,用②式−③式可得①式,因此ΔH1=ΔH2−ΔH3=−119 kJ/mol +242
kJ/mol =+123 kJ/mol。
33.(2017·全国)砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4
等化合物,有着广泛的用途。回答下列问题:
(3)已知:As(s)+ H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+ O2(g)=H2O(l) ΔH2
2As(s)+ O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_________。
【答案】(3)2△H1-3△H2-△H3
【解析】(3)根据盖斯定律,热化学反应As2O5(s) +3H2O(l)= 2H3AsO4(s)可以由反应①×2
-反应②×3-反应③转化得到,则 2△H1-3△H2-△H3。
34.(2017·江苏)通过以下反应可获得新型能源二甲醚(CH3OCH3 )。下列说法不正确...的是
( )
①C(s) + H2O(g) CO(g) + H2 (g) ΔH1 = a kJ·mol−1
②CO(g) + H2O(g) CO2 (g) + H2 (g) ΔH 2 = b kJ·mol−1
15
③CO2 (g) + 3H2 (g) CH3OH(g) + H2O(g) ΔH 3 = c kJ·mol−1
④2CH3OH(g) CH3OCH3 (g) + H2O(g) ΔH 4 = d kJ·mol−1
A.反应①、②为反应③提供原料气
B.反应③也是CO2 资源化利用的方法之一
C.反应CH3OH(g) CH3OCH3 (g) + H2O(l)的ΔH = kJ·mol−1
D.反应 2CO(g) + 4H2 (g) CH3OCH3 (g) + H2O(g)的ΔH = ( 2b + 2c + d ) kJ·mol−1
【答案】C
【名师点睛】本题以合成新能源二甲醚为背景,考查学生对简单化工流程的反应原理、能量
的转化关系、化学反应焓变的概念、盖斯定律的运用等知识的掌握和理解程度,同时关注了
节能减排、工业三废资源化处理、开发利用新能源等社会热点问题。
35.(2017·北京)TiCl4 是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制
备纯TiCl4 的流程示意图如下:
资料:TiCl4 及所含杂质氯化物的性质
化合物 SiCl4 TiCl4 AlCl3 FeCl3 MgCl2
沸点/℃ 58 136 181(升华) 316 1412
熔点/℃ −69 −25 193 304 714
在TiCl4 中的溶解性 互溶 —— 微溶 难溶
(1)氯化过程:TiO2 与Cl2 难以直接反应,加碳生成CO和CO2 可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1
① 沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:_______________________。
【答案】(1)①TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) △H=-45.5 kJ/mol
【解析】(1)①生成TiCl4 和CO的反应方程式为TiO2+2Cl2+2C=TiCl4+2CO,根据盖斯定律,
两式相加,得到TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO (g) △H=ΔH1+ΔH2=(-220.9
kJ·mol-1)+(+175.4 kJ·mol-1)=-45.5kJ·mol-1。
36.(2017·天津)(3)0.1 mol Cl2 与焦炭、TiO2 完全反应,生成一种还原性气体和一种
易水解成TiO2·xH2O的液态化合物,放热 4.28 kJ,该反应的热化学方程式为__________。
【答案】(3)2Cl2(g)+ TiO2(s)+2C(s)=TiCl4(l)+2CO(g) ΔH=−85.6 kJ·mol−1
37.(2016·全国II)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作
16
火箭燃料,回答下列问题:
(3)①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2 N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ΔH 4=-1048.9kJ/mol
上述反应热效应之间的关系式为ΔH4=________________,联氨和N2O4 可作为火箭推进剂的主
要原因为_________________________________________________。
【答案】(3)2ΔH3-2ΔH2-ΔH1 反应放热量大、产生大量气体
38.(2016·江苏)通过以下反应均可获取H2。下列有关说法正确的是( )
①太阳光催化分解水制氢:2H2O(l) ===2H2(g)+ O2(g) ΔH1=571.6kJ·mol–1
②焦炭与水反应制氢:C(s)+ H2O(g) ===CO(g)+ H2(g) ΔH2=131.3kJ·mol–1
③甲烷与水反应制氢:CH4(g)+ H2O(g) ===CO(g)+3H2(g) ΔH3=206.1kJ·mol–1
A.反应①中电能转化为化学能
B.反应②为放热反应
C.反应③使用催化剂,ΔH3 减小
D.反应CH4(g)===C(s)+2H2(g)的ΔH=74.8 kJ·mol–1
【答案】D
【名师点晴】应用盖斯定律进行反应热的简单计算的关键在于设计反应过程, 同时还需要
注意:①参照新的热化学方程式(目标热化学方程式),结合原热化学方程式(一般 2~3 个)
进行 合理“变形”,如热化学方程式颠倒、乘除以某一个数,然后将它们相加、减,得到
目标热化学方程式,求出目标热化学方程式的ΔH与原热化学方程式之间ΔH的换算关系。②
当热化学方程式乘、除以某一个数时,ΔH也应相应地乘、除以某一个数;方程式进行加减
运算时,ΔH也同样要进行加减运算,且要带“+”“-”符号,即把ΔH看作一个整体进行
运算。③将一个热化学方程式颠倒书写时,ΔH的符号也随之改变,但数值不变。④在设计
反应过程中,会遇到同一物质的三态(固、液、气)的相互转化,状态由固→液→气变化时,
会吸热;反之会放热。答题时注意灵活应用。
39.(2016·浙江)催化还原CO2 是解决温室效应及能源问题的重要手段 之一。研究表明,
在Cu/ZnO催化剂存在下,CO2 和H2 可发生两个平行反应,分别生成CH3OH和CO。反应的热化学
方程式如下:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol -1I
CO2(g)+H2(g) CO(g)+H2O(g)ΔH2 反应II
17
已知:①CO和H2 的标准燃烧热分别为-283.0kJ·mol-1 和-285.8kJ·mol-1
②H2O(l)=H2O(g)ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(1)反应II的ΔH2=_______kJ·mol-1。
【答案】(1) +41.2
40.(2016·四川)(5)工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知 25℃,
101kPa时:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) ΔH=-271kJ/mol
5 CaO(s)+3H3PO4(l)+HF(g)= Ca5(PO4)3F (s)+5H2O(l) ΔH=-937kJ/mol
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是_________________。
【答案】(5)Ca5(PO4)3F (s)+ 5H2SO4(l)=5CaSO4(s) +H3PO4(l)+HF(g) ΔH =-418kJ/mol
【解析】(5)已知 25℃,101kPa时:
①CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) ΔH =-271kJ/mol
②5 CaO(s)+3H3PO4(l)+HF(g)= Ca5(PO4)3F (s)+5H2O(l) ΔH =-937kJ/mol
根据盖斯定律:①×5-②得Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是Ca5(PO4)3F (s)+
5H2SO4(l)=5CaSO4(s) +H3PO4(l)+HF(g) ΔH =-418kJ/mol。
41.(2016·天津)下表为元素周期表的一部分。
碳 氮 Y
X 硫 Z
回答下列问题
(4)X与Z两元素的单质反应生成 1molX的最高价化合物,恢复至室温,放热 687kJ,已知该
化合物的熔、沸点分别为-69℃和 58℃,写出该反应的热化学方程式: ____。
【答案】(4)Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol
【解析】根据元素周期表的结构,可知X为Si元素,Y为O元素;Z为Cl元素;
(4)根据书写热化学方程式的方法,该反应的 热化学方程式为Si(s)+2Cl2(g)=SiCl4(l)△
H=-687kJ/mol,故答案为:Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol;
42.(2015·全国II)甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、
CO2 和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
18
由此计算△H1=kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3=kJ·mol-1。
【答案】(1)—99;+41
43.(2015·重庆)黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
S(s)+2KNO3(s)+3C(s)==K2S(s)+N2(g)+3CO2(g) ΔH= x kJ·mol-1
已知硫的燃烧热ΔH1= a kJ·mol-1
S(s)+2K(s)==K2S(s) ΔH2= b kJ·mol-1
2K(s)+N2(g)+3O2(g)==2KNO3(s) ΔH3= c kJ·mol-1
则x为( )
A.3a+b-c B.c +3a-b C.a+b-c D.c+a-b
【答案】A
【解析】已知硫的燃烧热为ΔH1= a kJ·mol-1,则硫的燃烧热化学方程式为,
①S(s)+O2(g)=SO2 (g) ΔH1= a kJ·mol-1 ,
②S(s)+2K(s)==K2S(s) ΔH2= b kJ·mol-1,
③2K(s)+N2(g)+3O2(g)==2KNO3(s) ΔH3= c kJ·mol-1,
根据盖斯定律,可得ΔH =3ΔH1+ΔH2—ΔH3,即x=3a+b-c,答案选A。
44.(2015·安徽)(4)NaBH4(s)与水(l)反应生成NaBO2(s)和氢气(g),在 25℃,
101KPa下,已知每消耗 3.8 克NaBH4(s)放热 21.6kJ,该反应的热化学方程式是_______。
【答案】(4)NaBH4(s)+H2O(l)=NaBO2(s)+H2(g) △H=-216kJ/mol;
【解析】(4)根据物质的量计算,n(NaBH4)=0.1mol,故热方程式为:NaBH4(s)+H2O(l)=
NaBO2(s)+H2(g) △H=-216KJ/mol.
45.(2015·福建)③已知:Al2O3(s)+3C(s)=2Al(s)+3CO(g) ΔH1=+1344.1kJ ·mol-1
2AlCl3(g)=2Al(s)+3Cl2(g) ΔH2=+1169.2kJ ·mol-1
由Al2O3、C和Cl2 反应生成AlCl3 的热化学方程式为。
【答案】③Al2O3(s)+3C(s)+2Cl2(g)=2AlCl3(g)+3CO(g) ΔH=+174.9kJ/mol;
【 解 析 】 ③ 第 一 个 式 子 减 去 第 二 个 式 子 , 整 理 可 得 : Al2O3(s)+3C(s)+2Cl2(g) =
2AlCl3(g)+3CO(g) ΔH=+174.9kJ/mol.
46.(2015·天津)随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大
小、最高正价或最低负价的变化如下图所示。
19
根据判断出的元素回答问题:
(4)已知 1mole的单质在足量d2 中燃烧,恢复至室温,放出 255.5kJ热量,写出该反应的热
化学方程式:___________________。
【答案】(4)2Na(s)+O2(g) =Na2O2(s) △H=-511kJ·mol-1
47.(2015·四川)(4)FeSO4 可转化为FeCO3,FeCO3 在空气中加热反应可制得铁系氧化物材
料。
已知 25℃,101kPa时:4Fe(s) + 3O2 (g) =2Fe2O3(s) =-1648kJ/mol
C(s)+O2(g)=CO2(g) =-393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) =-1480kJ/mol
FeCO3 在空气中加热反应生成Fe2O3 的热化学方程式是。
【答案】(4)4FeCO3(s)+O2(g) =2Fe2O3(s)+ 4CO2(g) =-260kJ/mol。
【解析】(4)发生反应:4FeCO3+O2 2Fe2O3+4CO2,根据盖斯定律,由已知热化学方程
式乘以适当的系数进行加减,构造目标热化学方程式:4FeCO3(s)+O2(g) =2Fe2O3(s)+ 4CO2(g)
=-260kJ/mol。
48.(2015·山东)(3)贮氢合金ThNi5 可催化由CO、H2 合成CH4 的反应,温度为T时,该反
应的热化学方程式为_________。已知温度为T时:CH4(g)+2H2O=CO2(g)+4H2(g) △H=+165KJ
•mol
CO(g)+H2O(g)=CO2(g)+H2( g) △H=-41KJ•mol
【答案】(3)CO(g)+3H2(g)=CH4(g)+H2O(g) ∆H=—206kJ•mol‾1
3
49.(2015·江苏)烟气(主要污染物SO2、NOx)经O3 预处理后用CaSO3 水悬浮液吸收,可减少
烟气中SO2、NOx的含量。O3 氧化烟气中SO2、NOx的主要反应的热化学方程式为:
NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9kJ·mol-1
NO(g)+1/2O2(g)=NO2(g) △H=-58.2kJ·mol-1
20
SO2(g)+O3(g)=SO3(g)+O2(g) △H=-241.6kJ·mol-1
(1)反应 3NO(g)+O3(g)=3NO2(g)的△H=_______mol·L-1。
【答案】(1)-317.3;
【解析】(1)根据盖斯定律①+② ×2 得出 :3NO(g)+O3(g)=3NO2(g) △H=-200.9-58.2
×2kJ·mol-1=-317.3kJ·mol-1.
50.(2015·海南)(3)由N2O和NO反应生成N2 和NO2 的能量变化如图所示,若生成 1molN2,
其△H=kJ·mol-1。
【答案】((3)-139
【解析】(3)根据图像可知N2O与NO反应生成氮气和二氧化氮的反应热为(209-348)
kJ/mol=-109kJ/mol。
51.(2014·全国 I)(1)已知 AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为
167 ℃。室温时 AX3与气体 X2反应生成 lmol AX5,放出热量123.8 kJ。该反应的热化学方程
式为。
【答案】(1)①AX3( )+X2( )=AX5( )△H= —123.8kJ•mol—1
【解析】(1)因为 AX3的熔点和沸点分别为—93.6℃和76℃,AX5的熔点为167℃,室温时,AX3
为液态,AX5为固态,生成1mol AX5,放出热量123.8kJ,该反应的热化学方程为:AX3( )+X2
( )=AX5( )△H= —123.8kJ•mol—1。
52.(2014·上海)1,3-丁二烯和2-丁炔分别与氢气反应的热化学方程式如下:
CH2=CH—CH=CH2(g) + 2H2(g) → CH3CH2CH2CH3(g) + 236.6 kJ
CH3-C≡C-CH3(g) + 2H2(g) → CH3CH2CH2CH3(g) + 272.7 kJ
由此不能判断
A.1,3-丁二烯和2-丁炔稳定性的相对大小
B.1,3-丁二烯和2-丁炔分子储存能量的相对高低
C.1,3-丁二烯和2-丁炔相互转化的热效应
D.一个碳碳叁键的键能与两个碳碳双键键能之和的大小
【答案】D
【解析】根据盖斯定律可得 CH2=CH—CH=CH2(g) →CH3-C≡C-CH3(g) —36.1kJ,这说明1,3-
丁二烯(CH2=CH—CH=CH2(g))转化为2-丁炔(CH3-C≡C-CH3(g))是吸热反应,故在质量相等
的前提下,1,3-丁二烯(CH2=CH—CH=CH2(g))的能量要低于2-丁炔(CH3-C≡C-CH3(g))的
能量,1,3-丁二烯(CH2=CH—CH=CH2(g))的稳定性要低于2-丁炔(CH3-C≡C-CH3(g)),通
过上述分子可知 ABC 均正确。
53.(2014·海南)某反应过程能量变化如图所示,下列说法正确的是
21
A、反应过程 a 有催化剂参与
B、该反应为放热反应,热效应等于△H
C、改变催化剂,可改变该反应的活化能
D、有催化剂的条件下,反应的活化能等于 E1+E2
【答案】BC
【解析】A、由图可知,反应过程 a 需要的活化能比 b 要高,所以 a 没有催化剂参与,A 错
误;B、由图可知,该反应中,反应物的总能量大于生成物的总能量,所以该反应属于放热
反应,反应的热效应等于反应物与生成物能量之差,即△H,B 正确;C、使用催化剂,改变
了反应进行的途径,降低了反应的活化能,C 正确。
54.(2014·海南)标准状况下,气态分子断开1mol 化学键的焓变称为键焓。已知 H—H,H
—O,和 O==O 键的键焓△H 分别为436KJ/mol,463KJ/mol,495KJ/mol,下列热化学方程式
正确的是( )
A、H2O(g)==H2(g)+1/2O2(g) △H =—485KJ/mol
B、H2O(g)==H2(g)+1/2O2(g) △H = + 485KJ/mol
C、2 H2(g) + O2(g)==2 H2O(g) △H = + 485KJ/mol
D、2 H2(g) + O2(g)==2 H2O(g) △H =—485KJ/mol
【答案】D
【解析】根据“H—H,H—O,和 O==O 键的键焓△H 分别为436KJ/mol,463KJ/mol,495KJ/mol”,
可 以 计 算 出 2mol H2 和 1mol O2 完 全 反 应 生 成 2mol H2O(g) 产 生 的 焓 变 是 436KJ/mol ×
2+495KJ/mol×1—463KJ/mol×4= —485KJ/mol,所以该过程的热化学方程式为2 H2(g) +
O2(g)=2 H2O(g) △H = —485KJ/mol,D 正确。
55.(2014·江苏)已知:C(s)+O2(g)=CO2(g) △H1
CO2(g)+C(s)=2CO(g) △H22CO(g)+O2(g)=2CO2(g) △H3
4Fe(s)+3O3(g)=2Fe2O3(s) △H43 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A.△H1>0,△H3<0
B.△H2>0,△H4>0
C.△H1=△H2+△H3
D.△H3=△H4+△H5
【答案】C
【解析】根据反应特点,碳燃烧放热,△H1<0,二氧化碳和碳反应吸热,△H2>0,CO 燃烧放
热,△H3<0铁和氧气反应放热△H4<0,CO 还原氧化铁放热,△H5<0;△H1=△H2+△H3 ,C 正确;
根据反应3△H3=2△H4 +2△H3 ,D 错误。
56.(2014·安徽)(3)CuCl(s)与 O2反应生成 CuCl2(s)和一种黑色固体。在25℃、101KPa
下,已知该反应每消耗1 mol CuCl(s),放出44.4KJ,该反应的热化学方程式是。
【答案】(3)4CuCl(s)+O2(g)=2CuCl2(s)+2CuO(s) △H= 177.6KJ/mol(合理答案均给分)
22
【解析】(3)根据热化学方程式的书写方法,可以写出该反应的热化学方程式为
4CuCl(s)+O2(g)=2CuCl2(s)+2CuO(s) △H= 177.6KJ/mol.
57.(2014·福建)元素周期表中第 VIIA 族元素的单质及其化合物的用途广泛。
(4)一定条件,在水溶液中1 mol Cl-、ClO-(x=1,2,3,4)的能量(KJ)相对大小如右图
所示。
①D 是(填离子符号)。
②B→A+C 反应的热化学方程式为(用离子符号表示)。
【答案】(4)①ClO4
— ②3 ClO—( )==ClO3
—( )+2Cl—( ) △H= 117KJ·mol—1
【解析】(4)根据图像,D 物质中化合价为+7,则 D 是 ClO4
—则根据化合价可得反应方程式
为:3 ClO—( )==ClO3
—( )+2Cl—( ) △H=63+0-3×60=-117 KJ·mol—1。
58.(2014·广东)用 CaSO4代替 O2与燃料 CO 反应,既可提高燃烧效率,又能得到高纯 CO2,
是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
① CaSO4(s)+CO(g) CaS(s)+CO2(g) ∆H1= —47.3kJ∙mol-1
② CaSO4(s)+CO(g) CaO(s)+CO2(g) +SO2(g) ∆H2= +210.5kJ∙mol-1
③ CO(g) C(s)+ CO2(g) ∆H3= —86.2kJ∙mol-1
( 1 ) 反 应 2CaSO4(s)+7CO(g) CaS(s)+ CaO(s)+6CO2(g)+ C(s) +SO2( g) 的 ∆ H =
___________(用∆H1、∆H2和∆H3表示)
【答案】(1)∆H=4∆H1+∆H2+2∆H3
【解析】(1)根据盖斯定律,①×4+②+③×2得:2CaSO4(s)+7CO(g) CaS(s )+
CaO(s)+6CO2(g)+ C(s) +SO2(g),所以∆H=4∆H1+∆H2+2∆H3;
59.(2014·全国 I)乙酸是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法
生产。回答下列问题:(2)已知:
甲醇脱水反应 2CH3OH(g)==CH3OCH3(g)+ H2O (g) = 23.9 KJ﹒mol-1
甲醇制烯烃反应 2CH3OH(g)== C2H4(g)+ 2H2O (g) = 29.1 KJ﹒mol-1
乙醇异构化反应 C2H5OH (g) ==CH3OCH3(g) =+50.7KJ﹒mol-1
23
则乙烯气相直接水合反应 C2H4(g)+H2O(g)==C2H5OH(g)的 =______KJ﹒mol-1。与间接水合
法相比,气相直接水合法的优点是________________。
【答案】(2)—45.5;减少污染;减少对设备的腐蚀。
【解析】(2)通过盖斯定律,—△H2+△H1-△H3=—45.5KJ·mol-1,比较两种流程,可看
出气相直接水合法减少反应步骤,增大产物的产率,同时减少污染物的排放;不用硫酸作反
应物,减少对设备的腐蚀。
60.(2013·全国Ⅰ)二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成
为 H2、CO 和少量的 CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:
(Ⅰ)CO(g)+2H2(g)===CH3OH (g) ΔH1=-90.1 kJ·mol-1
(Ⅱ)CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH2=-49.0 kJ·mol-1
水煤气变换反应:
(Ⅲ)CO(g)+H2O(g)===CO2(g)+H2(g) ΔH3=-41.1 kJ·mol-1
二甲醚合成反应:
(Ⅳ)2CH3OH(g)===CH3OCH3(g)+H2O(g) ΔH4=-24.5 kJ·mol-1
回答下列问题:
(3)由 H2 和 CO 直接制备二甲醚(另一产物为水蒸气)的热化学方程式为__________。
【答案】(3)2CO(g)+4H2(g)===CH3OCH3(g)+H2O(g) ΔH=-204.7 kJ·mol-1
【解析】((3)由盖斯定律(Ⅰ)×2+(Ⅳ)得:4H2(g)+2CO(g)===CH3OCH3(g)+H2O(g) ΔH=-
204.7 kJ·mol-1。
61.(2013·全国卷Ⅱ)在 1200 ℃时,天然气脱硫工艺中会发生下列反应:
H2S(g)+
3
2O2(g)===SO2(g)+H2O(g) ΔH1;2H2S(g)+SO2(g)===
3
2S2(g)+2H2O(g) ΔH2;
H2S(g)+
1
2O2(g)===S(g)+H2O(g) ΔH3;2S(g)===S2(g) ΔH4。
则ΔH4 的正确表达式为( )
A.ΔH4=
2
3(ΔH1+ΔH2-3ΔH3)
B.ΔH4=
2
3(3ΔH3-ΔH1-ΔH2)
C.ΔH4=
3
2(ΔH1+ΔH2-3ΔH3)
D.ΔH4=
3
2(ΔH1-ΔH2-3ΔH3)
【答案】A
【解析】将方程式依次标号①~④,可知反应④是通过方程式叠加得到:(②+①)×
2
3-③
×2,那么:ΔH4=(ΔH2+ΔH1)×
2
3-ΔH3×2=
2
3(ΔH2+ΔH1-3ΔH3),A 项正确。
62.(2013·江苏)磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如
Ca3(PO4)2 等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由 Ca3(PO4)2、焦炭和 SiO2 在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)===6CaO(s)+P4(s)+10CO(g) ΔH1=+3359.26 kJ·mol-1
24
CaO(s)+SiO2(s)===CaSiO3(s) ΔH2=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)===6CaSiO3(s)+P4(s)+10CO(g) ΔH3
则ΔH3=______________kJ·mol-1。
【答案】(1)2821.6
【解析】(1)依据盖斯定律,将“上式+下式×6”,即得所求反应的ΔH=+3359.26 kJ·mol
-1+(-89.61 kJ·mol-1)×6=2821.6 kJ·mol-1。
63.(2013·浙江)捕碳技术(主要指捕获 CO2)在降低温室气体排放中具有重要的作用。目
前 NH3 和(NH4)2CO3 已经被用作工业捕碳剂,它们与 CO2 可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g) (NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g) NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g) 2NH4HCO3(aq) ΔH3
请回答下列问题:
(1)ΔH3 与ΔH1、ΔH2 之间的关系是:ΔH3=________。
【答案】 (1)2ΔH2-ΔH1
【解析】 (1)根据盖斯定律可得出,将“反应Ⅱ×2-反应Ⅰ”,即得反应Ⅲ,所以ΔH3=2
ΔH2-ΔH1。
64.(2013·安徽) X、Y、Z、W 是元素周期表中原子序数依次增大的四种短周期元素,其
相关信息如下表:
元素 相关信息
X X 的最高价氧化物对应的水化物化学式为 H2XO3
Y Y 是地壳中含量最高的元素
Z Z 的基态原子最外层电子排布式为 3s23p1
W W 的一种核素的质量数为 28,中子数为 14
(4)在 25 ℃、101 kPa 下,已知 13.5 g 的 Z 固体单质在 Y2 气体中完全燃烧后恢复至原状态,
放热 419 kJ,该反应的热化学方程式是__________________。
【答案】(4)4Al(s)+3O2(g)===2Al2O3(s) ΔH=-3352 kJ·mol-1(其他合理答案均可)
【解析】利用 X 的信息知其为ⅣA 族元素,Y 是地壳中含量最高的元素,故 Y 为氧元素,结
合 X、Y、Z、W 是原子序数依次增大的短周期元素可知 X 为碳元素;Z 的基态原子的电子排
布式为 3s23p1,则 Z 为 13 号元素铝;W 元素的一种核素的质量数为 28,中子数为 14,则质
子数为 14,则 W 为硅元素。。(4)13.5 g Al 物质的量为 0.5 mol,由题中数据可知 4 mol Al
与氧气完全反应生成固态 Al2O3 时,放出热量为 419 kJ×
4 mol
0.5 mol=3352 kJ。
65.(2013·广东)大气中的部分碘源于 O3 对海水中 I-的氧化。将 O3 持续通入 NaI 溶液中进
行模拟研究。
(1)O3 将 I-氧化成 I2 的过程由 3 步反应组成:
①I-(aq)+O3(g)===IO-(aq)+O2(g) ΔH1;
②IO-(aq)+H+(aq)===HOI(aq) ΔH2;
③HOI(aq)+I-(aq)+H+(aq)===I2(aq)+H2O(l) ΔH3。
总反应的化学方程式为________,其反应热ΔH=________。
【答案】(1)2NaI+O3+H2SO4===Na2SO4+I2+O2+H2O 或 2NaI+O3+H2SO4===Na2SO4+I2+O2+H2O
等 ΔH1+ΔH2+ΔH3
【解析】(1)臭氧在酸性条件下将碘离子氧化成碘单质的过程由 3 步反应组成,观察已知 3
个热化学方程式中的反应物和生成物,发现①+②+③可以得出总反应的热化学方程式为 2
I-(aq)+O3(g)+2H+(aq)===I2(aq) +O2(g)+H2O(l),根据盖斯定律可得其焓变ΔH=ΔH1+
25
ΔH2+ΔH3;氢离子表示强酸如硫酸等,将臭氧持续通入 NaI 溶液中,总反应的化学方程式
是 2NaI+O3+H2SO4===Na2SO4+I2+O2+H2O 或 2NaI+O3+H2SO4===Na2SO4+I2+O2+H2O 等。
66.(2013·天津)(2)为减少 SO2 的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:H2(g)+
1
2O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
C(s)+
1
2O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式:_______。
【答案】(2)①C(s)+ H2O(g)===CO(g)+ H2(g) ΔH= +131.3 kJ·mol-1
【解析】(2)①第 2 个方程式减第 1 个方程式得目标反应的热化学方程式为 C(s)+
H2O(g)===CO(g)+H2(g) ΔH=+131.3 kJ·mol-1。
67.(2013·北京)(2)汽车发动机工作时会引发 N2 和 O2 反应,其能量变化示意图如下:
――→
2NO(g)
――→
2N(g)
――→
2O(g)
①写出该反应的热化学方程式:_____________________。
【答案】(2)①N2(g)+O2(g)===2NO(g) ΔH=+183 kJ·mol-1
【解析】(2)①N2(g)+O2(g)===2NO(g) ΔH=945 kJ·mol-1+498 kJ·mol-1-2×630 kJ·mol
-1=+183 kJ·mol-1。
68.(2012·广东)碘也可用作心脏起搏器电源—锂碘电池的材料。该电池反应为:
2Li(s)+I2(s)=2LiI (s) △H
已知:4Li(s)+O2(g)=2Li2O(s) △H1
4 LiI(s)+O2(g)=2I2(s)+2Li2O(s) △H2
则电池反应的△H=_________;碘电极作为该电池的___________极。
【答案】(△H1-△H2)/2; 负极
【解析】利用盖斯定律可计算△H=(△H1-△H2)/2;碘失去电子作负极。
69.(2012·天津)X、Y、Z、M、G 五种元素分属三个短周期,且原子序数依次增大。X、Z
同主族,可形成离子化合物 ZX;Y、M 同主族,可形成 MY2、MY3 两种分子。
⑷ X2M 的燃烧热ΔH = -a kJ·mo l - 1 ,写出 X2M 燃烧反应的热化学方程式:________。
【答案】2H2S(g)+3O2(g)=2 SO2(g)+2H2O(l), △H=-2aKJ·mol-1
【解析】该题考察物质结构元素周期律、热化学方程的书写、电化学等基本理论知识。由已
知条件首先推断X、Y、Z、M、G元素分别为H、O、Na、S、Cl。(4)根据燃烧热的含义,写H2S
燃 烧 的 热 化 学 方 程 式 生 成 物 应 该 生 成 SO2,2H2S(g)+3O2(g)=2SO2(g)+2H2O(l), △
H=-2aKJ·mol-1
70.(2012·天津)金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。
高温下,在密闭容器中用 H2 还原 WO3 可得到金属钨,其总反应为:WO3 (s) + 3H2 (g)
W (s) + 3H2O (g)
⑷ 已知:温度过高时,WO2 (s)转变为 WO2 (g);
WO2 (s) + 2H2 (g) W (s) + 2H2O (g);ΔH = +66.0 kJ·mo l -1
WO2 (g) + 2H2 W (s) + 2H2O (g);ΔH = -137.9 kJ·mol -1
则 WO2 (s) WO2 (g) 的ΔH = _______________。
【答案】+203.9KJ.mol-1
【解析】利用盖斯定律可计算△H=+203.9KJ.mol-1.
71.(2012·北京)(1)已知:Ⅰ反应 A 中, 4mol HCI 被氧化,放出 115.6kJ 的热量。
26
H2O 的电子式是_______________.
②反应 A 的热化学方程式是_______________。
③断开 1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为__________KJ, 中
H—O 键比 HCl 中 H—Cl 键(填“强”或“若”)_______________。
【 答 案 】 ⑴ ① (1 分 ) ② 4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) △ H= —
115.6kJ/mol(2 分)
【解析】(1)由题给条件可知,4molHCl被氧化,放出热量为115.6KJ,可知∆H=—115.6KJ/mol;
由∆H=—(生成物键能之和—反应物键能之和)可得,E(H—O)—E(H—Cl)=〔115.6+(498
—(2×243))/4=31.9,键能越大化学键越稳定越强,所以水中的H—O键比氯化氢中H
—Cl强。
72. (2012·海南)(3)肼可作为火箭发动机的燃料,与氧化剂 N2H4 反应生成 N2 和水蒸气。
已知:①N2(g)+2O2(g)= N2H4 (1) △H1= -195kJ·mol-1
② (1) + O2(g)= N2(g) + 2 H2O △H2= -534.2kJ·mol-1
写出肼和 N2H4 反应的热化学方程式;
【答案】(3)2N2H4 (1)+N2O4(1)==3N2(g)+4H2O(g) △H= -1048.9kJ·mol-1
【解析】(3)肼与 N2O4 反应生成 N2 和水蒸气:2N2H4 +N2O4==3N2+4H2O,观察已知的两个热方程
式 可 知 , ② × 2- ① 得 : 2N2H4 (1)+N2O4(1)==3N2(g)+4H2O(g) △ H= △ H2 × 2- △ H1==
-1048.9kJ·mol-1。