- 291.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时作业(十)
1.碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)已知反应H2(g)+I2(g)2HI(g) ΔH=-11 kJ·mol-1,1 mol H2(g)、1 mol HI(g)分子中化学键断裂时分别需要吸收436 kJ、299 kJ的能量,则1 mol I2(g)分子中化学键断裂时需吸收的能量为________。
(2)在密闭容器中发生反应H2(g)+I2(g)2HI(g)。如图表示不同温度T1、T2下平衡时HI(g)的体积分数随起始n(H2)∶n(I2)的变化关系。
①反应温度:T1________T2(填“>”“<”或“=”),A点对应的n(H2)∶n(I2)=________。
②维持B点温度和起始n(H2)∶n(I2)不变,欲加快该化学反应速率,则可采取的措施有________、________。
(3)Bodensteins研究了下列反应:2HI(g)H2(g)+I2(g),在730 K时,向密闭容器中投入HI,气体混合物中H2的物质的量分数x(H2)与反应时间t的关系如下表:
t/min
0
20
40
60
100
120
x(H2)
0
0.05
0.08
0.09
0.10
0.10
①40 min时,HI的转化率为________,根据上述实验结果,温度为730 K时该反应的平衡常数K=________。
②上述反应中,反应速率v=v正-v逆=k正·x2(HI)-k逆·x(H2)x(I2),k正、k逆分别为正、逆反应速率常数,x为物质的量分数。计算20 min时,=________(结果保留2位小数)。
答案 (1)151 kJ
(2)< 1∶1 增大压强(或缩小容器容积) 加入适当的催化剂
(3)16% 5.06
解析 (1)设I2(g)的键能为x,根据ΔH=反应物的总键能-生成物的总键能=436 kJ·mol-1+x-2×299 kJ·mol-1=-11 kJ·mol-1,解得x=151 kJ·mol-1,则1 mol I2(g)分子中化学键断裂时需吸收的能量为151 kJ。
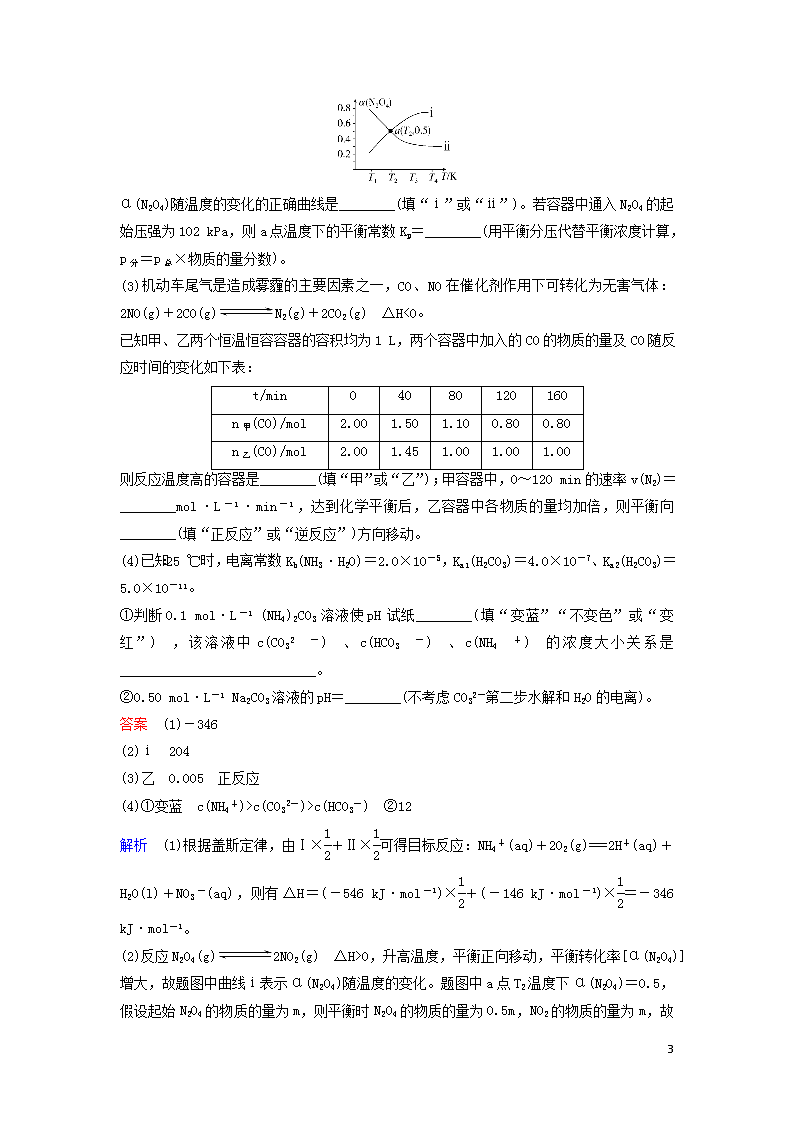
(2)①由题图可知,A点碘化氢的体积分数大于B点,又因H2(g)+I2(g)2HI(g) ΔH=-11 kJ·mol-1的正反应为放热反应,温度升高,平衡逆向移动,碘化氢的体积分数减小,所以反应温度:T10。在恒容密闭容器中充入一定量的N2O4,发生上述反应。测得N2O4的平衡转化率[α(N2O4)]随温度的变化为图中的某条曲线:
11
α(N2O4)随温度的变化的正确曲线是________(填“ⅰ”或“ⅱ”)。若容器中通入N2O4的起始压强为102 kPa,则a点温度下的平衡常数Kp=________(用平衡分压代替平衡浓度计算,p分=p总×物质的量分数)。
(3)机动车尾气是造成雾霾的主要因素之一,CO、NO在催化剂作用下可转化为无害气体:2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH<0。
已知甲、乙两个恒温恒容容器的容积均为1 L,两个容器中加入的CO的物质的量及CO随反应时间的变化如下表:
t/min
0
40
80
120
160
n甲(CO)/mol
2.00
1.50
1.10
0.80
0.80
n乙(CO)/mol
2.00
1.45
1.00
1.00
1.00
则反应温度高的容器是________(填“甲”或“乙”);甲容器中,0~120 min的速率v(N2)=________mol·L-1·min-1,达到化学平衡后,乙容器中各物质的量均加倍,则平衡向________(填“正反应”或“逆反应”)方向移动。
(4)已知:25 ℃时,电离常数Kb(NH3·H2O)=2.0×10-5,Ka1(H2CO3)=4.0×10-7、Ka2(H2CO3)=5.0×10-11。
①判断0.1 mol·L-1 (NH4)2CO3溶液使pH试纸________(填“变蓝”“不变色”或“变红”),该溶液中c(CO32-)、c(HCO3-)、c(NH4+)的浓度大小关系是____________________________。
②0.50 mol·L-1 Na2CO3溶液的pH=________(不考虑CO32-第二步水解和H2O的电离)。
答案 (1)-346
(2)ⅰ 204
(3)乙 0.005 正反应
(4)①变蓝 c(NH4+)>c(CO32-)>c(HCO3-) ②12
解析 (1)根据盖斯定律,由Ⅰ×+Ⅱ×可得目标反应:NH4+(aq)+2O2(g)===2H+(aq)+H2O(l)+NO3-(aq),则有ΔH=(-546 kJ·mol-1)×+(-146 kJ·mol-1)×=-346 kJ·mol-1。
(2)反应N2O4(g)2NO2(g) ΔH>0,升高温度,平衡正向移动,平衡转化率[α(N2O4)]增大,故题图中曲线ⅰ表示α(N2O4)随温度的变化。题图中a点T2温度下α(N2O4)=0.5,假设起始N2O4的物质的量为m,则平衡时N2O4的物质的量为0.5m,NO2的物质的量为m,
11
故平衡时N2O4、NO2的物质的量分数分别为、。起始压强为102 kPa,根据阿伏加德罗定律及推论可知,恒温恒容时,气体的压强之比等于其物质的量之比,则有=,解得p平衡=153 kPa,故N2O4、NO2的平衡分压分别为×153 kPa=51 kPa、×153 kPa=102 kPa,因此a点温度下的平衡常数Kp===204。
(3)反应2NO(g)+2CO(g)N2(g)+2CO2(g)的ΔH<0,升高温度,平衡逆向移动,反应物的转化率降低;对比表中数据,甲容器中反应达到平衡时所用时间长,平衡时n(CO)小,说明甲容器的温度低于乙容器。甲容器中0~120 min内消耗1.20 mol CO,同时应生成0.60 mol N2则有v(N2)==0.005 mol·L-1·min-1。达到化学平衡后,乙容器中各物质的量均加倍,与保持各物质的量不变、缩小容器容积至原来一半是等效平衡,而缩小容积相当于增大压强,平衡向正反应方向移动。
(4)①(NH4)2CO3溶液中NH4+、CO32-均存在水解平衡:NH4++H2ONH3·H2O+H+、CO32-+H2OHCO3-+OH-,则水解平衡常数Kh(NH4+)===5×10-10,Kh(CO32-)===2×10-4,则有Kh(NH4+)c(CO32-)>c(HCO3-)。②0.50 mol·L-1 Na2CO3溶液中存在水解平衡:CO32-+H2OHCO3-+OH-,由于CO32-的水解程度很小,近似处理:c(HCO3-)≈c(OH-),c(CO32-)≈0.50 mol·L-1,又因Kh(CO32-)=2×10-4,则有Kh(CO32-)≈==2×10-4,解得c(OH-)=1×10-2 mol·L-1,此时溶液中c(H+)== mol·L-1=1×10-12 mol·L-1,故溶液的pH=12。
3.研究碳氧化合物、氮氧化合物、硫氧化合物等大气污染物的处理对缓解环境污染、能源危机具有重要意义。
(1)已知:C(s)+O2(g)CO2(g)ΔH=-393.5 kJ·mol-1
N2(g)+O2(g)2NO(g) ΔH=+180 kJ·mol-1
则C(s)+2NO(g)CO2(g)+N2(g)的ΔH=________kJ·mol-1。
(2)用焦炭还原NO2的反应为2C(s)+2NO2(g)N2(g)+2CO2(g),向两个容积均为2 L、反应温度分别为T1 ℃、T2℃的恒温恒容密闭容器中分别加入足量的焦炭和一定量的NO2,测得各容器中n(NO2)随反应时间t的变化情况如图所示:
11
①T1________T2(填“>”或“<”),该反应为________(填“放热”或“吸热”)反应。
②T2 ℃时,40~80 min,用N2的浓度变化表示的平均反应速率v(N2)=________,此温度下的化学平衡常数K=________。
③T2 ℃下,120 min时,向容器中再加入焦炭和NO2各1 mol,在t时刻达到平衡,此时NO2的转化率比原平衡时________(填“增大”“减小”或“不变”)。
(3)工业上消除氮氧化物的常用方法是SCR(选择性催化还原)脱硝法,反应原理为4NH3(g)+4NO(g)+O2(g)===4N2(g)+6H2O(g) ΔH<0
①SCR法除NO,投料比一定时有利于提高NO平衡转化率的反应条件是________、________。
当反应温度过高时,会发生以下副反应:
2NH3(g)+2O2(g)===N2O(g)+3H2O(g)
4NH3(g)+5O2(g)===4NO(g)+6H2O(g)
②某科研小组通过系列实验,分析得出脱硝率与氨氮比[NH3/NOx表示氨氮比]、温度的关系如图所示,从图甲可以看出,最佳氨氮比为2.0,理由是___________________________ ____________________________________________________________________________;
由图乙可知,当温度高于405 ℃后,脱硝率会逐渐减小,原因是______________________ __________________________________________________。
答案 (1)-573.5
(2)①> 放热 ②0.002 5 mol·L-1·min-1 0.675 ③减小
11
(3)①降低温度 减小压强 ②氨氮比从2.0增大到2.2时,脱硝率的变化不大,但氨的浓度增加较大,导致生产成本提高 当温度过高时,会发生副反应
解析 (1)将题给两个热化学方程式依次编号为①、②,根据盖斯定律,由①-②可得:C(s)+2NO(g)CO2(g)+N2(g),则有ΔH=(-393.5 kJ·mol-1)-(+180 kJ·mol-1)=-573.5 kJ·mol-1。
(2)①由题图可知,T1时反应先达到平衡状态,则T1时反应速率快,温度高,则有:T1>T2;T1时反应达到平衡状态时的n(NO2)大于T2时反应达到平衡状态时的n(NO2),说明温度升高,平衡逆向移动,则该反应为放热反应。②由题图可知,T2 ℃时,40~80 min,n(NO2)由1.50 mol降低到1.10 mol,同时生成0.20 mol N2,则40~80 min,N2的平均反应速率v(N2)==2.5×10-3 mol·L-1·min-1;T2 ℃时,反应达到平衡状态时n(NO2)=0.80 mol,c(NO2)==0.4 mol·L-1,按“三段式法”计算:
2C(s)+2NO2(g)N2(g)+2CO2(g)
起始浓度/(mol·L-1) 1.00 0 0
转化浓度/(mol·L-1) 0.60 0.30 0.60
平衡浓度/(mol·L-1) 0.40 0.30 0.60
平衡常数K===0.675。
③T2 ℃下,120 min时再加入1 mol焦炭和1 mol NO2,相当于增大体系压强,平衡逆向移动,在t时刻达到平衡状态,此时NO2的转化率比原平衡时减小。
(3)①投料比一定时,为提高NO平衡转化率,应使平衡正向移动,可采取的措施有降低温度、减小压强等。②由题图甲可知,氨氮比从2.0升高到2.2时,脱硝率的变化不大,但氨浓度增加较大,若提高氨氮比会导致生产成本增加,经济效益降低;温度高于405 ℃时,NH3会发生副反应,导致NOx的脱除率逐渐减小。
4.Ⅰ.已知:①NaHCO3(s)===Na+(aq)+HCO3-(aq)ΔH1=+18.81 kJ·mol-1
②Na2CO3(s)===2Na+(aq)+CO32-(aq)ΔH2=-16.44 kJ·mol-1
③2NaHCO3(s)===Na2CO3(s)+CO2(g)+H2O(l)ΔH3=+92.34 kJ·mol-1
请回答下列问题:
(1)资料显示,NaHCO3固体加热到100 ℃发生分解,但是加热NaHCO3溶液时,不到80 ℃就有大量CO2气体放出。从反应热的角度说明原因:________________________________ ________________________________________。
(2)NaHCO3溶液中主要存在2种化学平衡:a.HCO3-+H2OH2CO3+OH-,b.2HCO3-CO32-+H2O+CO2↑。根据理论计算得0.10 mol·L-1 NaHCO3溶液中2个反应的转化率随温度变化如图甲所示(不考虑相互影响):
11
①25 ℃ 0.10 mol·L-1 NaHCO3溶液中CO2与H2CO3的总浓度最大可能为________mol·L-1。
②加热蒸干NaHCO3溶液最后得到的固体是________。
③25 ℃时0.10 mol·L-1 NaHCO3溶液的pH=8.3,加热到4 min溶液沸腾,然后保温到7 min。已知常温下Na2CO3溶液的浓度和pH的关系如下表(忽略温度对Kw的影响):
c/(mol·L-1)
饱和
0.20
0.10
0.010
0.001 0
pH
12.1
11.8
11.5
11.1
10.6
请在图乙中作出NaHCO3溶液的pH随时间变化曲线。
Ⅱ.研究得出当甲烷分解时,几种气体平衡时分压(Pa)的对数与温度(℃)的关系如图丙所示。
(3)T ℃时,向1 L恒容密闭容器中充入0.3 mol CH4,只发生反应2CH4(g)C2H4(g)+2H2(g),达到平衡时,c(C2H4)=c(CH4),CH4的平衡转化率为________;上述平衡状态的某一时刻,若改变温度至T2 ℃,CH4以0.01 mol·L-1·s-1的平均速率增加,经t s后再次达到平衡,且平衡时,c(CH4)=2c(C2H4),则t=________s。
(4)列式计算反应2CH4(g)C2H2(g)+3H2(g)在图丙中温度为A时的平衡常数K=________(用平衡分压代替平衡浓度计算,lg0.05=-1.3)。
(5)由图丙可知,甲烷裂解制乙炔时有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有________________。
答案 Ⅰ.(1)2HCO3-(aq)===CO32-(aq)+CO2(g)+H2O(l) ΔH=+38.28 kJ·mol-1,HCO3-为液态时反应需要的能量比固态时小(其他合理的说法也给分)
11
(2)①1.7×10-3 ②Na2CO3
Ⅱ.(3)66.7% 5 (4)5.0×104
(5)充入适量的乙烯
解析 (1)根据已知条件及盖斯定律,由③+②-2×①可得热化学方程式:2HCO3-(aq)===CO32-(aq)+CO2(g)+H2O(l) ΔH=+92.34 kJ·mol-1+(-16.44 kJ·mol-1)-2×(+18.81 kJ·mol-1)=+38.28 kJ·mol-1。加热固体NaHCO3放出CO2气体的反应热ΔH3=+92.34 kJ·mol-1;而加热NaHCO3溶液放出CO2气体的反应热ΔH=+38.28 kJ·mol-1,说明NaHCO3溶液受热分解放出CO2时需要的能量比固体低。
(2)①根据题图甲可知,25 ℃时,反应a中HCO3-的转化率为0.2%,即生成H2CO3的浓度为0.10 mol·L-1×0.2%=2×10-4 mol·L-1,25 ℃时,反应b中HCO3-的转化率为3.0%,即生成CO2的浓度为0.10 mol·L-1×3.0%×=1.5×10-3 mol·L-1,所以25 ℃ 0.10 mol·L-1 NaHCO3溶液中CO2与H2CO3的总浓度最大可能为2×10-4 mol·L-1+1.5×10-3 mol·L-1=1.7×10-3 mol·L-1。②加热蒸干NaHCO3溶液,NaHCO3受热分解生成Na2CO3、CO2和水,所以最后得到的固体是Na2CO3。③根据已知条件,碳酸氢钠溶液的起始pH为8.3,所以曲线的起点为(0,8.3),加热过程中碳酸氢钠会分解为碳酸钠,溶液的pH增大,加热到4 min溶液沸腾,说明碳酸氢钠分解为碳酸钠,此时碳酸钠的浓度为0.05 mol·L-1,由表格中数据可知,碳酸钠的浓度是0.10 mol·L-1时,溶液的pH为11.5,浓度是0.010 mol·L-1时,溶液的pH为11.1,即4 min时,碳酸钠溶液的pH为11.1到11.5之间;4~7 min内,pH变化不大。据此画出曲线。
Ⅱ.(3)根据方程式2CH4(g)C2H4(g)+2H2(g),假设达到平衡时,生成n(C2H4)为x,则有:
2CH4(g)C2H4(g)+2H2(g)
起始量/mol 0.3 0 0
转化量/mol 2x x 2x
平衡量/mol 0.3-2x x 2x
由于恒容密闭容器的容积不变,且达到平衡时,c(C2H4)=c(CH4),则n(C2H4)=n(CH4),x=0.3-2x,解得x=0.1 mol,甲烷的转化率为×100%≈66.7%;从题图丙可知,
11
温度升高,甲烷的分压增大,平衡逆向移动,甲烷的物质的量增加,则T2>T,假设再次平衡时乙烯的物质的量是y,则甲烷的物质的量是2y,因此0.1+2×(0.1-y)=2y,解得y=0.075 mol,说明甲烷的物质的量增加了0.075 mol×2-0.1 mol=0.05 mol,即浓度增加了0.05 mo1·L-1,所以时间t==5 s。
(4)根据题图丙可知,温度为A时,平衡时甲烷、氢气、乙炔的分压分别是103、104、0.05,所以该温度下的平衡常数K===5.0×104。
(5)根据方程式可知,增大乙烯的浓度,可使反应2CH4(g)C2H4(g)+2H2(g)的平衡逆向移动,甲烷的浓度增大,从而使反应2CH4(g)C2H2(g)+3H2(g)平衡正向移动,乙炔的浓度增大,故可通入适量的乙烯以提高制乙炔的转化率。
5.2018年张家口市公交行业迈入氢能源时代,为绿色冬奥再添新“绿”。“制氢”“储氢”“用氢”一直都是能源研究的热点。工业上制取H2有多种方法,如:
①C(s)+H2O(g)===CO(g)+H2(g)ΔH1=+131.5 kJ·mol-1
②CH4(g)+H2O(g)===CO(g)+3H2(g)ΔH2=+206.2 kJ·mol-1
③CH4(g)+CO2(g)===2CO(g)+2H2(g)ΔH3=+247.4 kJ·mol-1
④2H2O(g)===2H2(g)+O2(g)ΔH4=+483.6 kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为_______________ ____________________________________________________________________________。
(2)镧镍合金是一种良好的储氢材料,在一定条件下通过如下反应实现储氢:LaNi3(s)+3H2(g)LaNi3H6(s) ΔH<0。某实验室模拟该过程,向容积一定的密闭容器中充入反应物发生反应。H2的平衡转化率与其初始加入量(n)、反应温度(T)的关系如图甲所示;一定温度下,容器内的压强(p)随时间(t)的变化关系如图乙所示。
11
①图甲中H2初始充入量最大的是________(填“n1”“n2”或“n3”)。
②该反应平衡常数的大小关系为K(T1)________(填“>”“<”或“=”)K(T2),理由是________________________________________________________________________
________________________________________________________________________。
③保持温度不变,在t6时刻将容器的容积压缩至原容积的一半,并在t9时刻达到平衡。请在图乙中画出相应的变化曲线。
(3)氢气燃料电池能大幅度提高能量的转化率。相同条件下,其能量密度(能量密度之比等于单位质量的可燃物转移电子数之比)是甲醇燃料电池的________倍(计算结果保留两位有效数字)。
(4)科学家研发的“全氢电池”的工作原理如图丙所示,下列有关该电池的说法正确的是________(填序号)。
a.电池的总反应是2H2+O2===2H2O
b.左边电极上的电势高于右边电极上的电势
c.负极的电极反应是H2-2e-+2OH-===2H2O
d.装置中所用的是阴离子交换膜
e.产生能源的源泉是酸和碱的中和能
答案 (1)CH4(g)+2H2O(g)===CO2(g)+4H2(g)ΔH=+165.0 kJ·mol-1
(2)①n3 ②> 该可逆反应的正反应为放热反应,升高温度平衡向逆反应方向移动,平衡常数减小③
(3)5.3 (4)ce
解析 (1)CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的化学方程式为CH4(g)+2H2O(g)===CO2(g)+4H2(g),根据盖斯定律该反应可由2×②-③得到,所以ΔH=2ΔH2-ΔH3=2×(+206.2 kJ·mol-1)-(+247.4 kJ·mol-1)=+165.0 kJ·mol-1。
(2)①该反应的化学平衡常数K=,而温度不变时化学平衡常数不变,即平衡时的c(H2)不变,所以起始充入H2量越大、H2的平衡转化率越高,即H2初始充入量:n3>n2>n1。②该反应的正反应是放热反应,所以其他条件不变时温度越高、化学平衡常数越小,即K(T1)>K(T2)>K(T3)。③容器的容积变为原容积一半的瞬间,体系的压强变为原来的两倍,即6 kPa,再由平衡常数表达式可知再次达到平衡时c(H2)不变,
11
即再次达到平衡时的压强与原平衡相同,还是3 kPa。
(3)由能量密度之比等于单位质量的可燃物转移电子数之比可知H2和甲醇的能量密度之比为∶≈5.3。
(4)a项,由图示可知左侧H2参与反应、右侧生成H2,所以没有O2参与总反应,错误;b项,左侧H2,与OH-反应生成H2O,即H2发生氧化反应,所以对应电极是原电池的负极,而原电池中电势:正极>负极,错误;c项,左侧为负极,H2发生失电子的氧化反应生成H2O,电极反应式是H2-2e-+2OH-===2H2O,正确;d项,由溶液呈电中性可知,左侧消耗OH-,则Na+移向右侧,则装置中所用的是阳离子交换膜,错误;e项,负极上H2失去电子后生成的H+与电解质溶液中的OH-反应,即发生的中和反应释放能量,正确。
11
相关文档
- 2020届二轮复习微专题八化学反应原2021-08-2444页
- 2019届二轮复习大题分点提速练(二)2021-08-2412页
- 高中化学《化学反应原理》4_2化学2021-08-245页
- 高中化学《化学反应原理》3_2水的2021-08-248页
- 2018届二轮复习选择题中的化学反应2021-08-2445页
- 高一化学教案:第20讲-化学反应原理2021-08-2425页
- 广西专用2020版高考化学二轮复习非2021-08-247页
- 2019届二轮复习化学反应原理中计算2021-08-2421页
- 2018届高考二轮复习人教版第三编化2021-08-2427页
- 2020届二轮复习第12题 化学反应原2021-08-2413页