- 1.04 MB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
湖南省怀化市2020届高三第二次模拟考试理综
可能用到的相对原子质量:H 1 C 12 N 14 O 16 F 19 Mg 24 Al 27 Cl 35.5 I 127 Ce 140
一、选择题:本大题共7小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。
7. 下列说法不正确的是( )
A.医用酒精消杀新冠病毒的原理是使病毒蛋白质失去活性。
B.生产N95口罩的主要原料是聚丙烯,聚丙烯属于有机高分子化合物
C.长征5号B(胖5)运载火箭用液氢、煤油、液氧作推进剂,其优点之一是提升推力
D.陶瓷是中华民族的一项重大发明,制作陶瓷的主要原料为石膏
8. 下列说法正确的是( )
A.13.35 g AlCl3 水解形成的Al(OH)3胶体粒子数为0.1NA
B.1 L 0.1 mol·L-1 的 NaHSO3 溶液中,HSO3- 和 SO32-离子数之和为 0.1NA
C.密闭容器中 23 g NO2 与 N2O4 的混合气体中氮原子数为0.5NA
D.4.6 g乙醇含共价键数为0.7NA
9. 短周期主族元素X、Y、Z、W的原子序数依次增大,X的原子序数是W的原子序数的一半;X、Y、Z三种元素形成的化合物Q结构如图所示。下列叙述正确的是( )
A.元素非金属性强弱的顺序为:X>Z>W
B.化合物Q中X原子不全满足8电子稳定结构
C.Z单质的熔点高于W单质
D.W的氧化物对应的水化物一定为强酸
10. 根据下列实验操作和现象所得到的结论正确的是( )
选项
实验操作和现象
实验结论
A
向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,沉淀部分溶解
Na2SO3部分被氧化
B
加热NH4HCO3固体,产生能使湿润红色石蕊试纸变蓝的气体
NH4HCO3显碱性
C
向20%蔗糖溶液中加入少量稀H2SO4,加热;再加入银氨溶液;未出现银镜
蔗糖完全没有水解
D
pH试纸测得:CH3COONa溶液的pH约为9,NaNO2溶液的pH约为8
HNO2的电离常数比CH3COOH大
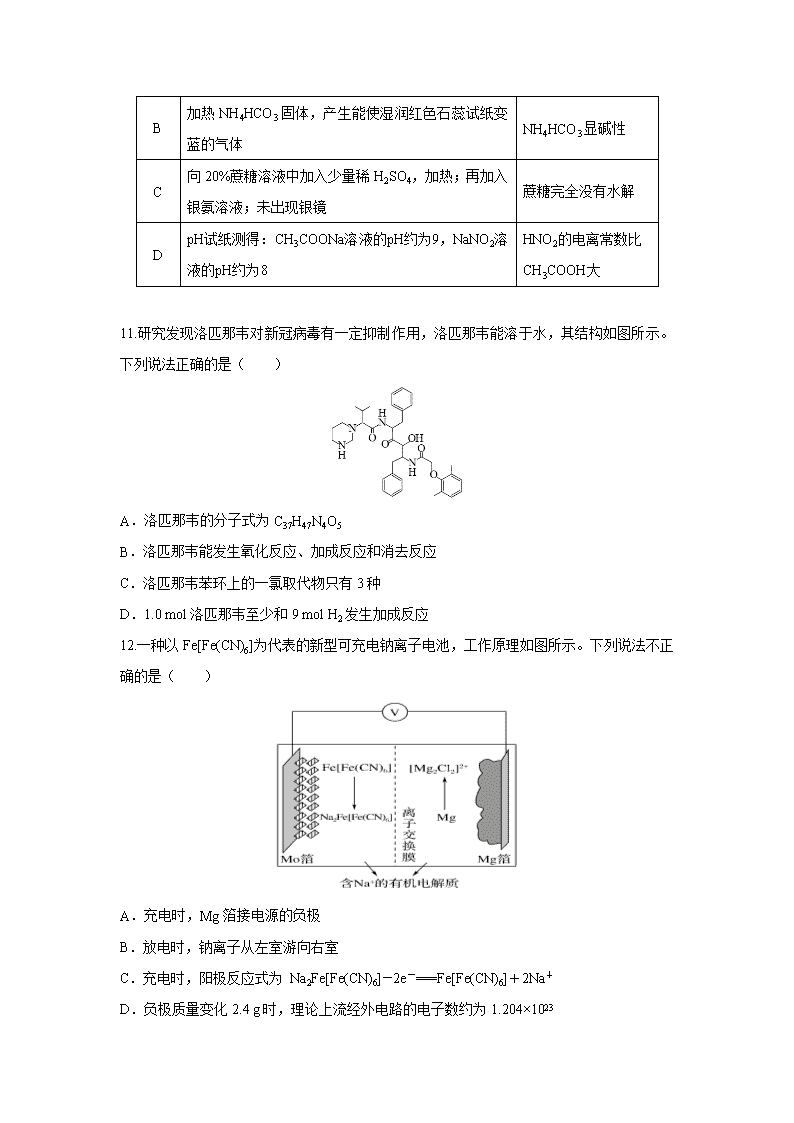
11.研究发现洛匹那韦对新冠病毒有一定抑制作用,洛匹那韦能溶于水,其结构如图所示。下列说法正确的是( )
A.洛匹那韦的分子式为C37H47N4O5
B.洛匹那韦能发生氧化反应、加成反应和消去反应
C.洛匹那韦苯环上的一氯取代物只有3种
D.1.0 mol洛匹那韦至少和9 mol H2发生加成反应
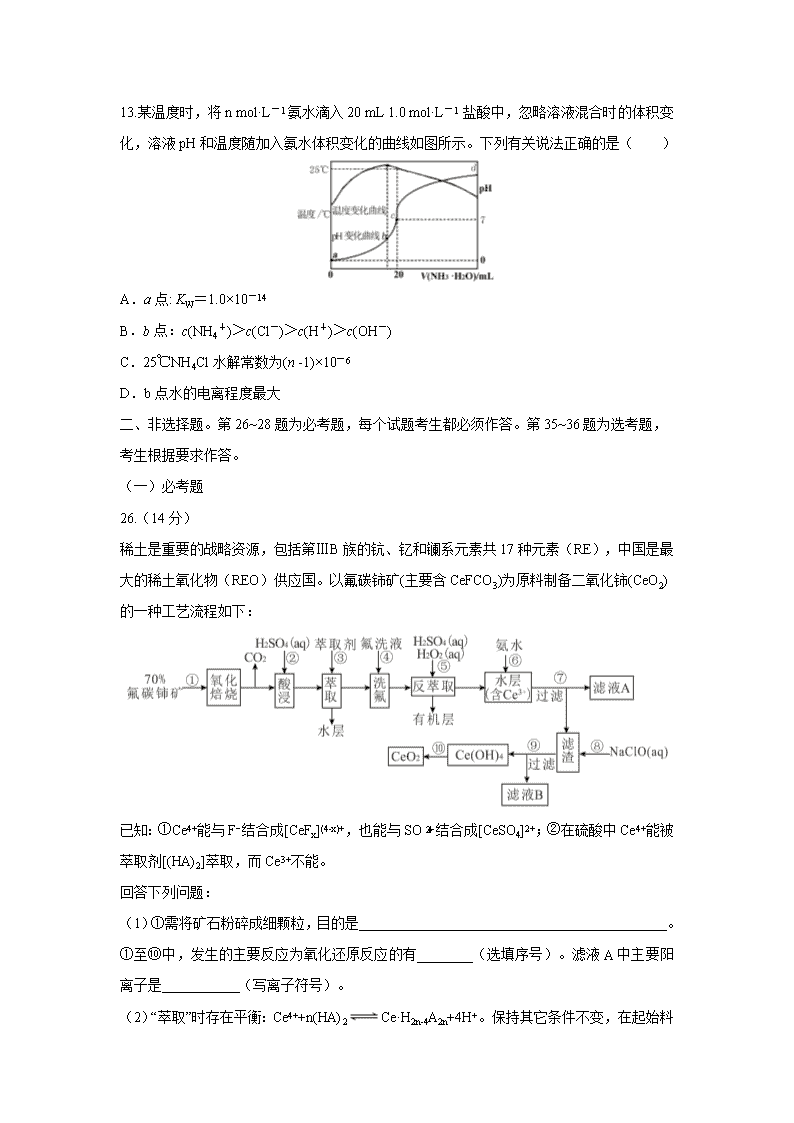
12.一种以Fe[Fe(CN)6]为代表的新型可充电钠离子电池,工作原理如图所示。下列说法不正确的是( )
A.充电时,Mg箔接电源的负极
B.放电时,钠离子从左室游向右室
C.充电时,阳极反应式为 Na2Fe[Fe(CN)6]-2e-===Fe[Fe(CN)6]+2Na+
D.负极质量变化2.4 g时,理论上流经外电路的电子数约为1.204×1023
13.某温度时,将n mol·L-1氨水滴入20 mL 1.0 mol·L-1 盐酸中,忽略溶液混合时的体积变化,溶液pH和温度随加入氨水体积变化的曲线如图所示。下列有关说法正确的是( )
A.a点: KW=1.0×10-14
B.b点:c(NH4+)>c(Cl-)>c(H+)>c(OH-)
C.25℃NH4Cl水解常数为(n -1)×10-6
D.b点水的电离程度最大
二、非选择题。第26~28题为必考题,每个试题考生都必须作答。第35~36题为选考题,考生根据要求作答。
(一)必考题
26.(14分)
稀土是重要的战略资源,包括第ⅢB族的钪、钇和镧系元素共17种元素(RE),中国是最大的稀土氧化物(REO)供应国。以氟碳铈矿(主要含CeFCO3)为原料制备二氧化铈(CeO2)的一种工艺流程如下:
已知:①Ce4+能与F−结合成[CeFx](4-x)+,也能与SO结合成[CeSO4]2+;②在硫酸中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能。
回答下列问题:
(1)①需将矿石粉碎成细颗粒,目的是____________________________________________。①至⑩中,发生的主要反应为氧化还原反应的有________(选填序号)。滤液A中主要阳离子是 (写离子符号)。
(2)“萃取”时存在平衡:Ce4++n(HA)2Ce·H2n-4A2n+4H+
。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO)。通过下图分析ф【ф=】随起始料液中c(SO42-)变化的原因________________________________________________
___________________________________________。
(3)写出⑤⑥中主要反应的离子方程式:
⑤__________________________________; ⑥________________________________。
(4)⑨中沉淀需进行洗涤,写出检验沉淀是否洗涤干净的实验操作及现象__________________________________________。
(5)用10吨含70%CeFCO3的矿石,按上述工艺生产,得二氧化铈4.48吨,则二氧化铈的产率为___________。(保留三位有效数字)
27.(14分)
碘酸钾(KIO3)是一种无色结晶粉末,溶解度0℃时为4.7 g,80℃时为24.8 g。常被添加在食盐中,用于预防碘缺乏病。
I.某实验小组利用图1装置制KH(IO3)2,利用图2方案制高纯碘酸钾。已知KH(IO3)2为无色晶体,微溶于冷水,溶于热水。
i.制KH(IO3)2
(1)反应釜中产生的Cl2须及时逐出,采取的措施有___________________________________
(写2条)。
(2)若还原产物Cl-和Cl2所得电子数相同,写出该反应的化学方程式 。判断反应釜中反应完全的现象是 。
ii.制高纯KIO3
(3)调节pH所用试剂为 (写化学式);操作2的具体过程是 、过滤、干燥。
(4)反应釜中混合液不能直接制得KIO3的原因可能是 。
II.电解法制取高纯KIO3
(5)查阅资料发现,电解法也可制取高纯KIO3,工作原理如图3,阳极电极反应方程式为 ;隔膜为 交换膜(填“阳离子”或“阴离子”)。若用2A直流电源进行电解,则通入2.54 g I2(完全转化)制KIO3,理论上约电解 min(保留整数,Q=It=n(e-)F,F为96500 C·mol-1)
28.(15分)
含NOx雾霾的综合治理是当前重要的研究课题。
(1)已知:①2NO(g) ⇌ N2(g)+O2(g) △H1= -180.5 kJ·mol-1;②CO的燃烧热△H2= -283.0 kJ·mol-l;③2NO(g)+2CO(g)⇌N2(g)+2CO2(g) △H3 =_______。
(2)若将CO和NO按不同比例投入一密闭容器中发生反应 2NO(g)+2CO(g)⇌N2(g)+2CO2(g) △H, N2的平衡体积分数随n(CO)/n(NO)和温度(T)的变化曲线如图。
① a、b、c对应 NO转化率最大的是________。
② c、d对应平衡常数c________d(填“>”、“<”或“=”),理由是 。
(3)为探究速率与浓度的关系,在恒容密闭容器中通入等物质的量的CO和NO,在一定条件下发生反应 2NO(g)+2CO(g)⇌N2(g)+2CO2(g) △H,根据相关实验数据,粗略绘制了两条速率-浓度关系曲线:υ正~c(NO)和υ逆~c(CO2)。
则υ逆~c(CO2)对应图中曲线___________ (填“甲”或“乙”)。降低反应体系温度,反应一段时间后,重新达到平衡,CO2和NO相应的平衡点分别为______(填字母)。
(4)利用测压法在刚性反应器中研究800℃时按投料比1:1进行的NO(g)与O2(g)的化合反应:
其中NO(g)与O2(g)化合的反应为不可逆反应,NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示[t=∞时,NO(g)完全反应]。
t/min
0
40
80
160
260
700
∞
p/kPa
33.2
28.6
27.1
26.3
25.9
25.2
22.3
①NO(g)与O2(g)合成的反应速率v=4.2×10-2×p2(NO)×p(O2)(kPa·min-1),t=52 min时,测得体系中p(NO)=6.2 kPa,v=_________kPa·min-1(计算结果保留1位小数)。
②800℃时,反应N2O4(g)⇌ 2NO2(g)的平衡常数Kp=_________kPa(Kp为以分压表示的平衡常数,计算结果保留2位有效数字)。
(二)选考题
35. [化学——选修3:物质结构与性质](15分)
(1)写出Cr3+的核外电子排布式 。我国科学家合成某种铬的化合物M(如图甲)对乙烯聚合表现出较好的催化活性,甲中化学键1、2、3、4属于配位键的是 ;聚乙烯链中碳原子采取的杂化方式为 。
(2)1mol(SCN)2中含有键的数目为 。HSCN的结构有两种,其中硫氰酸(H-S-C≡N)的沸点低于异硫氰酸,原因是 。
(3)研究表明水能凝结成13种类型结晶体,其中重冰(密度比水大)属于立方晶系,其立方晶胞沿x、y或z轴的投影图如乙,则该晶体中H2O的配位数为___________;若该晶胞边长为a pm,重冰的密度为___________g·cm-3(写出数学表达式,NA为阿伏加德罗常数)。
甲 乙 丙
(4)图丙为Fe3O4晶体中O2-的排列方式,其中围成正四面体空隙、3、6、7和正八面体空隙、6、7、8、9、12;晶体中有一半的填充在正四面体空隙中,和另一半填充在正八面体空隙中,则晶体中正四面体空隙数与正八面休空隙数之比为 ;有 的正八面体空隙没有填充阳离子。
36. [化学——选修5:有机化学基础](15分)
聚酰亚胺是重要的特种工程材料,已广泛应用在航空、航天、纳米、液晶、激光等领域。某聚酰亚胺的合成路线如下(部分反应条件略去)。
(1)①的反应类型是 ;E的名称是 ;F中含氧官能团的名称是_____________________。
(2)②的反应条件是 。
(3)1 molM与足量的NaHCO3溶液完全反应,生成4 mol CO2。据此写出L→M的化学反应方程式 。
(4)③对应化学反应方程式为 。
(5)同时满足下列条件的M的某种同分异构体的结构简式为 。
① 1 mol该物质完全水解后能消耗8 mol NaOH;
② 核磁共振氢谱中有3组峰,且峰面积之比为1∶1∶1。
(6)参照上述合成路线,设计由间二甲苯和甲醇制备的合成路线:
( 无机试剂任选)。
【参考答案】