- 2.76 MB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
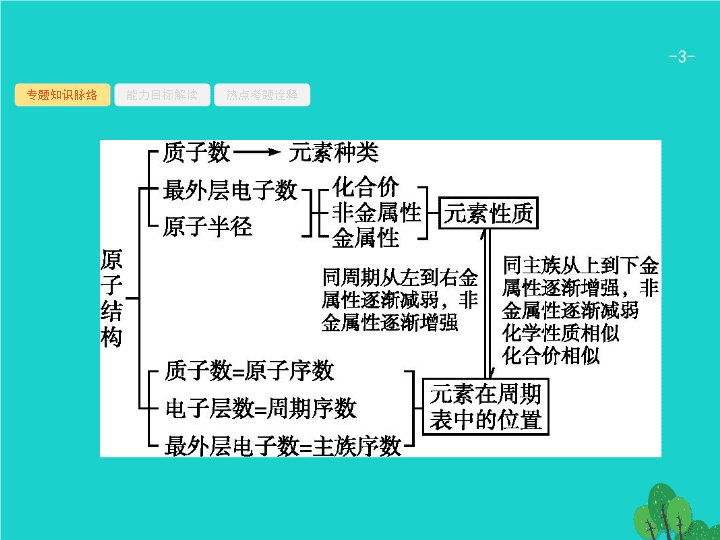
专题四 物质结构与性质
第
1
讲 物质结构 元素周期律
(
必修
)
-
3
-
专题知识脉络
能力目标解读
热点考题诠释
-
4
-
专题知识脉络
能力目标解读
热点考题诠释
-
5
-
专题知识脉络
能力目标解读
热点考题诠释
1
2
3
1
.(2016
全国甲
)a
、
b
、
c
、
d
为短周期元素
,a
的原子中只有
1
个电子
,b
2-
和
c
+
离子的电子层结构相同
,d
与
b
同族。下列叙述错误的是
(
)
A.a
与其他三种元素形成的二元化合物中其化合价均为
+1
价
B.b
与其他三种元素均可形成至少两种二元化合物
C.c
的原子半径是这些元素中最大的
D.d
与
a
形成的化合物的溶液呈弱酸性
答案
解析
解析
关闭
根据
a
的原子中只有
1
个电子
,
可知
a
为氢元素
,
依据
b
2-
和
c
+
离子的电子层结构相同
,
且元素都为短周期元素
,
可知
b
为氧元素
,c
为钠元素
,
最后根据
d
与
b
同族且为短周期元素可知
d
为硫元素。
NaH
中
H
为
-1
价
,A
项错误
;
由
H
2
O
、
H
2
O
2
、
Na
2
O
、
Na
2
O
2
、
SO
2
、
SO
3
等物质可知
B
项正确
;
原子半径由大到小的顺序为
Na>S>O>H,C
项正确
;H
2
S
的水溶液呈弱酸性
,D
项正确。
答案
解析
关闭
A
-
6
-
专题知识脉络
能力目标解读
热点考题诠释
1
2
3
2
.(2016
全国丙
)
四种短周期主族元素
W
、
X
、
Y
、
Z
的原子序数依次增大
,W
、
X
的简单离子具有相同电子层结构
,X
的原子半径是短周期主族元素原子中最大的
,W
与
Y
同族
,Z
与
X
形成的离子化合物的水溶液呈中性。下列说法正确的是
(
)
A.
简单离子半径
:WZ
答案
解析
解析
关闭
短周期主族元素中原子半径最大的是
Na,X
为
Na;Z
的原子序数比
X
大且
Z
与
X
形成的离子化合物的水溶液呈中性
,
则
Z
为
Cl
;
原子序数
WS(
或
N>P),
则氢化物的稳定性
H
2
O>H
2
S
或
NH
3
>PH
3
,C
项错误。非金属性
S(
或
N)<
Cl
,
故酸性
H
2
SO
4
(
或
HNO
3
)b>a
B.a
和其他
3
种元素均能形成共价化合物
C.d
和其他
3
种元素均能形成离子化合物
D.
元素
a
、
b
、
c
各自最高和最低化合价的代数和分别为
0
、
4
、
6
答案
解析
解析
关闭
因
a
-
的电子层结构与
He
相同
,
所以
a
为
H;
因
b
、
c
次外层有
8
个电子
,
最外层电子数分别为
6
、
7,
所以
b
、
c
分别为
S
、
Cl;
因
c
-
和
d
+
的电子层结构相同
,
且
d
最外层为
1
个电子
,
所以
d
为
K
。
c(Cl)
、
b(S)
、
a(H)
的非金属性强弱次序为
c(Cl)>b(S)>a(H),A
项正确
;
元素
H
与
K
不能形成共价化合物
,
所以
B
项错误
;
元素
K
可与
H
、
S
、
Cl
分别形成离子化合物
KH
、
K
2
S
、
KCl
,
所以
C
项正确
;
因
a
、
b
、
c
对应元素的最高化合价和最低化合价分别为
+1
、
+6
、
+7
价和
-1
、
-2
、
-1
价
,
所以它们的代数和分别为
0
、
4
、
6,D
项正确。
答案
解析
关闭
B
-
8
-
热点一
热点二
热点三
原子结构、原子核外电子排布规律
有关原子结构解题的思维路径
-
9
-
热点一
热点二
热点三
问题探究
1
.
原子结构和原子核外电子排布有哪些重要规律
?
(1)
构成原子或离子的微粒间的数量关系。
②
核电荷数
=
质子数
=
中性原子的核外电子数
③
阳离子
(
M
n
+
):
核电荷数
=
质子数
=
离子核外电子数
+
电荷数
(
n
)
④
阴离子
(R
n
-
):
核电荷数
=
质子数
=
离子核外电子数
-
电荷数
(
n
)
(2)
原子核外电子排布规律。
①
各层容纳的电子数最多为
2
n
2
个
(
n
表示电子层数
);
②
最外层电子数最多为
8
个
;
③
电子总是尽可能由内层排起
,
逐步往外层排
,
能量逐渐增大。
-
10
-
热点一
热点二
热点三
2
.
短周期元素有哪些特性
?
(1)
最外层电子数是次外层电子数
2
倍的原子是
C;3
倍的是
O;4
倍的是
Ne;
最外层电子数是次外层电子数
的是
Li
、
Si
。
(2)
最外层电子数与电子层数相等的原子有
H
、
Be
、
Al;
最外层电子数是电子层数
2
倍的原子是
He
、
C
、
S;3
倍的是
O
。
(3)
最外层电子数不是
8
的短周期元素的简单离子有
Li
+
、
H
+
、
H
-
等。
(4)
气态密度最小
,
原子半径最小
,
原子核中只有质子没有中子
,
原子序数、电子层数、最外层电子数三者均相等的是
H
。
-
11
-
热点一
热点二
热点三
-
12
-
热点一
热点二
热点三
-
13
-
热点一
热点二
热点三
题后反思
2
.
地壳中含量最高的非金属是
O
不是
N
。
3
.
任何微粒中
,
质量数
=
质子数
+
中子数
,
但质子数与电子数不一定相等。
4
.
质子数相同的微粒不一定属于同一种元素
,
如
Ne
和
H
2
O
。
5
.
因许多元素存在同位素
,
故原子的种类多于元素的种类
,
有多少种核素就有多少种原子。并非所有元素都有同位素
,
如
Na
、
F
、
Al
等就没有同位素。
6
.
互为同位素的原子中子数不同
,
质子数相同
,
化学性质几乎完全相同
,
物理性质差异较大。
-
14
-
热点一
热点二
热点三
答案
解析
解析
关闭
答案
解析
关闭
-
15
-
热点一
热点二
热点三
“
位
—
构
—
性
”
的关系及应用
有关
“
位
—
构
—
性
”
题目解题思维路径
-
16
-
热点一
热点二
热点三
-
17
-
热点一
热点二
热点三
-
18
-
热点一
热点二
热点三
问题探究
1
.
原子结构与位置、性质的关系包括哪些内容
?
-
19
-
热点一
热点二
热点三
-
20
-
热点一
热点二
热点三
2
.
如何比较元素的金属性和非金属性强弱
?
-
21
-
热点一
热点二
热点三
-
22
-
热点一
热点二
热点三
例
2
短周期元素
X
、
Y
、
Z
、
W
的原子序数依次增大
,
其中
Y
、
Z
原子的核外电子数之和与
X
、
W
原子的核外电子数之和相等
,Z
单质可以用来冶炼其他熔点较高的金属
,X
和
W
间可形成一种能产生酸雨的化合物
,
则下列说法不正确的是
(
)
A.
原子半径从大到小顺序为
W>Z>Y>X
B.X
与
Y
可形成既含离子键又含非极性共价键的化合物
C.X
、
W
分别形成的简单氢化物中
,
后者还原性强
D.X
形成单核阴离子的核外电子数与
Y
、
Z
、
W
原子的核外内层电子数相同
-
23
-
热点一
热点二
热点三
分析推理
(1)
铝热反应有何作用
?
哪些物质可形成酸雨
?
铝热反应主要是用来冶炼高熔点的金属。形成酸雨的物质包括氮氧化物、硫氧化物。所以
Z
为
Al;
结合原子序数依次增大可知
W
为
S
、
X
为
O
。
(2)Y
的核外电子数
=24-13=11,
为
Na
。
(3)
怎样比较原子半径或离子半径
?
原子半径应用元素周期表进行比较
,
首先把
X
、
Y
、
Z
、
W
放在元素周期表中大致位置
,
可知
Y
的原子半径最大
,A
选项错误
;
离子半径大小比较
,
应用
“
同层比核
”,
具有相同电子层结构的离子
,
核电荷数越大
,
离子半径越小
,
如
r
(Al
3+
)<
r
(Na
+
)<
r
(F
-
)<
r
(O
2-
)
。
-
24
-
热点一
热点二
热点三
(4)
其他选项
,
可采取具体举例法分析
——
由
Na
2
O
2
可知
B
项正确
;H
2
S
的还原性强于
H
2
O
的
,C
选项正确
;O
2-
的核外电子数为
10,Na
、
Al
、
S
的内层电子数之和均为
10,D
选项正确。
答案
A
-
25
-
热点一
热点二
热点三
题后反思
解答元素
“
位
—
构
—
性
”
关系的
“
六大误区
”
-
26
-
热点一
热点二
热点三
对点训练
2
.(2015
广东汕头模拟
)
前四周期主族元素
A
、
B
、
C
、
D
、
E
在元素周期表中的相对位置如图所示
,
其中
C
元素原子的最外层电子数与最内层电子数之和等于其电子总数的一半。下列说法正确的是
(
)
A.
元素
A
、
B
的所有氢化物中均只含有极性共价键
B.
元素
C
、
D
形成的简单离子的电子总数不同
C.
元素
C
、
D
、
E
形成的常见单质的熔、沸点高低
:E>D>C
D.C
、
D
、
E
三种元素最高价氧化物对应的水化物中
D
的酸性最强
答案
解析
解析
关闭
首先根据
“C
元素原子的最外层电子数与最内层电子数之和等于其电子总数的一半
”
确定
C
为硫元素
,
然后根据这五种元素的位置关系可确定
A
为碳元素
,B
为氮元素
,D
为氯元素
,E
为溴元素
;
元素
A
、
B
的氢化物如
C
2
H
6
、
N
2
H
4
等
,
除了含有极性共价键外
,
还含有非极性共价键
,A
项错误
;
元素
C
、
D
形成的简单离子分别为
S
2-
、
Cl
-
,
其电子总数均为
18,B
项错误
;
元素
C
、
D
、
E
形成的常见单质分别为
S(
固体
)
、
Cl
2
(
气体
)
、
Br
2
(
液体
),
根据这些物质在常温下的状态可知其熔、沸点高低为
C>E>D,C
项错误
;C
、
D
、
E
三种元素中
,
元素
D(Cl
)
的非金属性最强
,
则其最高价氧化物对应水化物的酸性最强
,D
项正确。
答案
解析
关闭
D
-
27
-
热点一
热点二
热点三
3
.(2015
安徽合肥质检
)
几种前四周期元素的原子半径及主要化合价如下表所示
:
下列叙述正确的是
(
)
A.
元素
A
和
B
的最高价氧化物均可用作耐火材料
B.
由元素
B
、
C
组成的化合物可以通过单质与单质化合制得
,
也可以在溶液中通过复分解反应制得
C.
气态氢化物的还原性
:C>E
D.D
元素的非金属性最强
,
其最高价氧化物对应水化物的酸性最强
答案
解析
解析
关闭
根据元素的原子半径及主要化合价可确定
A
为镁元素
,B
为铝元素
,C
为硫元素
,D
为氟元素
(
因氟元素无正价
),E
为硒元素
;
MgO
、
Al
2
O
3
的熔点均很高
,
均可用作耐火材料
,A
项正确
;Al
2
S
3
在水中会发生剧烈反应生成
Al(OH)
3
沉淀和
H
2
S
气体
,
故不能在溶液中通过复分解反应制得
Al
2
S
3
,B
项错误
;
由于硫的非金属性比硒的强
,
故其气态氢化物的还原性
:H
2
Se>H
2
S,C
项错误
;
由于氟元素的非金属性最强
,
氟元素无正价
,
故氟元素无最高价氧化物对应的水化物
,D
项错误。
答案
解析
关闭
A
-
28
-
热点一
热点二
热点三
化学键和元素推断
有关化学键的解题思维路径
-
29
-
热点一
热点二
热点三
问题探究
1
.
书写电子式应注意哪些问题
?
书写电子式时
,
首先要判断物质是离子化合物
,
还是共价化合物
,
活泼金属与活泼非金属形成的大多是离子化合物
,
非金属之间形成的大多是共价化合物
,
但要注意铵盐属于离子化合物
,
如
NH
4
Cl
、
NH
4
HCO
3
等。
2
.
如何书写等电子体
?
在记忆电子数相同的微粒时
,
我们一定要利用元素周期表这一工具。如
:10
电子的微粒在元素周期表中从
10
电子的
Ne
向后推
18
电子的微粒应以
Ar
为基准向前后推导
,
但不要忘记一些相加类型
,
如
:F
2
、
H
2
O
2
、
C
2
H
6
、
CH
3
OH
、
CH
3
F
、
N
2
H
4
等。
-
30
-
热点一
热点二
热点三
-
31
-
热点一
热点二
热点三
-
32
-
热点一
热点二
热点三
问题探究
常见元素有哪些特性
?
(1)
地壳中含量最多的元素或简单氢化物在常温下呈液态的元素为
O;
地壳中含量第二的元素为
Si;
地壳中含量最多的金属元素为
Al
。
(2)
空气中含量最多的元素或气态氢化物的水溶液显碱性的元素为
N
。
(3)
单质硬度最大
,
熔、沸点最高
,
形成化合物种类最多
,
正负化合价代数和为零且气态氢化物中含氢质量分数最高的元素是
C
。
(4)
最高价氧化物及其水化物既能与强酸反应
,
又能与强碱反应的元素在中学阶段为
Al
。
(5)
两短周期金属元素的最高价氧化物对应水化物相互反应
,
这两种元素分别为
Na
和
Al
。
-
33
-
热点一
热点二
热点三
例
3
(2015
江西南昌质检
)
已知
A
、
B
、
C
、
D
、
E
是原子序数依次增大的五种短周期元素
,A
与
C
同主族
,A
与
B
、
A
与
E
形成共价化合物
,A
与
B
形成的最简单化合物的水溶液呈碱性
,E
的最高正化合价与最低负化合价的代数和为
6,D
是同周期中简单离子半径最小的元素。
(1)
五种元素中
,E
在元素周期表中的位置是
,
画出
C
的原子结构示意图
。
(2)B
的气态氢化物与其最高价氧化物对应的水化物反应生成的化合物中存在的化学键类型为
。
(3)C
的最高价氧化物对应的水化物与
D
的最高价氧化物反应的化学方程式为
。
-
34
-
热点一
热点二
热点三
(4)
已知
X
、
Y
、
Z
三种物质中均含有上述元素中的某一种元素
,
①
若
X
、
Y
、
Z
均含有同一种金属元素
,
若
W
固体俗称干冰
,
则反应
Y→Z
的离子方程式为
;
若
W
是强碱
,
且
Y
是白色难溶固体
,
则反应
Y→Z
的离子方程式为
。
②
若
X
、
Y
、
Z
是均含有同一种非金属元素的化合物
,W
是一种常见金属单质
,
且上述转化均在常温条件下完成
,
则反应
Z→Y
的离子方程式为
。
-
35
-
热点一
热点二
热点三
分析推理
(1)
最高正价与最低负价代数和为
6
的是什么元素
?
依据元素周期律
,
第
Ⅶ
A
族元素的最高正价为
+7,
最低负价为
-1,
代数和为
6
。短周期中
,
由于
F
无正价
,
故符合上述条件的元素只有
Cl
。
(2)
同周期中简单离子半径最小的元素在周期表的什么位置
?
依据电子层结构相同的离子
,
核电荷数越小
,
半径越大
,
同周期中
,
第
Ⅲ
A
族元素能形成简单离子的离子半径最小
,
如第三周期中
Al
3+
半径最小。
-
36
-
热点一
热点二
热点三
-
37
-
热点一
热点二
热点三
-
38
-
热点一
热点二
热点三
题后反思
1
.
误认为离子化合物中只存在离子键
,
不存在共价键。
2
.
由金属元素与非金属元素形成的化合物不一定是离子化合物
,
如
AlCl
3
为共价化合物
;
只由非金属元素形成的化合物不一定是共价化合物
,
如
NH
4
Cl
为离子化合物。
3
.
误认为任何物质中都存在化学键
,
如稀有气体分子中不存在化学键。
4
.
误认为只要有化学键的断裂就一定发生化学反应
,
如
NaCl
熔化时断裂化学键
,
但未发生化学反应。
5
.
误认为同位素原子间的质量数不同而造成化学性质的不同。
-
39
-
热点一
热点二
热点三
对点训练
4
.(2015
湖北宜昌四月调研
)
五种短周期主族元素
A
、
B
、
C
、
D
、
E
的原子序数依次递增
,A
2
属于绿色燃料
,C
的氧化物常用于玻璃的生产
;D
元素原子的核电荷数是同主族上一周期元素的
2
倍
,B
、
C
为同周期元素
,B
、
D
元素原子最外层电子数之和等于
E
元素原子的最外层电子数。根据以上叙述
,
下列说法中正确的是
(
)
A.
五种元素中
B
的金属性最强
B.
元素
D
、
E
分别与元素
A
形成化合物的稳定性
:A
2
D>AE
C.
元素
C
、
D
、
E
的最高价氧化物对应水化物的酸性递减
D.
元素
B
、
D
、
E
的简单离子半径大小为
B>D>E
答案
解析
解析
关闭
根据
“A
2
属于绿色燃料
”
推出
A
为氢元素
,
然后根据
“C
的氧化物常用于玻璃的生产
”
推出
C
为硅元素
,
再根据
“D
元素原子的核电荷数是同主族上一周期元素的
2
倍
”
确定
D
为硫元素
,
硫元素之后的短周期主族元素只有氯元素
,
故
E
为氯元素
,
最后根据
“B
、
C
为同周期元素
,B
、
D
元素原子最外层电子数之和等于
E
元素原子的最外层电子数
”
可确定
B
为钠元素。在这五种元素中只有
B(Na
)
为金属元素
,
则其金属性最强
,A
项正确
;
由于
E(Cl
)
的非金属性比
D(S)
的强
,
则元素
D
、
E
分别与元素
A(H)
形成的氢化物的稳定性大小为
HCl
>H
2
S,B
项错误
;
根据元素
C(Si
)
、
D(S)
、
E(Cl
)
的非金属性递增
,
则其最高价氧化物对应水化物的酸性也递增
,C
项错误
;
元素
B
、
D
、
E
的简单离子分别为
Na
+
、
S
2-
、
Cl
-
,
其离子半径大小为
S
2-
>
Cl
-
>
Na
+
,D
项错误。
答案
解析
关闭
A
-
40
-
热点一
热点二
热点三
5
.(2016
山东滨州模拟
)X
、
Y
为两种短周期元素
,
其原子的最外层电子数分别是
1
和
6,
则
X
、
Y
两种元素形成的常见化合物或者离子不可能是
(
)
A.
只含极性键的共价化合物
B.
含非极性键的共价化合物
C.
阴阳离子个数之比为
1
∶
1
的离子化合物
D.
可形成双核离子或者四核离子
答案
解析
解析
关闭
短周期元素
X
原子的最外层电子数为
1,
则
X
可能为
H
、
Li
、
Na;
短周期元素
Y
原子的最外层电子数为
6,
则
Y
可能为
O
、
S
。
X
、
Y
可形成只含极性键的共价化合物
H
2
O,A
项正确
;X
、
Y
形成的含非极性键的共价化合物为
H
2
O
2
,B
项正确
;X
、
Y
形成的离子化合物可为
Na
2
O
、
Na
2
O
2
、
Na
2
S
等
,
阴阳离子个数比都为
1
∶
2,C
项错误
;X
、
Y
形成的双核离子可为
OH
-
,
形成的四核离子为
H
3
O
+
,D
项正确。
答案
解析
关闭
C
-
41
-
1
2
3
4
1
.(2016
吉林长春质检
)X
、
Y
、
M
、
N
是短周期主族元素
,
且原子序数依次增大。已知
X
的最外层电子数是电子层数的
3
倍
,X
、
M
同主族
,Y
原子在短周期主族元素中原子半径最大
,
下列说法正确的是
(
)
A.M
与
X
形成的化合物对应的水化物一定是强酸
B.Y
2
X
和
Y
2
X
2
中阴、阳离子的个数比相同
,
化学键类型也完全相同
C.X
、
Y
的简单离子半径
:
r
(X
2-
)>
r
(Y
+
)
D.N
的气态氢化物比
X
的气态氢化物稳定
答案
解析
解析
关闭
X
、
Y
、
M
、
N
是短周期主族元素
,
且原子序数依次增大
,X
原子的最外层电子数是电子层数的
3
倍
,
则
X
是
O
元素
,X
、
M
同主族且都是短周期主族元素
,
所以
M
是
S
元素
;N
原子序数大于
M
且为短周期主族元素
,
所以
N
是
Cl
元素
;Y
原子在短周期主族元素中原子半径最大
,
则
Y
是
Na
元素。由于
H
2
SO
4
是强酸
,
但
H
2
SO
3
是弱酸
,A
项错误
;Na
2
O
中只含离子键、
Na
2
O
2
中含有共价键和离子键
,
所以化学键类型不完全相同
,B
项错误
;
电子层结构相同的离子
,
核电荷数越大离子半径越小
,
所以离子半径
:
r
(O
2-
)>
r
(Na
+
),C
项符合题意
;
由于非金属性
:X(O)>N(Cl),
所以气态氢化物的热稳定性
:X>N,D
项错误。
答案
解析
关闭
C
-
42
-
1
2
3
4
2
.
短周期主族元素
X
、
Y
、
Z
、
W
的原子序数依次增大。
X
原子的最外层电子数是其内层电子数的
2
倍
,Y
是地壳中含量最高的元素
,Z
2+
与
Y
2-
具有相同的电子层结构
,W
与
X
同主族。下列说法正确的是
(
)
A.
原子半径的大小顺序
:
r
(W)>
r
(Z)>
r
(Y)>
r
(X)
B.Y
分别与
Z
、
W
形成的化合物中化学键类型相同
C.X
的最高价氧化物对应的水化物的酸性比
W
的弱
D.Y
的气态简单氢化物的热稳定性比
W
的强
答案
解析
解析
关闭
答案
解析
关闭
-
43
-
1
2
3
4
3
.(2015
河北唐山检测
)
元素的性质主要表现在原子半径、主要化合价、元素的金属性、元素的非金属性等方面。下列有关元素性质的说法中正确的是
(
)
A.
同一周期元素形成的简单离子的半径从左到右依次减小
B.
主族元素的最高正价均等于其族序数
C.
元素的非金属性、金属性与元素原子在氧化还原反应中得失电子数目的多少无关
D.
元素的非金属性越强
,
其气态氢化物的还原性越弱
,
其气态氢化物的酸性也越弱
答案
解析
解析
关闭
同一周期元素形成的简单离子有阳离子、阴离子
,
同周期元素形成的阴离子半径均比同周期元素形成的阳离子半径大
,A
项错误
;
氧、氟元素无正价
,B
项错误
;
元素的非金属性、金属性与元素原子得失电子能力的大小有关
,
与得失电子数目的多少无关
,C
项正确
;
元素的非金属性越强
,
其气态氢化物的还原性越弱
,
但其气态氢化物的酸性不一定越弱
,
如非金属性
Cl>S,
酸性
HCl
>H
2
S,D
项错误。
答案
解析
关闭
C
-
44
-
1
2
3
4
4
.(2015
湖北天门一中检测
)
元素
①
~
⑦
在元素周期表中的位置如表所示
,
请回答下列问题
:
(1)
③
、
④
、
⑦
的原子半径由大到小的顺序为
。
(
用元素符号表示
)
(2)
⑥
和
⑦
的最高价含氧酸的酸性强弱为
(
用化学式表示
)
。
-
45
-
1
2
3
4
(3)
①
、
②
两种元素按原子个数之比为
1
∶
1
组成的常见液态化合物
,
在酸性溶液中能将
Fe
2+
氧化
,
写出该反应的离子方程式
:
。
(4)
由表中元素形成的物质可发生如图所示的反应
,
其中
B
、
C
、
G
是单质
,B
为黄绿色气体
,D
溶液显碱性。
①
写出
D
溶液与
G
反应的化学方程式
:
;
②
写出检验
A
溶液中溶质的阴离子的方法
:
;
-
46
-
1
2
3
4
③
常温下
,
若电解
1 L 0.1 mol·L
-1
的
A
溶液
,
一段时间后测得溶液
pH
为
12(
忽略溶液体积变化
),
则该电解过程中转移电子的物质的量为
;
④
若上图中各步反应均恰好完全进行
,
则混合物
X
中含有的物质除水外还有
(
填化学式
)
。
-
47
-
1
2
3
4
-
48
-
1
2
3
4
解析
根据表中位置可知
①
是氢元素、
②
是氧元素、
③
是氟元素、
④
是钠元素、
⑤
是铝元素、
⑥
是硫元素、
⑦
是氯元素。
(1)
根据三种元素原子结构可以判断原子半径大小顺序是
Na>Cl>F
。
(2)
两元素位于同周期
,
同周期元素从左到右
,
非金属元素最高价含氧酸的酸性逐渐增强。
(3)
氢、氧两种元素按原子个数之比为
1
∶
1
组成的常见液态化合物是
H
2
O
2
,
具有氧化性
,
在酸性溶液中能将
Fe
2+
氧化为
Fe
3+
。
-
49
-
1
2
3
4