- 1.70 MB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
微专题5 元素化合物的综合应用(二)——化学工艺流程题
1.解题要领必备
解答工艺流程综合题的关键是分析流程图,对于比较陌生且复杂的流程图,需要宏观把握整个流程,可针对问题分析细节,不必把每个环节的原理都弄清。总体方法:关注箭头的指向(聚焦局部,箭头指入——反应物,箭头指出——生成物)、前后追溯物质(放大局部)、考虑反应实际(物质性质、试剂用量)。
2.识记化工术语
关键词
释义
研磨、
雾化
将块状或颗粒状的物质磨成粉末或将液体分散成微小液滴,增大反应物接触面积,以加快反应速率或使反应更充分
灼烧
(煅烧)
使固体在高温下分解或改变结构、使杂质高温氧化、分解等。如煅烧石灰石、高岭土、硫铁矿
浸取
向固体中加入适当溶剂或溶液,使其中可溶性的物质溶解,包括水浸取、酸溶、碱溶、醇溶等
浸出率
固体溶解后,离子在溶液中的含量的多少
酸浸
在酸性溶液中使可溶性金属离子进入溶液,不溶物通过过滤除去的过程
水浸
与水接触反应或溶解
过滤
固体与液体的分离
滴定
定量测定,可用于某种未知浓度物质的物质的量浓度的测定
蒸发
结晶
蒸发溶剂,使溶液由不饱和变为饱和,继续蒸发,过剩的溶质就会呈晶体析出
蒸发
浓缩
蒸发除去部分溶剂,提高溶液的浓度
水洗
用水洗去可溶性杂质,类似的还有酸洗、醇洗等
酸作用
溶解、去氧化物(膜)、抑制某些金属离子的水解、除去杂质离子等
碱作用
去油污、去铝片氧化膜,溶解铝、二氧化硅,调节pH、促进水解(沉淀)
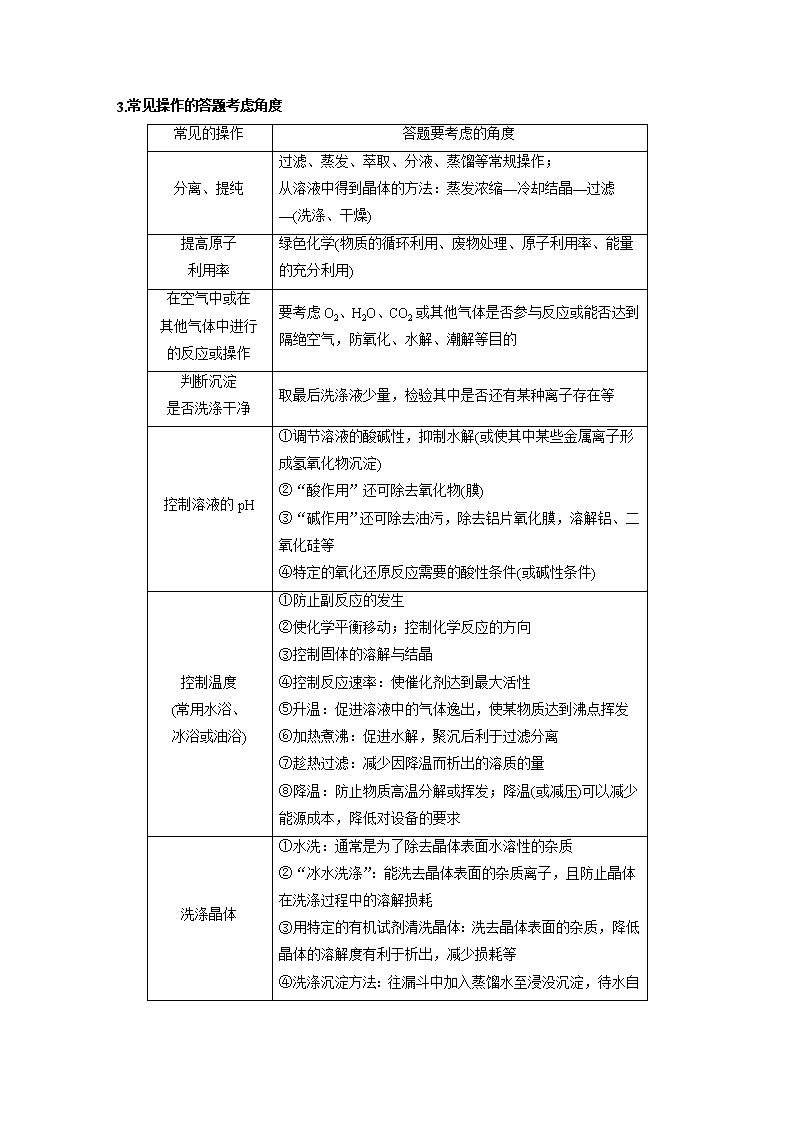
3.常见操作的答题考虑角度
常见的操作
答题要考虑的角度
分离、提纯
过滤、蒸发、萃取、分液、蒸馏等常规操作;
从溶液中得到晶体的方法:蒸发浓缩—冷却结晶—过滤—(洗涤、干燥)
提高原子
利用率
绿色化学(物质的循环利用、废物处理、原子利用率、能量的充分利用)
在空气中或在
其他气体中进行
的反应或操作
要考虑O2、H2O、CO2或其他气体是否参与反应或能否达到隔绝空气,防氧化、水解、潮解等目的
判断沉淀
是否洗涤干净
取最后洗涤液少量,检验其中是否还有某种离子存在等
控制溶液的pH
①调节溶液的酸碱性,抑制水解(或使其中某些金属离子形成氢氧化物沉淀)
②“酸作用”还可除去氧化物(膜)
③“碱作用”还可除去油污,除去铝片氧化膜,溶解铝、二氧化硅等
④特定的氧化还原反应需要的酸性条件(或碱性条件)
控制温度
(常用水浴、
冰浴或油浴)
①防止副反应的发生
②使化学平衡移动;控制化学反应的方向
③控制固体的溶解与结晶
④控制反应速率:使催化剂达到最大活性
⑤升温:促进溶液中的气体逸出,使某物质达到沸点挥发
⑥加热煮沸:促进水解,聚沉后利于过滤分离
⑦趁热过滤:减少因降温而析出的溶质的量
⑧降温:防止物质高温分解或挥发;降温(或减压)可以减少能源成本,降低对设备的要求
洗涤晶体
①水洗:通常是为了除去晶体表面水溶性的杂质
②“冰水洗涤”:能洗去晶体表面的杂质离子,且防止晶体在洗涤过程中的溶解损耗
③用特定的有机试剂清洗晶体:洗去晶体表面的杂质,降低晶体的溶解度有利于析出,减少损耗等
④洗涤沉淀方法:往漏斗中加入蒸馏水至浸没沉淀,待水自
然流下后,重复以上操作2~3次
表面处理
用水洗除去表面可溶性杂质,金属晶体可用机械法(打磨)或化学法除去表面氧化物、提高光洁度等
1.[2018·全国卷Ⅰ,27(1)(2)]焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。回答下列问题:
(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式:________________________________________________________________________
________________________________________________________________________。
(2)利用烟道气中的SO2生产Na2S2O5的工艺为:
①pH=4.1时,Ⅰ中为________溶液(写化学式)。
②工艺中加入Na2CO3固体、并再次充入SO2的目的是
________________________________________________________________________。
答案 (1)2NaHSO3===Na2S2O5+H2O
(2)①NaHSO3 ②得到NaHSO3过饱和溶液
解析 (1)根据题给信息,将NaHSO3过饱和溶液结晶脱水可得到Na2S2O5,则化学方程式为2NaHSO3===Na2S2O5+H2O。
(2)①酸性条件下,SO2与Na2CO3溶液反应生成NaHSO3。②工艺中加入Na2CO3固体并再次通入SO2,其目的是得到NaHSO3过饱和溶液。
2.(2018·全国卷Ⅱ,26)我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子
Fe3+
Fe2+
Zn2+
Cd2+
开始沉淀的pH
1.5
6.3
6.2
7.4
沉淀完全的pH
2.8
8.3
8.2
9.4
回答下列问题:
(1)焙烧过程中主要反应的化学方程式为______________________。
(2)滤渣1的主要成分除SiO2外还有________;氧化除杂工序中ZnO的作用是________________________________________________________________________,
若不通入氧气,其后果是__________________________________________________。
(3)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为________________________________________________________________________。
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为________________________;沉积锌后的电解液可返回________工序继续使用。
答案 (1)2ZnS+3O22ZnO+2SO2
(2)PbSO4 调节溶液的pH 无法除去杂质Fe2+
(3)Cd2++Zn===Cd+Zn2+ (4)Zn2++2e-===Zn 溶浸
解析 (1)闪锌矿的主要成分是ZnS,所以高温焙烧过程中主要反应的化学方程式为2ZnS+3O22ZnO+2SO2。
(2)闪锌矿焙烧后的主要成分变为ZnO,还存在少量SiO2、Fe2O3、CdO、PbO,加稀H2SO4后,发生一系列化学反应:ZnO+H2SO4===ZnSO4+H2O、Fe2O3+3H2SO4===Fe2(SO4)3+3H2O、CdO+H2SO4===CdSO4+H2O、PbO+H2SO4===PbSO4+H2O。其中SiO2和PbSO4不溶于水,以沉淀的形式沉降下来,所以滤渣1的主要成分是SiO2和PbSO4。氧化除杂工序中ZnO的作用是调节溶液的pH在2.8~6.2,使Fe3+完全转变为Fe(OH)3沉淀;通入O2的目的是使溶液中的Fe2+转化为Fe3+,有利于除杂,若不通入O2,无法除去溶液中的杂质Fe2+。
(3)溶液中的Cd2+与加入的Zn粉反应而被除去,反应的离子方程式为Zn+Cd2+===Zn2++Cd。
(4)电解ZnSO4溶液制备单质Zn时,阴极放电的是Zn2+和H+。因为溶液中的Zn2+浓度较大,所以阴极电极反应式应该是Zn2++2e-===Zn,阳极放电的是OH-,电极反应式是4OH--4e-===2H2O+O2↑。沉积锌后的溶液应该是ZnSO4和稀H2SO4,可返回到溶浸工序循环使用。
3.[2018·全国卷Ⅲ,27(1)(2)]KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题:
(1)KIO3的化学名称是________。
(2)利用“KClO3氧化法”制备KIO3工艺流程如下图所示:
“酸化反应”所得产物有 KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是__________________。“滤液”中的溶质主要是__________。“调pH”中发生反应的化学方程式为__________________。
答案 (1)碘酸钾 (2)加热 KCl KH(IO3)2+KOH===2KIO3+H2O(或HIO3+KOH===KIO3+H2O)
解析 (2)Cl2的溶解度随温度的升高而降低,所以可以用加热的方法来达到“逐Cl2”的目的;KH(IO3)2和KCl的分离可以根据溶解度的不同,采用结晶法分离,滤液中的溶质主要是KCl,要使KH(IO3)2转化为KIO3,可以加入KOH调节pH。发生反应:KH(IO3)2+KOH===2KIO3+H2O或HIO3+KOH===KIO3+H2O,从而避免引入新的杂质离子。
4.(2017·全国卷Ⅰ,27)Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的浸出率为70%时,所采用的实验条件为________________________________________________________________
________________________________________________________________________。
(2)“酸浸”后,钛主要以TiOCl形式存在,写出相应反应的离子方程式:________________________________________________________________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃
30
35
40
45
50
TiO2·xH2O转化率/%
92
95
97
93
88
分析40 ℃时TiO2·xH2O转化率最高的原因:_______________________________________
________________________________________________________________________
________________________________________________________________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol·L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5 mol·L-1,此时是否有Mg3(PO4)2沉淀生成?________________________________________________________________________
_________________________________________________________________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式_____________________。
答案 (1)100 ℃、2 h或90 ℃、5 h
(2)FeTiO3+ 4H++ 4Cl-===Fe2++TiOCl+2H2O
(3)低于40 ℃,TiO2·xH2O转化反应速率随温度升高而增加;超过40 ℃,双氧水分解与氨气逸出导致TiO2·xH2O转化反应速率下降
(4)4
(5)Fe3+恰好沉淀完全时, c(PO)= mol·L-1=1.3×10-17mol·L-1,c3(Mg2+)·c2(PO)值为0.013×(1.3×10-17)2≈1.7×10-40HB
答案 B
解析 将过量的过氧化钠投入滴有酚酞溶液的水中,反应中生成NaOH,溶液显碱性,溶液先变红色,但Na2O2有强氧化性,最终溶液变为无色,A错误;向Ba(NO3)2溶液中通入SO2气体,在酸性条件下,硝酸能够把SO2气体氧化为硫酸根离子,硫酸根离子与钡离子反应产生硫酸钡白色沉淀,体现了SO2气体的还原性,B正确;铁离子具有强氧化性,能够把金属铜氧化为铜离子,铁离子被还原为亚铁离子,发生了氧化还原反应,不是置换反应,C错误;形成盐的酸根离子对应的酸越弱,盐水解能力越强,由于pH(NaB)10-6 mol·L-1,所以pH不超过6。
(4)钛酸煅烧得中间产物的化学方程式为H2TiO3(s)TiO2(s)+H2O(g)
,上述工艺流程中钛酸煅烧得到的中间产物与Cl2和焦炭在900 ℃时反应生成TiCl4,所以生成TiCl4的化学方程式为2Cl2+TiO2+CTiCl4+CO2(或2Cl2+TiO2+2CTiCl4+2CO)。若要TiO2(s)与Cl2(g)高温条件下直接反应生成TiCl4(l)和O2(g),该反应极难进行,当向反应体系中加入焦炭后,根据化学平衡移动原理:①C与O2反应减小了O2的浓度使平衡向右移动;②C与O2反应放热,温度升高使平衡向右移动,促使反应顺利进行。