- 1.65 MB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第五部分 化学实验
专题十八 化学常用仪器和实验基本操作
【考情探究】
内容 常用化学仪器的用途及使用方法 化学实验基本操作课
标
解
读
解读
1.了解化学实验是科学探究过程中的一种重要方法
2.了解化学实验室常用仪器的主要用途和使用方法
3.能识别化学品标识
1.掌握化学实验的基本操作
2.了解实验室一般事故的预防和处理方法
3.掌握常见气体的实验室制法
考情分析
正确使用实验室常用仪器,掌握化学实验基本操作是保证实验安全及实验结果准确性的前提,同时也
是化学素养的重要体现,本专题内容是历年高考的必考内容,命题形式可以是选择题,也可以是综合性
实验题
备考策略 应重点关注实验基本操作的规范性,常见仪器的正确使用方法及注意事项,以及气体的制备方法
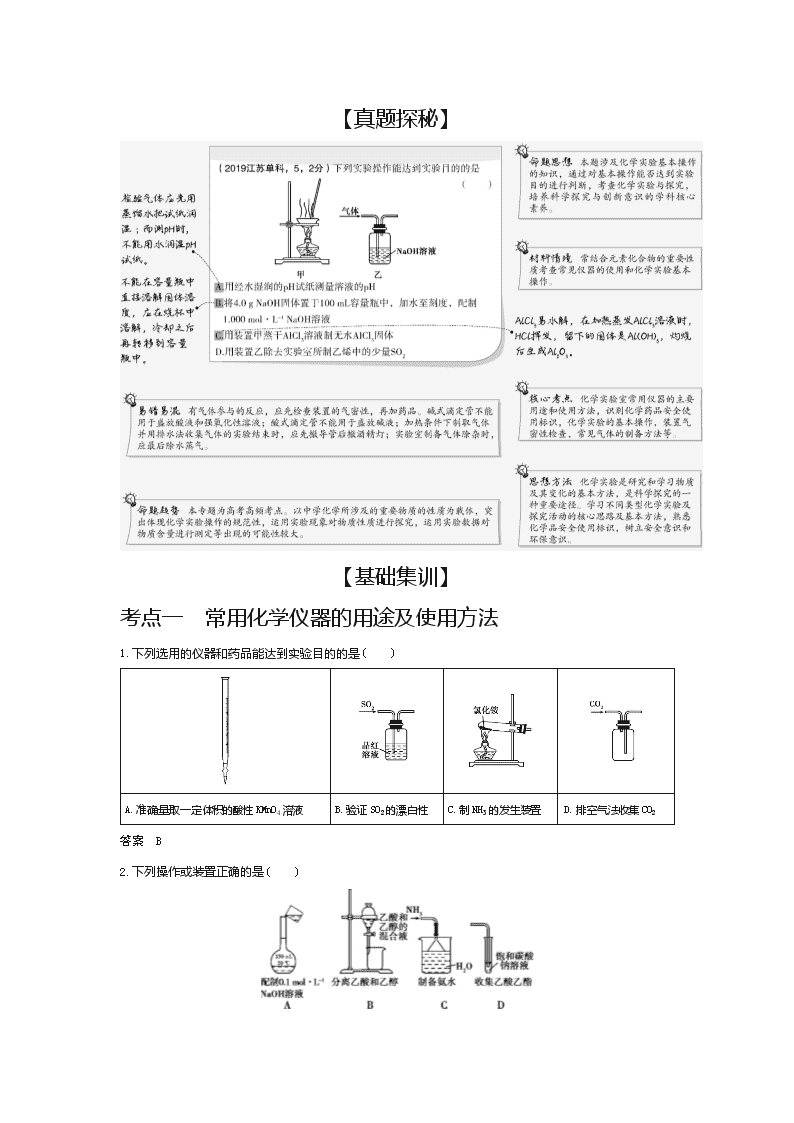
【真题探秘】
【基础集训】
考点一 常用化学仪器的用途及使用方法
1.下列选用的仪器和药品能达到实验目的的是( )
A.准确量取一定体积的酸性 KMnO4 溶液 B.验证 SO2 的漂白性 C.制 NH3 的发生装置 D.排空气法收集 CO2
答案 B
2.下列操作或装置正确的是( )
答案 C
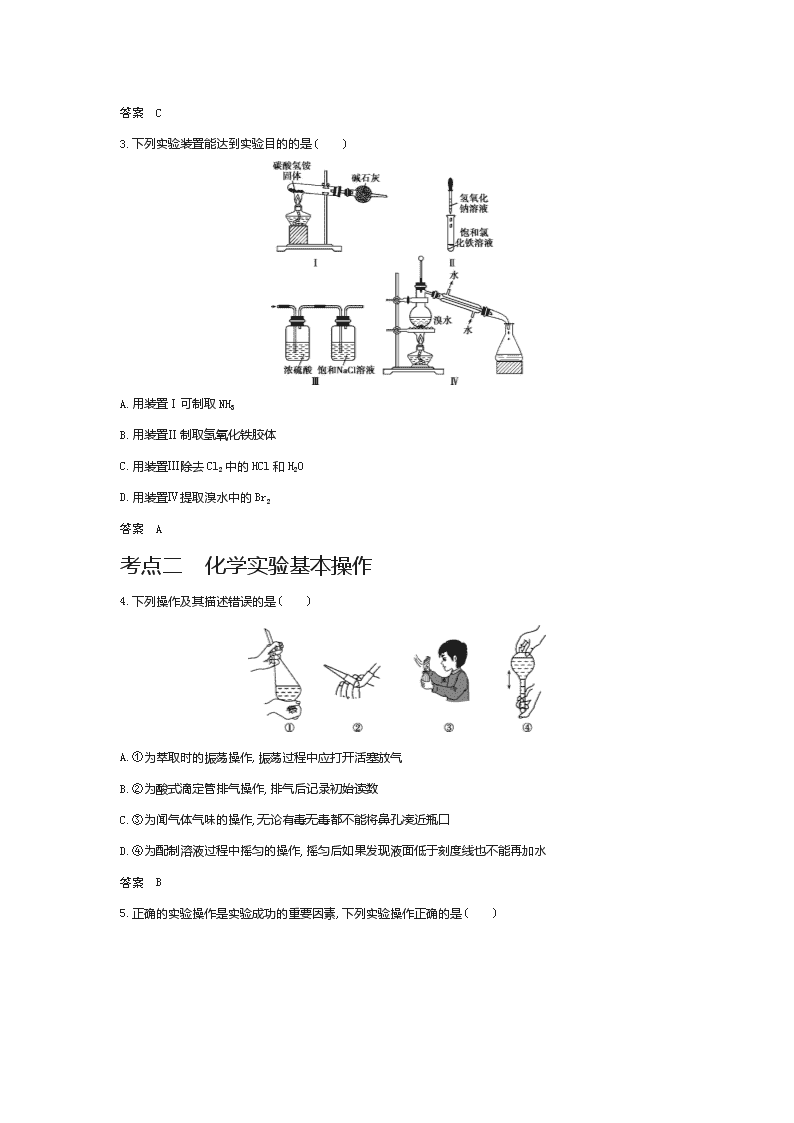
3.下列实验装置能达到实验目的的是( )
A.用装置Ⅰ可制取 NH3
B.用装置Ⅱ制取氢氧化铁胶体
C.用装置Ⅲ除去 Cl2 中的 HCl 和 H2O
D.用装置Ⅳ提取溴水中的 Br2
答案 A
考点二 化学实验基本操作
4.下列操作及其描述错误的是( )
A.①为萃取时的振荡操作,振荡过程中应打开活塞放气
B.②为酸式滴定管排气操作,排气后记录初始读数
C.③为闻气体气味的操作,无论有毒无毒都不能将鼻孔凑近瓶口
D.④为配制溶液过程中摇匀的操作,摇匀后如果发现液面低于刻度线也不能再加水
答案 B
5.正确的实验操作是实验成功的重要因素,下列实验操作正确的是( )
答案 A
6.洗涤仪器时,下列所选试剂合理的是( )
A.用稀盐酸洗涤沾有二氧化锰的烧杯
B.用稀硫酸洗涤做过银镜反应的试管
C.用水洗涤久置漂白粉的试剂瓶
D.用 CS2 洗涤沾有硫单质的圆底烧瓶
答案 D
【综合集训】
1.(2019 山西顶级名校模块诊断,16)用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加
热装置及气体收集装置均已略去;必要时可以加热;a、b、c、d 表示相应仪器中加入的试剂)。其中正确的
是( )
选项 气体 a b c d
A CO2 盐酸 CaCO3 饱和 Na2CO3 溶液 浓硫酸
B Cl2 浓盐酸 MnO2 NaOH 溶液 浓硫酸
C NH3 饱和 NH4Cl 溶液 消石灰 H2O 固体 NaOH
D NO 稀硝酸 铜屑 H2O 浓硫酸
答案 D
2.(2019 河南郑州一模,9)已知草酸晶体(H2C2O4·2H2O)的熔点为 101 ℃,170 ℃分解。下列选用的装置和药
品能达到实验目的的是( )
答案 D
3.(2018 贵州贵阳普通高中摸底,18)某校研究性学习小组选用如图装置组装制备纯净干燥的 NH3 并探究 NH3
与 CuO 发生的反应,同时检验和收集非固态产物。请回答下列问题:
(1)完成实验所需装置,按气流方向从左到右的连接顺序为 。
(2)连接好装置后应首先 ,然后添加药品进行实验。
(3)装置 A 中发生反应的化学方程式为 。
(4)装置 D 中盛放碱石灰的仪器名称是 ,装置 E 的作用是 。
(5)通过进一步检测发现装置 F 中收集到的气体是一种常见的单质气体,装置 C 的硬质玻璃管中得到一种固
体单质。试描述该小组同学还能观察到的其他现象: ;
装置 C 中发生反应的化学方程式为 。
答案 (1)ADCEGBF
(2)检查装置的气密性
(3)2NH4Cl+Ca(OH)2 CaCl2+2H2O+2NH3↑
(4)球形干燥管 检验 NH3 与 CuO 反应的产物中是否有水
(5)装置C硬质玻璃管中黑色固体逐渐变红,管壁上有液珠产生;装置E中白色固体逐渐变蓝 2NH 3+3CuO
3Cu+3H2O+N2
【应用集训】
1.(2019 黑龙江哈尔滨三中二模,6)实验室从废定影液[含 Ag(S2O3)3-2 和 Br-等]中回收 Ag 和 Br2的主要步骤为:
向废定影液中加入 Na2S 溶液沉淀银离子,过滤、洗涤及干燥,灼烧 Ag2S 制取金属 Ag;制取 Cl2 并将 Cl2 通入
滤液中氧化 Br-,用苯萃取分液。其中部分操作的装置如下图所示:
下列叙述正确的是( )
A.用装置甲分离 Ag2S 时,用玻璃棒不断搅拌
B.用装置乙在空气中高温灼烧 Ag2S 制取 Ag
C.用装置丙制备用于氧化滤液中 Br-的 Cl2
D.用装置丁分液时,先放出水相再放出有机相
答案 C
2.(2018 广东广州二模,10)实验室利用反应 TiO2(s)+CCl4(g) TiCl4(g)+CO2(g),在无水无氧条件下制取
TiCl4,实验装置如图所示(CCl4、TiCl4 的沸点分别为 76 ℃、136 ℃,CCl4 与 TiCl4 互溶,TiCl4 遇水发生水
解)。下列说法正确的是( )
A.①、⑤中分别盛装碱石灰、NaOH 溶液
B.②中热水的作用是使 CCl4 汽化,④中冰水的作用是使 TiCl4 冷凝
C.③中反应结束,先停止通 N2,再停止加热
D.分离④中圆底烧瓶中的液态混合物,采用的操作是分液
答案 B
3.(2018 安徽江南十校综合素质检测,11)下列有关实验操作的主要仪器、注意事项及应用举例都正确的是
( )
选项 实验操作 主要仪器 注意事项 应用举例
A 洗气 ① 从长管进气,短管出气 用饱和碳酸氢钠溶液除去 CO2 中的 SO2
B 气体干燥 ② 从粗管进气,细管出气 用无水氯化钙作干燥剂干燥氨气
C 分液 ③
先将下层液体从下口放出,再将上层
液体从下口放出
分离植物油和水的混合物
D 气体收集 ④ 从长管进气,短管出气 收集氯气
答案 A
【五年高考】
考点一 常用化学仪器的用途及使用方法
1.(2017 课标Ⅰ,10,6 分)实验室用 H2 还原 WO3 制备金属 W 的装置如图所示(Zn 粒中往往含有硫等杂质,焦性
没食子酸溶液用于吸收少量氧气)。下列说法正确的是( )
A.①、②、③中依次盛装 KMnO4 溶液、浓 H2SO4、焦性没食子酸溶液
B.管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C.结束反应时,先关闭活塞 K,再停止加热
D.装置 Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
答案 B
2.(2016 天津理综,5,6 分)下列选用的仪器和药品能达到实验目的的是( )
A B C D
制乙炔的发生装置 蒸馏时的接收装置 除去 SO2 中的少量 HCl 准确量取一定体积 K2Cr2O7 标准溶液
答案 C
3.(2019 课标Ⅲ,27,14 分)乙酰水杨酸(阿司匹林)是目前常用药物之一。实验室通过水杨酸进行乙酰化制备
阿司匹林的一种方法如下:
+(CH3CO)2O
醋酸酐
+CH3COOH
水杨酸 醋酸酐 乙酰水杨酸
熔点/℃ 157~159 -72~-74 135~138
相对密度/(g·cm-3) 1.44 1.10 1.35
相对分子质量 138 102 180
实验过程:在 100 mL 锥形瓶中加入水杨酸 6.9 g 及醋酸酐 10 mL,充分摇动使固体完全溶解。缓慢滴加
0.5 mL 浓硫酸后加热,维持瓶内温度在 70 ℃左右,充分反应。稍冷后进行如下操作。
①在不断搅拌下将反应后的混合物倒入 100 mL 冷水中,析出固体,过滤。
②所得结晶粗品加入 50 mL 饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤得固体。
④固体经纯化得白色的乙酰水杨酸晶体 5.4 g。
回答下列问题:
(1)该合成反应中应采用 加热。(填标号)
A.热水浴 B.酒精灯 C.煤气灯 D.电炉
(2)下列玻璃仪器中,①中需使用的有 (填标号),不需使用的有 (填名称)。
(3)①中需使用冷水,目的是 。
(4)②中饱和碳酸氢钠的作用是 ,以便过滤除去难溶杂质。
(5)④采用的纯化方法为 。
(6)本实验的产率是 %。
答案 (1)A
(2)BD 分液漏斗、容量瓶
(3)充分析出乙酰水杨酸固体(结晶)
(4)生成可溶的乙酰水杨酸钠
(5)重结晶
(6)60
考点二 化学实验基本操作
4.(2019 课标Ⅱ,10,6 分)下列实验现象与实验操作不相匹配的是 ( )
实验操作 实验现象
A. 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 溶液的紫色逐渐褪去,静置后溶液分层
B. 将镁条点燃后迅速伸入集满 CO2 的集气瓶 集气瓶中产生浓烟并有黑色颗粒产生
C. 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 有刺激性气味气体产生,溶液变浑浊
D. 向盛有 FeCl3 溶液的试管中加过量铁粉,充分振荡后加 1 滴 KSCN 溶液 黄色逐渐消失,加 KSCN 后溶液颜色不变
答案 A
5.(2018 课标Ⅲ,10,6 分)下列实验操作不当的是( )
A.用稀硫酸和锌粒制取 H2 时,加几滴 CuSO4 溶液以加快反应速率
B.用标准 HCl 溶液滴定 NaHCO3 溶液来测定其浓度,选择酚酞为指示剂
C.用铂丝蘸取某碱金属的盐溶液灼烧,火焰呈黄色,证明其中含有 Na+
D.常压蒸馏时,加入液体的体积不超过圆底烧瓶容积的三分之二
答案 B
6.(2017 课标Ⅲ,9,6 分)下列实验操作规范且能达到目的的是( )
目的 操作
A. 取 20.00 mL 盐酸
在 50 mL 酸式滴定管中装入盐酸,调整初始读数为 30.00 mL 后,
将剩余盐酸放入锥形瓶
B. 清洗碘升华实验所用试管 先用酒精清洗,再用水清洗
C. 测定醋酸钠溶液 pH 用玻璃棒蘸取溶液,点在湿润的 pH 试纸上
D.
配制浓度为 0.010 mol·L-1的 KMnO4溶
液
称取 KMnO4 固体 0.158 g,放入 100 mL 容量瓶中,加水溶解并稀释
至刻度
答案 B
7.(2017 江苏单科,4,2 分)下列制取 SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目
的的是( )
答案 B
8.(2016 课标Ⅰ,10,6 分)下列实验操作能达到实验目的的是( )
A.用长颈漏斗分离出乙酸与乙醇反应的产物
B.用向上排空气法收集铜粉与稀硝酸反应产生的 NO
C.配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释
D.将 Cl2 与 HCl 混合气体通过饱和食盐水可得到纯净的 Cl2
答案 C
9.(2016 课标Ⅲ,9,6 分)下列有关实验的操作正确的是( )
实验 操作
A. 配制稀硫酸 先将浓硫酸加入烧杯中,后倒入蒸馏水
B. 排水法收集 KMnO4 分解产生的 O2 先熄灭酒精灯,后移出导管
C. 浓盐酸与 MnO2 反应制备纯净 Cl2 气体产物先通过浓硫酸,后通过饱和食盐水
D. CCl4 萃取碘水中的 I2 先从分液漏斗下口放出有机层,后从上口倒出水层
答案 D
10.(2016 浙江理综,8,6 分)下列叙述不正确的是( )
A.钾、钠、镁等活泼金属着火时,不能用泡沫灭火器灭火
B.探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再用水浴加热至设定温度,
则测得的反应速率偏高
C.蒸馏完毕后,应先停止加热,待装置冷却后,停止通水,再拆卸蒸馏装置
D.为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线时,改用滴管滴加蒸
馏水至刻度线
答案 B
11.(2016 江苏单科,6,2 分)根据侯氏制碱原理制备少量 NaHCO3 的实验,经过制取氨气、制取 NaHCO3、分离
NaHCO3、干燥 NaHCO3 四个步骤。下列图示装置和原理能达到实验目的的是( )
答案 C
12.(2016 课标Ⅲ,26,14 分)过氧化钙微溶于水,溶于酸,可用作分析试剂、医用防腐剂、消毒剂。以下是一
种制备过氧化钙的实验方法。回答下列问题:
(一)碳酸钙的制备
(1)步骤①加入氨水的目的是 。小火煮沸的作用是使沉淀颗粒长大,有利
于 。
(2)如图是某学生的过滤操作示意图,其操作不规范的是 (填标号)。
a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(二)过氧化钙的制备
(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈 性(填“酸”“碱”
或“中”)。将溶液煮沸,趁热过滤。将溶液煮沸的作用是 。
(4)步骤③中反应的化学方程式为 ,该反应需要在冰浴下进
行,原因是 。
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是 。
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该
工艺方法的优点是 ,产品的缺点是 。
答案 (1)调节溶液 pH 使 Fe(OH)3 沉淀(1 分) 过滤分离(1 分)
(2)ade(3 分)
(3)酸(1 分) 除去溶液中的 CO2(1 分)
(4)CaCl2+2NH3·H2O+H2O2+6H2O CaO2·8H2O↓+2NH4Cl 或 CaCl2+2NH3·H2O+H2O2
CaO2↓+2NH4Cl+2H2O(2 分) 温度过高时双氧水易分解(1 分)
(5)去除结晶表面水分(2 分)
(6)工艺简单、操作方便(1 分) 纯度较低(1 分)
教师专用题组
考点一 常用化学仪器的用途及使用方法
1.(2015 安徽理综,8,6 分)下列有关实验的选项正确的是 ( )
A.配制 0.10 mol·L-1NaOH 溶
液
B.除去 CO 中的 CO2
C.苯萃取碘水中 I2,分出水层后的
操作
D.记录滴定终点读数为 12.20
mL
答案 B
考点二 化学实验基本操作
2.(2015 山东理综,7,5 分)进行化学实验时应强化安全意识。下列做法正确的是( )
A.金属钠着火时使用泡沫灭火器灭火
B.用试管加热碳酸氢钠固体时使试管口竖直向上
C.浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗
D.制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片
答案 D
3.(2015 福建理综,8,6 分)下列实验操作正确且能达到相应实验目的的是( )
实验目的 实验操作
A 称取 2.0 g NaOH 固体 先在托盘上各放 1 张滤纸,然后在右盘上添加 2 g 砝码,左盘上添加 NaOH 固体
B 配制 FeCl3 溶液 将 FeCl3 固体溶于适量蒸馏水
C 检验溶液中是否含 NH+4 取少量试液于试管中,加入 NaOH 溶液并加热,用湿润的红色石蕊试纸检验产生的气体
D 验证铁的吸氧腐蚀 将铁钉放入试管中,用盐酸浸没
答案 C
4.(2015 江苏单科,7,2 分)下列实验操作正确的是( )
A.用玻璃棒蘸取 CH3COOH 溶液点在水湿润的 pH 试纸上,测定该溶液的 pH
B.中和滴定时,滴定管用所盛装的反应液润洗 2~3 次
C.用装置甲分液,放出水相后再从分液漏斗下口放出有机相
D.用装置乙加热分解 NaHCO3 固体
答案 B
5.(2016 浙江理综,29,15 分)无水 MgBr2 可用作催化剂。实验室采用镁屑与液溴为原料制备无水 MgBr2,装置
如下图,主要步骤如下:
步骤 1 三颈瓶中装入 10 g 镁屑和 150 mL 无水乙醚;装置 B 中加入 15 mL 液溴。
步骤 2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤 3 反应完毕后恢复至常温,过滤,滤液转移至另一干燥的烧瓶中,冷却至 0 ℃,析出晶体,再过滤得三乙
醚合溴化镁粗品。
步骤 4 室温下用苯溶解粗品,冷却至 0 ℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至 160 ℃分解得无
水 MgBr2 产品。
已知:①Mg 与 Br2 反应剧烈放热;MgBr2 具有强吸水性。
②MgBr2+3C2H5OC2H5 MgBr2·3C2H5OC2H5
请回答:
(1)仪器 A 的名称是 。实验中不能用干燥空气代替干燥 N2,原因
是 。
(2)如将装置 B 改为装置 C,可能会导致的后果是 。
(3)步骤 3 中,第一次过滤除去的物质是 。
(4)有关步骤 4 的说法,正确的是 。
A.可用 95%的乙醇代替苯溶解粗品
B.洗涤晶体可选用 0 ℃的苯
C.加热至 160 ℃的主要目的是除去苯
D.该步骤的目的是除去乙醚和可能残留的溴
(5)为测定产品的纯度,可用 EDTA(简写为 Y4-)标准溶液滴定,反应的离子方程式:
Mg2++Y4- MgY2-
①滴定前润洗滴定管的操作方法是 。
②测定时,先称取 0.250 0 g 无水 MgBr2 产品,溶解后,用 0.050 0 mol·L-1 的 EDTA 标准溶液滴定至终点,消
耗 EDTA 标准溶液 26.50 mL,则测得无水 MgBr2 产品的纯度是 (以质量分数表示)。
答案 (1)干燥管 防止镁屑与氧气反应,生成的 MgO 阻碍 Mg 与 Br2 的反应
(2)会将液溴快速压入三颈瓶,反应过快大量放热而存在安全隐患 (3)镁屑 (4)BD
(5)①从滴定管上口加入少量待装液,倾斜着转动滴定管,使液体润湿内壁,然后从下部放出,重复 2~3 次
②97.5%
【三年模拟】
时间:40 分钟 分值:75 分
一、选择题(每题 6 分,共 42 分,每小题只有一个选项正确)
1.(2020 届湖北名师联盟月考,9)下列有关实验装置的说法中正确的是( )
A.用图 1 装置制取干燥纯净的 NH3
B.用图 2 装置制备 Fe(OH)2 并能较长时间观察其颜色
C.用图 3 装置可以完成“喷泉”实验
D.用图 4 装置测量 Cu 与浓硝酸反应产生气体的体积
答案 C
2.(2019 河北衡水质量测评,9)某化学实验小组以高锰酸钾为原料制备氧气并回收二氧化锰。下列有关操作
示意图正确的是( )
答案 C
3.(2019 广东化州联考,13)用下列实验方案及所选玻璃仪器(非玻璃仪器任选)就能实现相应实验目的的是
( )
实验目的 实验方案 所选玻璃仪器
A 除去 KNO3 中少量 NaCl 将混合物制成热的饱和溶液,冷却结晶,过滤
酒精灯、烧杯、玻璃
棒
B
证明 HClO 和 CH3COOH 的酸性
强弱
同温下用 pH 试纸测定 0.1 mol·L-1 NaClO 溶液和 0.1
mol·L-1 CH3COONa 溶液的 pH
玻璃棒、玻璃片
C 检验蔗糖水解产物具有还原 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中 试管、烧杯、酒精灯、
性 加入新制的银氨溶液,并水浴加热 胶头滴管
D
配制 1 L 1.6%的 CuSO4 溶液(溶
液密度近似为 1 g/mL)
将 25 g CuSO4·5H2O 溶解在 975 mL 水中 烧杯、量筒、玻璃棒
答案 D
4.(2019 广东广州外国语学校一模,10)实验是化学研究的基础,下图关于各实验装置(夹持装置已略去)的叙
述,正确的是( )
答案 A
5.(2019 江西上饶六校联考,9)下列选项中的实验操作、现象与结论完全一致的是( )
选项 实验操作 现象 结论
A 用玻璃棒蘸取次氯酸钠溶液,点在 pH 试纸上 试纸最终显蓝色 次氯酸钠溶液显碱性
B
用 pH 试纸分别测定 0.1 mol·L-1 的 Na2CO3 溶液
和 0.1 mol·L-1 的 NaHCO3 溶液的 pH
Na2CO3 溶液的 pH 约为 10,NaHCO3
溶液的 pH 约为 8
结合 H+能力:CO2-3 >HCO-3
C
用坩埚钳夹住一小块用砂纸打磨过的铝箔在
酒精灯上加热
熔化后的液态铝滴落下来 金属铝的熔点低
D 分别将乙烯与 SO2 通入溴水中 溴水均褪色
两种气体使溴水褪色的
原理相同
答案 B
6.(2019 四川大学附中月考,12)下列有关实验操作或判断正确的有( )
①用 10 mL 量筒准确量取稀硫酸 8.0 mL;
②用干燥的 pH 试纸测定氯水的 pH;
③能说明亚硝酸是弱电解质的是:用 HNO2 溶液进行导电实验,灯泡很暗;
④使用容量瓶配制溶液时,俯视刻度线定容后所得溶液的浓度偏大;
⑤将饱和 FeCl3 溶液滴入蒸馏水中即得 Fe(OH)3 胶体;
⑥圆底烧瓶、锥形瓶、蒸发皿加热时都应垫上石棉网;
⑦除去铁粉中混有的少量铝粉可加入过量的氢氧化钠溶液,完全反应后过滤;
⑧为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔融氢氧化钠固体后进行测量;
⑨用食醋除去水壶中的水垢。
A.3 个 B.4 个 C.5 个 D.6 个
答案 B
7.(2019 湖南岳阳二检,9)某学生利用以下装置探究喷泉实验。其中 A、F 分别为硫化氢和氯气的发生装置,C
为纯净干燥的氯气与硫化氢反应的装置。打开 K1、K2,将常温常压下的 H2S、Cl2 控制等体积通入烧瓶且最终
气体刚好充满烧瓶。
下列说法正确的是( )
A.装置 A 中的分液漏斗内液体 a 可选用稀硝酸
B.虚线框 B、D、E 内从“备选装置”中选择合适装置的编号依次为Ⅲ、Ⅱ、Ⅰ
C.立即看到烧瓶内产生“喷泉”
D.本实验必须对烧瓶冷敷或热敷来引发喷泉
答案 D
二、选择题(每题 6 分,共 18 分,每小题有一个或两个选项正确)
8.(2020 届福建福州月考,8)下列有关实验装置中进行的相应实验,不能达到实验目的的是( )
A.用图①所示装置制取少量纯净的 CO2 气体
B.用图②所示装置验证镁和盐酸反应的热效应
C.用图③所示装置验证 HCl 气体易溶于水
D.用图④所示装置检验 NH4Cl 分解产生的气体
答案 A
9.(2019 山东四校联考)使用下列实验装置进行相应的实验,能达到实验目的的是( )
答案 AC
10.(2020 届山东德州期中,14)下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 实验 现象 结论
A 向稀硝酸中加入过量铁粉,充分反应后滴加 KSCN 溶液 有气体生成,溶液呈血红色 稀硝酸将 Fe 氧化为 Fe3+
B 向 1.0 mol·L-1 Fe2(SO4)3 溶液中加入铜粉 溶液变蓝、有黑色固体出现 金属铁比铜活泼
C 用铂丝蘸取少量某溶液进行焰色反应 火焰呈黄色 该溶液含钠元素
D 蘸有浓氨水的玻璃棒靠近某溶液 有白烟产生 该溶液可能是浓盐酸
答案 CD
三、非选择题(共 15 分)
11.(2020 届河南顶级名校摸底,22)(15 分)氯化亚砜(SOCl2)常用于医药、农药、染料工业,也可在有机合成
工业中作氯化剂。已知 SOCl2 的相关性质如下表所示:
颜色、状态 熔点 沸点 腐蚀性 水解
无色或微黄液体 -105 ℃ 78 ℃ 强 极易水解
现利用如图装置制备 SOCl2。
甲
请回答下列问题:
Ⅰ.制备 SO2 和 Cl2。
(1)本实验选用装置甲制备 SO2 和 Cl2,装置甲中仪器 x 的名称为 ;若以 KMnO4 和浓盐酸反应制备
Cl2,反应的离子方程式为 。
Ⅱ.制备 SOCl2。
以活性炭作为催化剂,SO2 和 Cl2 可以和 S 粉在 180~200 ℃时反应合成 SOCl2,选用装置 A、B、C、D 进行制备
(夹持、加热装置略去)。
(2)按气流从左到右的方向,装置 A、B、C、D 的连接顺序为 (填仪器接口的字母编号)。
(3)试剂 y 为 (填选项字母,下同);试剂 z 为 。
A.热水 B.乙醇 C.石蜡油 D.冰水
(4)装置 A 中 U 形管内发生反应的化学方程式为 。
(5)装置 C 的作用为 ;若装置 A 处通入的 SO2 和 Cl2 的物质的量之比为 1∶3,则装置 C 中生成
的盐为 (填化学式);请设计实验验证装置 C 中生成的盐中含有
SO2-4 : 。
答案 (1)分液漏斗
2MnO-4+16H++10Cl- 2Mn2++5Cl2↑+8H2O
(2)afg(gf)bcde (3)C D
(4)SO2+2Cl2+S 2SOCl2
(5)尾气处理(或吸收未反应的 SO2 和 Cl2) NaCl、NaClO 和 Na2SO4 取少量装置 C 中溶液于试管中,加稀盐
酸酸化,无气体生成,继续滴加 BaCl2 溶液,生成白色沉淀,证明有 SO2-4