- 322.00 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第三章 晶体结构与性质
第一节 晶体的常识
课时演练·促提升
A组
1.下列哪些性质不能区分晶体与非晶体( )
A.各向异性 B.X-射线衍射
C.导电性 D.有无固定熔点
解析:根据晶体的特点和性质可知,晶体具有规则的几何外形,具有各向异性;衍射时能看到明显的谱线。有的晶体也不容易导电。
答案:C
2.不能够支持石墨是晶体这一事实的选项是( )
A.石墨和金刚石是同素异形体
B.石墨中的碳原子呈周期性有序排列
C.石墨的熔点为3 625 ℃
D.在石墨的X-射线衍射图谱上有明锐的谱线
解析:原子在三维空间里呈有序排列(B项)、有自范性、有固定的熔点(C项)、物理性质上体现各向异性、X-射线衍射图谱上有分明的斑点或明锐的谱线(D项)等特征,都是晶体在各个方面有别于非晶体的体现。而是否互为同素异形体与是否为晶体这两者之间并无联系,如无定形碳也是金刚石、石墨的同素异形体,却属于非晶体。
答案:A
3.下列有关晶体和非晶体的说法中正确的是( )
A.具有规则几何外形的固体均为晶体
B.晶体具有自范性,非晶体没有自范性
C.晶体研碎后即变为非晶体
D.将玻璃加工成规则的固体即变成晶体
解析:晶体的规则几何外形是自发形成的,有些固体尽管有规则的几何外形,但由于不是自发形成的,所以不属于晶体,A、D项错误;晶体是由晶胞通过无隙并置形成的,组成晶体的粒子在三维空间呈现周期性的有序排列,因此,晶体研碎成小的颗粒仍然是晶体,C项错误;自范性是晶体与非晶体的本质区别,B项正确。
答案:B
4.如图是a、b两种物质的熔化曲线,下列说法中正确的是( )
①a是晶体 ②a是非晶体 ③b是晶体 ④b是非晶体
A.①④ B.②④ C.①③ D.②③
解析:晶体有固定的熔点,由图a来分析,中间有一段a物质的温度不变但一直在吸收能量,
这段就表示a晶体在熔化;由图b可知,b物质的温度一直在升高,所以找不出固定的熔点,故b为非晶体。
答案:A
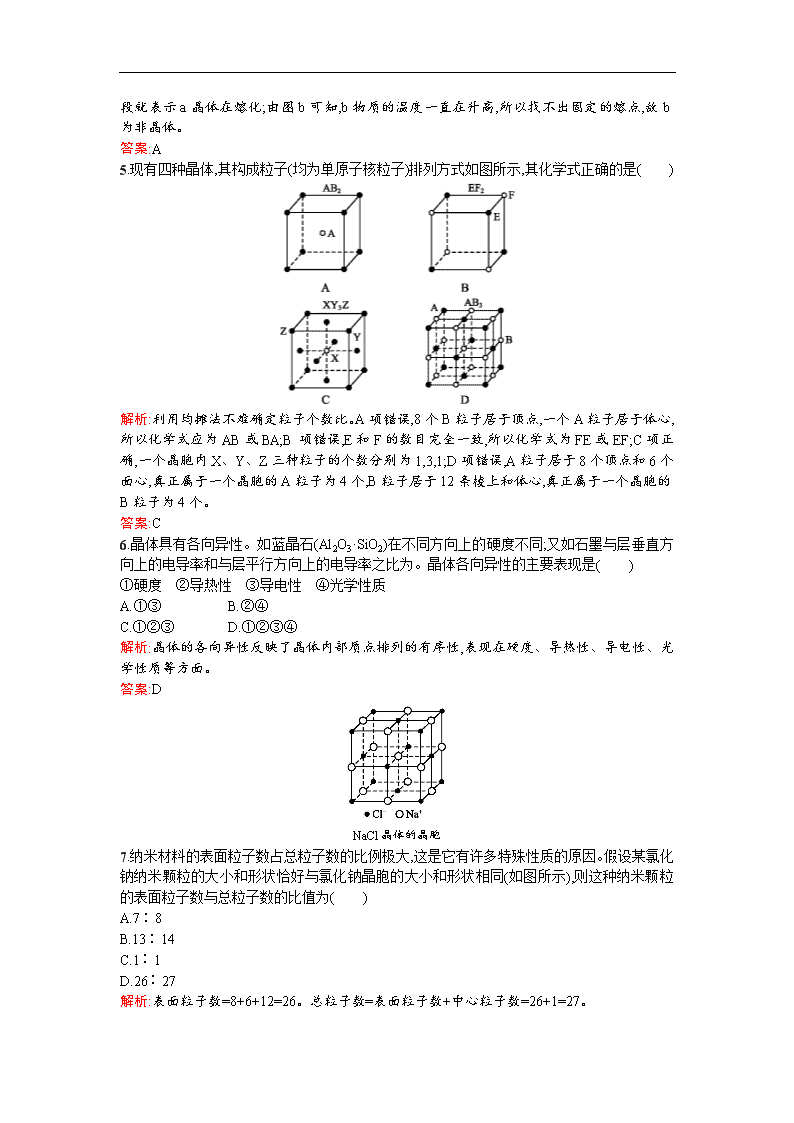
5.现有四种晶体,其构成粒子(均为单原子核粒子)排列方式如图所示,其化学式正确的是( )
解析:利用均摊法不难确定粒子个数比。A项错误,8个B粒子居于顶点,一个A粒子居于体心,所以化学式应为AB或BA;B项错误,E和F的数目完全一致,所以化学式为FE或EF;C项正确,一个晶胞内X、Y、Z三种粒子的个数分别为1,3,1;D项错误,A粒子居于8个顶点和6个面心,真正属于一个晶胞的A粒子为4个,B粒子居于12条棱上和体心,真正属于一个晶胞的B粒子为4个。
答案:C
6.晶体具有各向异性。如蓝晶石(Al2O3·SiO2)在不同方向上的硬度不同;又如石墨与层垂直方向上的电导率和与层平行方向上的电导率之比为。晶体各向异性的主要表现是( )
①硬度 ②导热性 ③导电性 ④光学性质
A.①③ B.②④
C.①②③ D.①②③④
解析:晶体的各向异性反映了晶体内部质点排列的有序性,表现在硬度、导热性、导电性、光学性质等方面。
答案:D
NaCl晶体的晶胞
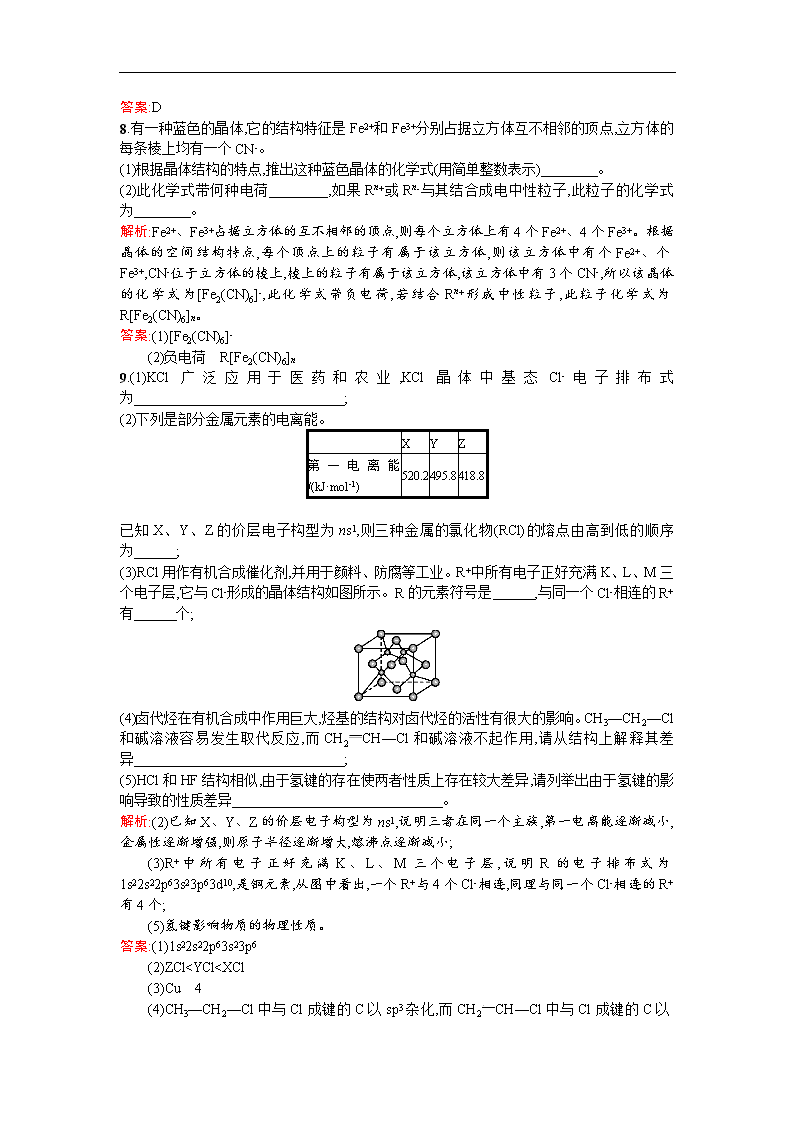
7.纳米材料的表面粒子数占总粒子数的比例极大,这是它有许多特殊性质的原因。假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同(如图所示),则这种纳米颗粒的表面粒子数与总粒子数的比值为( )
A.7∶8
B.13∶14
C.1∶1
D.26∶27
解析:表面粒子数=8+6+12=26。总粒子数=表面粒子数+中心粒子数=26+1=27。
答案:D
8.有一种蓝色的晶体,它的结构特征是Fe2+和Fe3+分别占据立方体互不相邻的顶点,立方体的每条棱上均有一个CN-。
(1)根据晶体结构的特点,推出这种蓝色晶体的化学式(用简单整数表示) 。
(2)此化学式带何种电荷 ,如果Rn+或Rn-与其结合成电中性粒子,此粒子的化学式为 。
解析:Fe2+、Fe3+占据立方体的互不相邻的顶点,则每个立方体上有4个Fe2+、4个Fe3+。根据晶体的空间结构特点,每个顶点上的粒子有属于该立方体,则该立方体中有个Fe2+、个Fe3+,CN-位于立方体的棱上,棱上的粒子有属于该立方体,该立方体中有3个CN-,所以该晶体的化学式为[Fe2(CN)6]-,此化学式带负电荷,若结合Rn+形成中性粒子,此粒子化学式为R[Fe2(CN)6]n。
答案:(1)[Fe2(CN)6]-
(2)负电荷 R[Fe2(CN)6]n
9.(1)KCl广泛应用于医药和农业,KCl晶体中基态Cl-电子排布式为 ;
(2)下列是部分金属元素的电离能。
X
Y
Z
第一电离能/(kJ·mol-1)
520.2
495.8
418.8
已知X、Y、Z的价层电子构型为ns1,则三种金属的氯化物(RCl)的熔点由高到低的顺序为 ;
(3)RCl用作有机合成催化剂,并用于颜料、防腐等工业。R+中所有电子正好充满K、L、M三个电子层,它与Cl-形成的晶体结构如图所示。R的元素符号是 ,与同一个Cl-相连的R+有 个;
(4)卤代烃在有机合成中作用巨大,烃基的结构对卤代烃的活性有很大的影响。CH3—CH2—Cl和碱溶液容易发生取代反应,而CH2CH—Cl和碱溶液不起作用,请从结构上解释其差异 ;
(5)HCl和HF结构相似,由于氢键的存在使两者性质上存在较大差异,请列举出由于氢键的影响导致的性质差异 。
解析:(2)已知X、Y、Z的价层电子构型为ns1,说明三者在同一个主族,第一电离能逐渐减小,金属性逐渐增强,则原子半径逐渐增大,熔沸点逐渐减小;
(3)R+中所有电子正好充满K、L、M三个电子层,说明R的电子排布式为1s22s22p63s23p63d10,是铜元素,从图中看出,一个R+与4个Cl-相连,同理与同一个Cl-相连的R+有4个;
(5)氢键影响物质的物理性质。
答案:(1)1s22s22p63s23p6
(2)ZCl