- 1.78 MB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1.了解水的电离、离子积常数(KW)。 2.了解溶液pH的含义及其测定方法,能进行pH的简单计算。 3.理解弱电解质在水中的电离平衡,能利用电离平衡常数(Ka、Kb、Kh)进行相关计算。 4.了解盐类水解的原理,影响盐类水解程度的主要因素,盐类水解的应用。 5.了解难溶电解质的沉淀溶解平衡。理解溶度积(Ksp)的含义,能进行相关的计算。 6.以上各部分知识的综合运用。
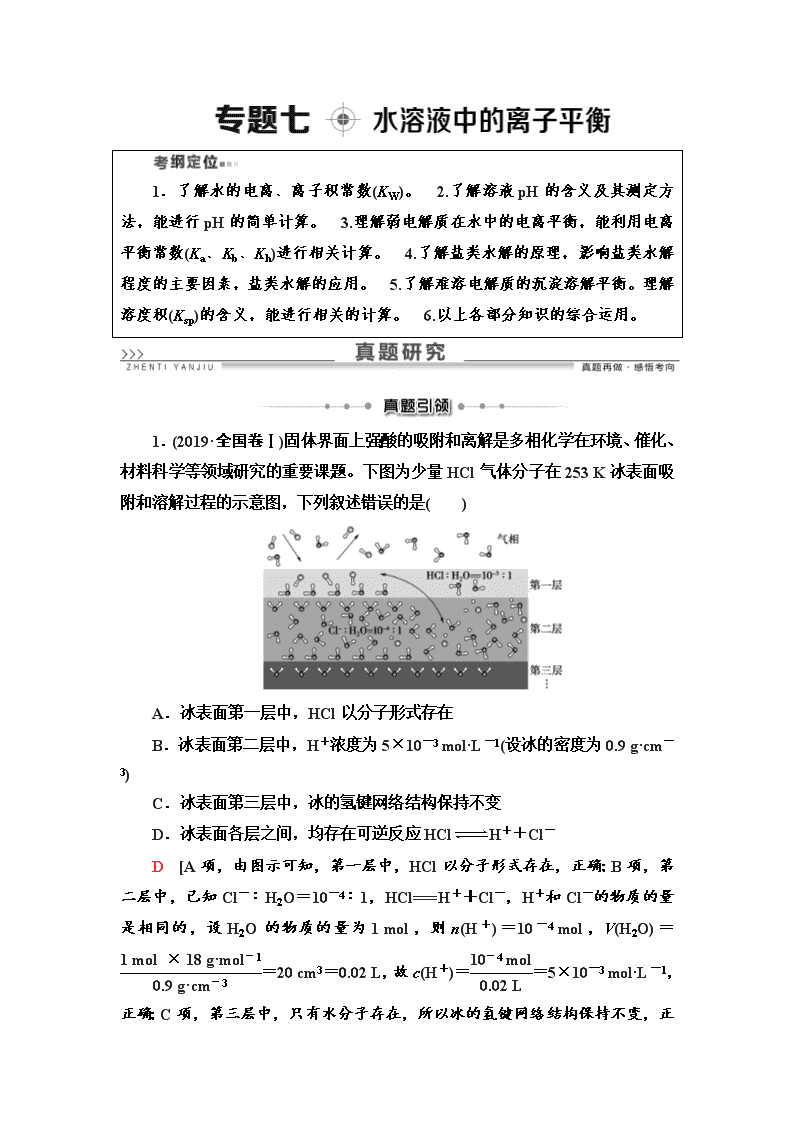
1.(2019·全国卷Ⅰ)固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。下图为少量HCl气体分子在253 K冰表面吸附和溶解过程的示意图,下列叙述错误的是( )
A.冰表面第一层中,HCl以分子形式存在
B.冰表面第二层中,H+浓度为5×10-3 mol·L-1(设冰的密度为0.9 g·cm-3)
C.冰表面第三层中,冰的氢键网络结构保持不变
D.冰表面各层之间,均存在可逆反应HClH++Cl-
D [A项,由图示可知,第一层中,HCl以分子形式存在,正确;B项,第二层中,已知Cl-∶H2O=10-4∶1,HCl===H++Cl-,H+和Cl-的物质的量是相同的,设H2O的物质的量为1 mol,则n(H+)=10-4 mol,V(H2O)==20 cm3=0.02 L,故c(H+)==5×10-3 mol·L-1
,正确;C项,第三层中,只有水分子存在,所以冰的氢键网络结构保持不变,正确;D项,由A项、C项分析可知,第一层和第三层中的物质均以分子形式存在,故均不存在可逆反应HClH++Cl-,错误。]
2.(2019·全国卷Ⅰ)NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10-3,Ka2=3.9×10-6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是( )
A.混合溶液的导电能力与离子浓度和种类有关
B.Na+与A2-的导电能力之和大于HA-的
C.b点的混合溶液pH=7
D.c点的混合溶液中,c(Na+)>c(K+)>c(OH-)
C [A项,溶液导电能力的强弱与溶液中自由移动的离子浓度和种类有关,正确;B项,由图像知,a点到b点,HA-转化为A2-,b点导电能力相对于a点增强,可判断Na+和A2-的导电能力之和大于HA-的,正确;C项,b点为反应终点,发生的反应为2KHA+2NaOH===Na2A+K2A+2H2O。因为H2A为弱酸,所以Na2A、K2A溶液显碱性,pH>7,错误;D项,c点为Na2A、K2A和NaOH的混合溶液,由图像经分析可知c(Na+)>c(K+)>c(OH-),正确。]
3.(2018·全国卷Ⅱ,节选)测定K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)中铁的含量。
(1)称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是_____________。
(2)向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为________。
[解析] (1)将C2O氧化成CO2,达到滴定终点时,KMnO4稍过量,溶液中出现粉红色且半分钟内不变色。(2)加入过量锌粉能将溶液中Fe3+还原为Fe2+,酸化后Fe2+与KMnO4溶液反应,根据化合价变化可找出关系式为5Fe2+
~MnO,根据消耗KMnO4溶液的浓度和体积可知溶液中n(Fe2+)=c mol·L-1×V×10-3 L×5=5×10-3cV mol,则该晶体中铁元素的质量分数为×100%或×100%。
[答案] (1)当滴入最后一滴标准液后,溶液变为粉红色,且半分钟内不变色 (2)×100%
4.(2018·全国卷Ⅲ)用0.100 mol·L-1 AgNO3滴定50.0 mL 0.050 0 mol·L-1 Cl-溶液的滴定曲线如图所示。下列有关描述错误的是( )
A.根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
B.曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl)
C.相同实验条件下,若改为0.040 0 mol·L-1 Cl-,反应终点c移到a
D.相同实验条件下,若改为0.050 0 mol·L-1 Br-,反应终点c向b方向移动
C [根据滴定曲线,当加入25 mL AgNO3溶液时,Ag+与Cl-刚好完全反应,AgCl处于沉淀溶解平衡状态,此时溶液中c(Ag+)=c(Cl-)=10-4.75 mol·L-1,Ksp(AgCl)=c(Ag+)·c(Cl-)=10-9.5≈3.16×10-10,A项正确;曲线上各点都处于沉淀溶解平衡状态,故符合c(Ag+)·c(Cl-)=Ksp(AgCl),B项正确;根据图示,Cl-浓度为0.050 0 mol·L-1时消耗25 mL AgNO3溶液,则Cl-浓度为0.040 0 mol·L-1时消耗20 mL AgNO3溶液,a点对应AgNO3溶液体积为15 mL,所以反应终点不可能由c点移到a点,C项错误;由于AgBr的Ksp小于AgCl的Ksp,初始c(Br-)与c(Cl-)相同时,反应终点时消耗的AgNO3溶液体积相同,但Br-浓度小于Cl-浓度,即反应终点从曲线上的c点向b点方向移动,D项正确。]
5.(2017·全国卷Ⅰ)常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )
A.Ka2(H2X)的数量级为10-6
B.曲线N表示pH与lg 的变化关系
C.NaHX溶液中c(H+)>c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
D [由Ka1≫Ka2,则- lgKa1<-lgKa2。当lg =lg 时,有pH1c(OH-),C项正确。
由以上分析可知,HX-的电离程度大于其水解程度,故当溶液呈中性时,c(Na2X)>c(NaHX),溶液中各离子浓度大小关系为c(Na+)>c(X2-)>c(HX-)>c(OH-)=c(H+),D项错误。]
6.(1)(2017·全国卷Ⅰ,节选)若“滤液②”中c(Mg2+)=0.02 mol·L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5 mol·L-1,此时是否有Mg3(PO4)2沉淀生成?
______________________________________________________
______________________________________________________
______________________________________________________
(列式计算)。FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(2)(2015·全国卷Ⅱ,节选)已知:Ksp[Fe(OH)3]=1×10-39,Ksp[Zn(OH)2]=10-17,Ksp[Fe(OH)2]=1.6×10-14。用废电池的锌皮制备ZnSO4·7H2O的过程中,需除去锌皮中的少量杂质铁,其方法是加稀H2SO4和H2O2溶解,铁变为________,加碱调节至pH为______时,铁刚好沉淀完全(离子浓度小于1×10-5mol·L-1时,即可认为该离子沉淀完全);继续加碱至pH为________时,锌开始沉淀(假定Zn2+浓度为0.1 mol·L-1)。若上述过程不加H2O2后果是_____________
______________________________________________________,
原因是____________________________________________。
[解析] (2)根据氢氧化铁的溶度积常数可知,当铁离子完全沉淀时溶液中氢氧根的浓度为mol·L-1≈5×10-12mol·L-1,所以氢离子浓度是2×10-3mol·L-1,因此加碱调节pH为2.7,Fe3+刚好完全沉淀。Zn2+浓度为0.1 mol·L-1,根据氢氧化锌的溶度积常数可知开始沉淀时的氢氧根浓度为10-8mol·L-1,则pH=6,即继续加碱调节pH为6,锌开始沉淀。如果不加双氧水,则在沉淀锌离子的同时亚铁离子也沉淀,导致生成的氢氧化锌不纯,无法分离开Zn2+和Fe2+。
[答案] (1)Fe3+恰好沉淀完全时,c(PO)=
mol·L-1=1.3×10-17 mol·L-1,
c3(Mg2+)·c2(PO)
=(0.02×)3×(1.3×10-17)2≈1.7×10-40n(H+):c(OH-)=⇒c(H+)⇒pH
(2)n(OH-)7
pH<7
(2)已知酸、碱溶液的pH之和为14,若混合后溶液的pH为7,溶液呈中性,则
―→V酸∶V碱=1∶1
―→V酸∶V碱>1∶1
―→V酸∶V碱<1∶1
(3)强酸、强碱等体积混合后溶液酸、碱性的判断
——
pH的有关计算
4.已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示:
(1)95 ℃时,0.01 mol·L-1的NaOH溶液中pH等于________。
(2)95 ℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸溶液的pH1与强碱溶液的pH2之间应满足的关系是__________________。
(3)95 ℃时,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如下表所示。
实验序号
Ba(OH)2溶液的体积/mL
盐酸的体积/mL
溶液的pH
①
22.00
0.00
8
②
22.00
18.00
7
③
22.00
22.00
6
假设溶液混合前后的体积不变,则a=________,实验②所得溶液中由水电离产生的c(OH-)=________mol·L-1。
[解析] 根据图像可知95 ℃时,KW=1×10-12 。
(1)c(H+)= mol·L-1,pH=10。
(2)要注意95 ℃时,水的离子积为1×10-12,即c(H+)·c(OH-)=1×10-12
,则等体积强酸、强碱反应至中性时,有pH(酸)+pH(碱)=12。 根据95 ℃时混合后溶液呈中性,pH2=b的某强碱溶液中c(OH-)=10b-12 mol·L-1;根据溶液呈中性可得100V×10-a mol·L-1=V×10b-12 mol·L-1,可得10-a+2=10b-12,即a+b=14或pH1+pH2=14。(3)此条件下,pH=6时溶液呈中性,根据表中实验①数据可得Ba(OH)2溶液中c(OH-)=1.0×10-4 mol·L-1,根据表中实验③的数据可以判断,盐酸中的c(H+)与Ba(OH)2溶液中c(OH-)相等,所以a=4,即pH=4;实验②溶液呈碱性,其c(OH-)= mol·L-1=1.0×10-5 mol·L-1,则由水电离出的c(OH-)=1.0×10-7 mol·L-1。
[答案] (1)10 (2)a+b=14或pH1+pH2=14 (3)4 1.0×10-7
溶液稀释的有关图像分析
5.(2019·德州一模)298 K时,将0.1 mol·L-1的两种钠盐NaX、NaY溶液加水稀释,溶液的pH与稀释倍数的对数lg 的关系如图所示。下列说法不正确的是( )
A.酸性:HY>HX
B.298 K时,=
C.lg =2时,c(HX)+c(X-)=c(HY)+c(Y-)
D.相同浓度时,NaX和NaY两溶液中离子总浓度相等
D [NaX水解程度较大,HX酸性较弱,A对;K(HX)=10-7,K(HY)=10-5,B对;根据物料守恒可知C对;根据电荷守恒:c(Na+)+c(H+)=c(X-)+c(OH-),c(Na+)+c(H+)=c(Y-)+c(OH-),又因为两溶液中c(Na+)相同,c(H+)不同,故总离子浓度不相等,D错。]
6.将体积均为V0的三种溶液分别加水稀释至体积为V时,pH与
的关系如图所示,下列说法正确的是( )
A.酸性:HX>HY
B.用HX溶液滴定NaOH溶液时指示剂用甲基橙比用酚酞误差小
C.对于HX和NaX的混合溶液,=10-1时,c(HX)c(OH-)
B.随温度升高,CH3COONa溶液的c(OH-)减小
C.随温度升高,CuSO4溶液的pH变化是KW改变与水解平衡移动共同作用的结果
D.随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO-、Cu2+水解平衡移动方向不同
C [水的电离与盐的水解都是吸热过程,加热都促进了平衡的右移,KW与Kh都增大。]
3.在T ℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示。下列说法不正确的是 ( )
A.T ℃时,在Y点和Z点,Ag2CrO4的Ksp相等
B.在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C.T ℃时,Ag2CrO4的Ksp为1×10-8
D.图中a=×10-4
C [Ksp=c2(Ag+)·c(CrO)=(1×10-3)2×1×10-5=1×10-11,C错误。]
4.(2019·贵阳模拟)已知:T ℃时,Ksp(PbS)=1.3×10-24,Ksp(ZnS)=1.0×10-22;当溶液中离子浓度≤10-5 mol·L-1时,表明该离子已除尽。T ℃时,下列有关ZnS和PbS的说法不正确的是( )
A.ZnS的饱和溶液中,c(Zn2+)=c(S2-)=1.0×10-11 mol·L-1
B.欲将某工业废水中的Pb2+除去,则加入Na2S溶液后应保证溶液中c(S2-)≥1.3×10-19 mol·L-1
C.向同浓度的ZnCl2和PbCl2的混合溶液中滴加Na2S溶液,PbS先析出
D.向PbS悬浊液中加入ZnCl2浓溶液,PbS不可能转化为ZnS
D [PbS悬浊液中c(S2-)=,向该悬浊液中加入ZnCl2浓溶液,当c(Zn2+)≥时,PbS沉淀转化为ZnS沉淀,D项错误。]
Ka、Kb、Kh的计算及应用
5.已知H2A的Ka1=1×10-4,Ka2=1×10-9,则常温下,下列说法不正确的是( )
A.当溶液中c(HA-)=c(A2-)时,pH=9
B.浓度均为0.1 mol·L-1的H2A与NaOH溶液等体积混合,溶液呈碱性
C.0.01 mol·L-1的Na2A溶液的pH约为10.5
D.pH=10的溶液中=10
B [根据电离常数可求A2-的水解常数Kh1=1×10-5,Kh2=1×10-10。H2A与NaOH溶液混合恰好生成NaHA,HA-的电离程度(Ka2=1×10-9)大于HA-的水解程度(Kh2=1×10-10),溶液呈酸性,B错误。]
6.25 ℃时,将0.1 mol NaOH固体加入1.0 L x mol·L-1 CH3COOH溶液中(忽略溶液体积、温度变化),充分反应后向混合液中加入CH3COOH或CH3COONa固体,溶液pH的变化如图。下列叙述正确的是( )
A.c点对应的溶液中c(Na+)>c(CH3COO-)
B.从b点对应溶液到a点对应溶液的过程中减小
C.a、b、c点对应的溶液中,水的电离程度:a>b>c
D.a、b、c点对应的溶液中,Ka(CH3COOH)均为×10-7
B [c点对应的溶液呈中性,c(H+)=c(OH-),根据电荷守恒知c(Na+)=c(CH3COO-),A错误;加入CH3COOH过程中,c(CH3COO-)和c(H+)增大,c(OH-)减小,c(Na+)不变,减小,B正确;CH3COO-增多,水解程度增大,水的电离程度增大,则a、b、c点对应的溶液中,水的电离程度:c>b>a,C错误;温度一定,电离平衡常数一定,c点时有c(Na+)+c(H+)=c(CH3COO-)+c(OH-),又溶液的pH=7,则c(H+)=c(OH-)=10-7 mol·L-1,c(Na+)=c(CH3COO-)=0.2 mol·L-1,Ka(CH3COOH)===×10-7,D错误。]
7.(1)(2019·衡阳一模)25 ℃时,H2S的电离平衡常数Ka1=1.3×10-7、Ka2=7.0×10-15。用NaOH溶液吸收H2S气体得到pH=10的Na2S溶液,在此过程中水的电离程度将________(填“增大”“减小”或“不变”);此时溶液中=________。
(2)(2019·菏泽一模)已知常温下,Ka(HNO2)=5×10-4,则反应HNO2(aq)+OH-(aq)NO(aq)+H2O(l)的平衡常数K=________,相同物质的量浓度的HNO2、NaNO2混合溶液中,各离子的物质的量浓度由大到小的顺序为______________________。
[解析] (1)NaOH为强碱,对水的电离产生抑制,Na2S为强碱弱酸盐,S2-水解促进水的电离,因此用NaOH溶液吸收H2S气体生成Na2S的过程中,水的电离程度增大;c(S2-)/c(HS-)=c(S2-)×c(H+)/[c(HS-)×c(H+)]=7.0×10-15/10-10=7.0×10-5。(2)平衡常数K====5×1010;
由Ka(HNO2)=5×10-4知HNO2为弱酸,NO的水解常数Kh===2×10-11,Ka(HNO2)>Kh,故相同物质的量浓度的HNO2、NaNO2混合溶液中,HNO2的电离大于NO
的水解,所以各离子的物质的量浓度由大到小的顺序为c(NO)>c(Na+)>c(H+)>c(OH-)。
[答案] (1)增大 7.0×10-5 (2)5×1010
(3)c(NO)>c(Na+)>c(H+)>c(OH-)
Ksp的有关计算及应用
8.(1)(2019·聊城模拟)已知:常温下Ksp[Fe(OH)3]=8.0×10-38,Ksp[Al(OH)3]=1.3×10-33,当Fe3+完全沉淀时,溶液中Al3+理论最大浓度为________。
(2)(2019·四川名校联考)除了OH-之外,S2-也是一种常见的金属离子沉淀剂。本质原因是一些金属硫化物的溶解度极小。已知:25 ℃时,CuS的溶度积为4×10-36,H2S的Ka1=1.25×10-7,Ka2=8.0×10-14。若要在1 L的盐酸中完全溶解0.01 mol CuS,理论上需要盐酸的最低浓度为________mol·L-1(提示:用离子方程式计算)。
(3)(2019·长沙名校模拟)CuCl加入饱和NaCl溶液中会部分溶解生成CuCl,在一定温度下建立两个平衡:
Ⅰ.CuCl(s)Cu+(aq)+Cl-(aq) Ksp=1.4×10-6
Ⅱ.CuCl(s)+Cl-(aq)CuCl(aq) K=0.35。
请写出c(Cu+)与c(CuCl)的数学关系为_________________。
[解析] (1)当离子浓度≤1.0×10-5 mol·L-1时,认为该离子沉淀完全,即c3(OH-)==8.0×10-33 mol3·L-3,c(Al3+)= mol·L-1=0.162 5 mol·L-1。
(2)设盐酸的最小浓度为x mol·L-1。
CuS+ 2H+Cu2++H2S
起始/(mol·L-1) x 0 0
变化/(mol·L-1) 0.01 0.02 0.01 0.01
平衡/(mol·L-1) x-0.02 0.01 0.01
K===
==
4×10-16=,解得x≈5×105 mol·L-1。
(3)根据Ⅰ、Ⅱ可得2CuCl(s)Cu+(aq)+CuCl(aq) K′=1.4×10-6×0.35,故c(Cu+)·c(CuCl)=1.4×10-6×0.35=4.9×10-7。
[答案] (1)0.162 5 mol·L-1 (2)5×105 mol·L-1
(3)c(Cu+)·c(CuCl)=4.9×10-7
9.(2019·衡水模拟)25 ℃时,若滤液中要求c(Al3+)≤1.3×10-6 mol·L-1、c(Mg2+)=0.018 mol·L-1、c(Zn2+)=0.12 mol·L-1,则过滤前沉淀时需调节溶液的pH范围为________{已知:Ksp[Al(OH)3]=1.3×10-33,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Zn(OH)2]=1.2×10-17}。
[答案] 5≤pH<6
Ksp与Qc的关系应用
(1)当Qc>Ksp时,溶液过饱和,有沉淀析出,直至溶液饱和,达到新的平衡。
(2)当Qc=Ksp时,溶液饱和,沉淀与溶解处于平衡状态。
(3)当Qcc(M+)>c(H+)>c(MOH)>c(OH)
(2)Na2A(强碱弱酸盐)溶液
①电荷守恒:c(Na+)+c(H+)=2c(A2-)+c(HA-)+c(OH-)
②物料守恒:c(Na+)=2[c(H2A)+c(HA-)+c(A2-)]
③粒子浓度:c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H2A)>c(H+)
(3)NaHA(a:水解为主,b:电离为主)
①电荷守恒:c(Na+)+c(H+)=2c(A2-)+c(HA-)+c(OH-)
②物料守恒:c(Na+)=c(H2A)+c(HA-)+c(A2-)
③粒子浓度:
(4)HA(弱酸)与NaA混合液(同浓度同体积)(a:pH<7,b:pH>7)
①电荷守恒:c(Na+)+c(H+)=c(A-)+c(OH-)
②物料守恒:2c(Na+)=c(HA)+c(A-)
③粒子浓度:
(5)MOH(弱碱)与MCl混合液(同浓度、同体积)
(a:pH>7,b:pH<7)
①电荷守恒:c(M+)+c(H+)=c(Cl-)+c(OH-)
②物料守恒:2c(Cl-)=c(MOH)+c(M+)
③粒子浓度:
同一溶液中粒子浓度比较
1.(2019·成都高三适应性考试)常温下,向1 L pH=10的NaOH溶液中持续通入CO2。通入CO2的体积(V)与溶液中水电离出的OH-浓度[c(OH-
)]的关系如图所示。下列叙述不正确的是( )
A.a点溶液中,由水电离出的c(H+)=1×10-10 mol·L-1
B.b点溶液中,c(H+)c(SO)>c(NH)>c(OH-)=c(H+)
C [根据电荷守恒,可知C项中的混合液中存在:2c(S2-)+c(Cl-)+c(HS-)+c(OH-)=c(Na+)+c(H+),C错误。]
3.(2019·衡水信息卷)工业用Na2SO3溶液吸收SO2,减少空气污染。常温下,测得Na2SO3溶液吸收SO2过程中,pH随c(SO)∶c(HSO)的变化关系如下表所示,下列说法正确的是( )
c(SO)∶c(HSO)
91∶9
1∶1
9∶91
pH
8.2
7.2
6.2
A.Ka1(H2SO3)<1×10-7.2
B.NaHSO3溶液的pH<7,c(Na+)=c(HSO)+c(SO)
C.吸收液的pH=7时,c(Na+)>c(HSO)>c(SO)>c(H+)=c(OH-)
D.Na2SO3溶液中,SO的水解常数Kh1=9.1×10-5.2
C [Ka2===1×10-7.2,Ka1>Ka2,Ka1>1×10-7.2,A项错误;NaHSO3溶液的pH<7,根据物料守恒可知,c(Na+)=c(HSO)+c(H2SO3),B项错误;吸收液的pH=7时,结合表中数据可知,c(HSO)>c(SO),C项正确;SO的水解常数Kh1====1×10-6.8,D项错误。]
4.常温下,Ka(CH3COOH)=1.8×10-5,分别向20 mL 0.1 mol·L-1 NaHCO3溶液和CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,滴定曲线如图所示,下列叙述正确的是( )
A.a点溶液中存在:c(Na+)+c(H+)=c(HCO)+c(CO)+c(OH-)
B.b、d点溶液中离子浓度的大小关系均为c(Na+)<c(CH3COO-)
C.c点溶液中存在:c(H+)+c(HCO)+c(H2CO3)=c(OH-)
D.d点溶液中存在:n(CH3COO-)/n(CH3COOH)=180
D [NaHCO3溶液显碱性,CH3COOH溶液显酸性,因此上边的曲线表示NaHCO3与NaOH的反应,下边的曲线表示CH3COOH与NaOH的反应。a点溶液中的溶质为等物质的量的Na2CO3和NaHCO3,根据电荷守恒,存在:c(Na+)+c(H+)=c(HCO)+2c(CO)+c(OH-),A项错误;b点溶液显酸性,根据电荷守恒,c(Na+)<c(CH3COO-),d点溶液pH=7,根据电荷守恒,c(Na+)=c(CH3COO-),B项错误;c点溶液中的溶质为Na2CO3,根据质子守恒,存在:c(H+)+c(HCO)+2c(H2CO3)=c(OH-),C项错误;d点溶液的pH=7,Ka(CH3COOH)=1.8×10-5,则=180,D项正确。]
不同溶液中相同粒子浓度的比较
5.0.01 mol·L-1的下列溶液中:
(1)①NH4Cl ②NH4HSO4 ③NH4Fe(SO4)2
④NH3·H2O溶液中c(NH)从大到小的顺序为__________________(用序号,下同)。
(2)①Na2CO3 ②(NH4)2CO3 ③NaHCO3 ④NH4HCO3溶液中c(CO)从大到小的顺序为__________________,c(HCO)从大到小的顺序为__________________。
[答案] (1)②>③>①>④ (2)①>②>③>④
③>④>②>①
溶液中粒子浓度的比较模型
中和滴定及迁移应用
(对应学生用书第56页)
1.滴定管的选择
2.指示剂选择
(1)酸碱中和滴定
(2)其他滴定
3.误差分析
c测=V标
4.[示例]
以向10 mL 0.1 mol·L-1的HA溶液中滴加0.1 mol·L-1的NaOH溶液为例,突破中和滴定曲线的“五点”
a点:Ka=10-5。
b点:离子浓度大小:c(A-)>c(Na+)>c(H+)>c(OH-)。
c点:离子浓度大小:c(A-)=c(Na+)>c(H+)=c(OH-)。
d点:离子浓度大小:c(Na+)>c(A-)>c(OH-)>c(H+)。
e点:离子浓度大小:c(Na+)>c(A-)>c(OH-)>c(H+)。
滴定现象、计算及误差分析
1.(2019·四川名校联考)为测定产品MgBr2的纯度,可用EDTA(简写为Y4-)标准溶液滴定,以铬黑T(简写为In)为指示剂。已知Mg2+与铬黑T和EDTA均能形成配合物,且EDTA与Mg2+配合更稳定:
物质
颜色
物质
颜色
Y4-
无色
MgY2-
无色
In
纯蓝色
MgIn-
酒红色
反应的离子方程式为Mg2++Y4-===MgY2-
(1)滴定终点的现象为__________________________。
滴定终点读数时仰视,结果偏________(填“大”或“小”)。
(2)测定前,先称取0.250 0 g无水MgBr2产品,溶解后,加入2滴铬黑T试液作指示剂,用0.050 0 mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液25.00 mL,则测得无水MgBr2产品的纯度是______________________(用质量分数表示)。
[解析] (2)MgBr2 ~ EDTA
n(MgBr2)=0.050 0×25.00×10-3 mol=1.25×10-3 mol,
产品的纯度=×100%=92.0%。
[答案]
(1)滴入最后一滴EDTA标准液时,溶液由酒红色变为纯蓝色,且半分钟内保持不变 大 (2)92.0%
2.(2019·济宁一模)用佛尔哈德法测定POCl3含量(已知POCl3极易水解):准确称取20.20 g POCl3产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解;将水解液配成100.00 mL溶液,取10.00 mL溶液于锥形瓶中;加入10.00 mL 3.200 mol·L-1 AgNO3标准溶液,并加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖;加入指示剂,用0.200 0 mol·L-1 KSCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00 mL KSCN溶液。
[已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12]
(1)POCl3水解的化学反应方程式为_______________________。
(2)滴定选用的指示剂是________(选填字母),滴定终点的现象为_____________________________________________________。
a.FeCl2 b.NH4Fe(SO4)2
c.淀粉 d.甲基橙
(3)用硝基苯覆盖沉淀的目的是_________________________
_____________________________________________________。
(4)产品中POCl3的百分含量为________。
[解析] (4)n(AgNO3)过量=0.200 0×10.00×10-3 mol=2×10-3 mol,
n(POCl3)=×(10.00×10-3×3.200 mol-2×10-3 mol)=0.01 mol,
w(POCl3)=×100%=75.99%。
[答案] (1)POCl3+3H2O===H3PO4+3HCl
(2)b 当滴入最后一滴KSCN溶液时,溶液变为红色,且半分钟内不褪色
(3)防止生成的AgCl在滴加KSCN时转化为AgSCN沉淀
(4)75.99%(或76%或76.0%)
(1)终点现象答题模板
当滴入最一滴×××溶液时―→溶液由××色变为××色(或溶液变为××色)―→且半分钟内不变色。
(2)滴定测定的三种类型
(3)滴定计算的两种类型
常规滴定曲线的分析
3.(2019·试题调研)用0.1 mol·L-1 NaOH溶液滴定40 mL 0.1 mol·L-1 H2SO3溶液,所得滴定曲线如图所示(忽略混合时溶液体积的变化)。下列叙述不正确的是( )
A.H2SO3的Ka1=1×10-2,Ka2=1×10-7.19
B.HSO的电离程度大于HSO的水解程度
C.Y点的溶液中,3c(SO)=c(Na+)+c(H+)-c(OH-)
D.X点的溶液中c(H+)H2O=1×10-4.25 mol·L-1
D [X点溶液中pH<7,HSO的电离为主,c(H+)H2O=c(OH-)=10-9.75 mol·L-1,D错误。]
4.(2019·南昌一模)25 ℃时,向体积均为20 mL、浓度均为0.1 mol·L-1的两种酸HX、HY溶液中分别滴加0.1 mol·L-1的NaOH溶液,所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是( )
A.HX、HY均为弱酸
B.Ka(HY)的数量级约为10-6
C.b点时:2c(Na+)=c(Y-)+c(HY)
D.V(NaOH)=20 mL时,反应后的两种溶液中c(X-)=c(Y-)
C
[由图可知,HX的pH等于1,HY的pH等于4,则HX为强酸,故A错误;浓度为0.1 mol·L-1的HY,由图可知,HY的pH等于4,则Ka(HY)=c(H+)·c(Y-)/c(HY)=(10-4×10-4)/0.1=10-7,故B错误;V(NaOH)=20 mL时,两种溶液恰好反应分别生成起始等量的NaX和NaY,Y-发生水解,所以溶液中c(X-)>c(Y-),故D错误。]
5.某温度下,分别向10 mL浓度均为0.1 mol·L-1的CuCl2和ZnCl2溶液中滴加0.1 mol·L-1的Na2S溶液,滴加过程中溶液中-lg c(Cu2+)和-lg c(Zn2+)与Na2S溶液体积(V)的关系如图所示。[已知:Ksp(ZnS)>Ksp(CuS),lg 3≈0.5],下列说法错误的是( )
A.溶液pH:aKsp(CuS),故终点时-lg(Zn2+)<-lg(Cu2+),故a—b—e表示ZnCl2的滴定曲线,C错误。对于D项,10 mL浓度均为0.1 mol·L-1的CuCl2和ZnCl2溶液中分别滴加10 mL 0.1 mol·L-1 Na2S溶液,达到滴定终点时,-lg c(Cu2+)=17.7,Ksp(CuS)=10-35.4,d点时,c(S2-)约为×0.1 mol·L-1,c(Cu2+)= mol·L-1=10-33.9 mol·L-1,故d点纵坐标约为33.9,D项正确。]
回归高考,真题验收
6.(2019·全国卷Ⅱ,节选)成品中S2-的含量可以用“碘量法”测得。称取m g样品,置于碘量瓶中,移取25.00 mL 0.100 0 mol·L-1的I2KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5 min,有单质硫析出。以淀粉为指示剂,过量的I2用0.100 0 mol·L-1 Na2S2O3溶液滴定,反应式为I2+2S2O===2I-+S
4O。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为____________________,
样品中S2-的含量为________________(写出表达式)。
[解析] 淀粉溶液遇到I2溶液变蓝,当Na2S2O3将I2消耗完后,溶液由浅蓝色变至无色,即滴定终点时,溶液会由浅蓝色变至无色。设Na2S2O3消耗的I2的物质的量为n1。
由化学方程式可得:
I2 + 2S2O === 2I-+S4O
1 mol 2 mol
n1 0.100 0 mol·L-1×V×10-3 L
则n1=V×0.100 0×10-3 mol
设样品中S2-的含量为w,则由反应I2+S2-===2I-+S↓可得:
I2 ~ S2-
1 mol 32 g
25.00×10-3 L×0.100 0 mol·L-1
-V×0.100 0×10-3 mol m g×w
由此可得:w=×100%。
[答案] 浅蓝色至无色 ×100%
7.(2017·全国卷Ⅱ)水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化,MnO(OH)2被I-还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的
I2(2S2O+I2===2I-+S4O)。
回答下列问题:
(1)取水样时应尽量避免扰动水体表面,这样操作的主要目的是______________________________________________________
_____________________________________________________。
(2)“氧的固定”中发生反应的化学方程式为_______________
_____________________________________________________。
(3)Na2S2O3溶液不稳定,使用前需标定。配制该溶液时需要的玻璃仪器有烧杯、玻璃棒、试剂瓶和________;蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除________及二氧化碳。
(4)取100.00 mL水样经固氧、酸化后,用a mol·L-1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为____________________
______________________________________________________;若消耗Na2S2O3溶液的体积为b mL,则水样中溶解氧的含量为________mg·L-1。
(5)上述滴定完成时,若滴定管尖嘴处留有气泡会导致测定结果偏________(填“高”或“低”)。
[解析] (1)本实验为测定水样中的溶解氧,如果扰动水体表面,会增大水体与空气的接触面积,增大氧气在水中的溶解量。避免扰动水体表面是为了使测定值与水体中的实际值保持一致,避免产生误差。
(3)因Na2S2O3溶液不稳定,使用前还需标定,故用量筒粗略配制Na2S2O3溶液即可。
(4)由于混合液中含有碘单质,加入淀粉时,溶液为蓝色;滴定时,Na2S2O3与碘反应,当碘恰好完全反应时,溶液蓝色刚好褪去,且半分钟内颜色不变色。由各反应关系可建立如下关系式:O2~2MnO(OH)2~2I2~4S2O,由题意知,滴定消耗Na2S2O3的物质的量为ab×10-3 mol,因此0.1 L水样中溶解氧的物质的量=×10-3 mol,质量为×10-3 mol×32 g·mol-1=8ab×10-3 g=8ab mg,即溶解氧的含量为80ab mg·L-1。
[答案] (1)使测定值与水体中的实际值保持一致,避免产生误差
(2)O2+2Mn(OH)2===2MnO(OH)2
(3)量筒 氧气
(4)当滴入最后一滴标准液时,溶液由蓝色变为无色,且半分钟内无变化 80ab
(5)低
8.(2016·全国卷Ⅰ)298 K时,在20.0 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是( )
A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0 mL
C.M点处的溶液中c(NH)=c(Cl-)=c(H+)=c(OH-)
D.N点处的溶液中pH<12
D [A项用0.10 mol·L-1盐酸滴定20.0 mL 0.10 mol·L-1氨水,二者恰好完全反应时生成强酸弱碱盐NH4Cl,应选用甲基橙作指示剂。B项当V(HCl)=20.0 mL时,二者恰好完全反应生成NH4Cl,此时溶液呈酸性,而图中M点溶液的pH=7,故M点对应盐酸的体积小于20.0 mL。C项M点溶液呈中性,则有c(H+)=c(OH-);据电荷守恒可得c(H+)+c(NH)=c(OH-)+c(Cl-),则有c(NH)=c(Cl-),此时溶液中离子浓度关系为c(NH)=c(Cl-)>c(H+)=c(OH-)。D项NH3·H2O为弱电解质,部分发生电离,N点时V(HCl)=0,此时氨水的电离度为1.32%,则有c(OH-)=0.10 mol·L-1×1.32%=1.32×10-3mol·L-1,c(H+)==mol·L-1≈7.58×10-12mol·L-1,故N点处的溶液中pH<12。]
分类突破水溶液中陌生图像的分析
类型1 酸、碱、盐溶液反应过程中陌生图像
(对应学生用书第58页)
1.两坐标为对数的直线型示例分析
(1)常考有关对数示例
①pC:类比pH,即为C离子浓度的负对数,规律是pC越大,C离子浓度越小。
②pK:平衡常数的负对数,规律是pK越大,平衡常数越小,对于一元弱酸(HX):pKa=pH-lg ,lg 越大,HX的电离程度越大。
③AG=lg ,氢离子浓度与氢氧根离子浓度比的对数;规律是AG越大,酸性越强,中性时AG=0。
(2)图像示例
①pOH—pH曲线:
⇒
②常温下,二元弱酸H2Y溶液中滴加NaOH溶液,所得混合溶液的pH与离子浓度变化的关系如图所示:
⇒
③常温下将KOH溶液滴加到二元弱酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系图:
⇒
2.粒子的物质的量分数或浓度与pH的关系图像分析
T ℃时,向某浓度的草酸溶液中逐滴加入一定浓度的NaOH溶液,所得溶液中三种微粒H2C2O4、HC2O、C2O的物质的量分数(δ)与pH的关系如图所示:
⇒
1.(2019·潍坊模拟)常温下,将NaOH溶液滴入二元弱酸H2X溶液中,混合溶液中的粒子浓度与溶液pH的变化关系如图所示。下列叙述正确的是( )
A.曲线M表示lg 与pH的变化关系
B.NaHX溶液显碱性
C.当混合溶液呈中性时,c(Na+)>c(X2-)>c(HX-)>c(H+)=c(OH-)
D.Ka2(H2X)的数量级为10-9
C [H2X为二元弱酸,以第一步电离为主,则Ka1(H2X)>Ka2(H2X),酸性条件下,则pH相同时>,由图像可知N为lg的变化曲线,M为lg )的变化曲线,当lg 或lg =0时,说明或=1,浓度相等,结合图像可计算电离常数并判断溶液的酸碱性。]
2.(2019·长沙模拟)常温下,钠盐(Na2XO3)溶液中微粒浓度的变化关系如图所示[pOH=-lg c(OH-)]。下列说法正确的是( )
A.曲线N表示lg 与pOH的变化关系
B.常温下,Ka2(H2XO3)=10-10
C.当pOH=2时,NaHXO3溶液中:=10-8
D.向Na2XO3溶液中滴加稀盐酸至中性时,溶液中:c(Na+)=2c(HXO)+2c(XO)
B [pOH相同,Kh1>Kh2,可知lg 较小,A错;pOH=2时,=·=10-7×10-2=10-9,C错;根据电荷守恒知,c(Na+)=c(HXO)+2c(XO),D错。]
3.(2019·聊城一中月考)室温下,向H2C2O4溶液中滴加NaOH溶液,若pC=-lg c,则所得溶液中pC(H2C2O4)、pC(HC2O)、pC(C2O)与溶液pH的关系如图所示。下列说法正确的是( )
A.M点时,2c(HC2O)+c(C2O)>c(Na+)
B.pH=x时,c(HC2O)c(Na+),故A正确;因为pC=-lg c,所以纵坐标越大,浓度越小,根据图示可知,pH=x时,应该是c(HC2O)>c(H2C2O4)=c(C2O),故B不正确;根据图示pH=1.3的点计算,Ka1(H2C2O4)=×c(H+)=c(H+)=10-1.3,故C不正确;=,K只与温度有关,温度不变就是定值,故D不正确。]
4.(2017·全国卷Ⅱ)改变0.1 mol·L-1二元弱酸H2A溶液的pH,溶液中H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示[已知δ(X)=]。
下列叙述错误的是( )
A.pH=1.2时,c(H2A)=c(HA-)
B.lg[K2(H2A)]=-4.2
C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D.pH=4.2时,c(HA-)=c(A2-)=c(H+)
D [A项,根据题给图像,pH=1.2 时,H2A与HA-的物质的量分数相等,则有c(H2A)=c(HA-),正确;B项,根据题给图像,pH=4.2时,HA-与A2-的物质的量分数相等,K2(H2A)==c(H+)=10-4.2,则lg[K2(H2A)]=-4.2,正确;C项,根据题给图像,pH=2.7时,H2A与A2-的物质的量分数相等,且远小于HA-的物质的量分数,则有c(HA-)>c(H2A)=c(A2-),正确;D项,根据题给图像,pH=4.2时,HA-与A2-的物质的量分数相等,c(HA-)=c(A2-),且c(HA-)+c(A2-)约为0.1 mol·L-1,c(H+)=10-4.2 mol·L-1,则c(HA-)=c(A2-)>c(H+),错误。]
5.(2019·黄冈调研)已知金属离子M2+,25 ℃时在水中存在M2+(aq)、M(OH)+(aq)、M(OH)2(s)、M(OH)(aq)、M(OH)(aq)五种形态,该体系中各形态的物质的量分数(α)随pH的变化关系如图,下列叙述错误的是( )
A.P点的pH为12,则M(OH)M(OH)2+OH-的平衡常数为10-2
B.M(OH)2完全沉淀后,增大溶液的pH,沉淀不会立即开始溶解
C.溶液pH达到14之前,沉淀M(OH)2已完全溶解
D.M(NO3)2溶液显酸性,其水解的离子方程式为M2++H2OM(OH)++H+
A [根据M2+M(OH)+M(OH)2M(OH)M(OH),可知曲线1为M2+,曲线2为M(OH)+,曲线3为M(OH)2,曲线4为M(OH),曲线5为M(OH)。P点处M(OH)2和M(OH)的物质的量分数相等,c(OH-)=10-2 mol·L-1,而M(OH)M(OH)2+OH-的平衡常数K=,A项错误。]
类型2 沉淀、溶解平衡图像分析
(对应学生用书第60页)
1.两坐标为离子浓度的曲线型图像
⇒
2.两坐标为对数或负对数的直线型图像
已知:pCu=-lg c(Cu+),pX=-lg c(X-),式中X-表示卤素阴离子。298 K时,Ksp(CuCl)≈1.0×10-7,Ksp(CuBr)≈1.0×10-9,Ksp(CuI)≈1.0×10-12。298 K时,CuCl、CuBr、CuI的饱和溶液中pCu和pX的关系如图所示。
⇒
1.(2019·全国卷Ⅱ)绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
A.图中a和b分别为T1、T2温度下CdS在水中的溶解度
B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动
D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
B [A项,难溶物质的溶解度可以用物质的量浓度(摩尔浓度)表示,即图中
a、b分别表示T1、T2温度下,1 L CdS饱和溶液里含a mol、b mol CdS,正确;B项,Ksp在一定温度下是一个常数,所以Ksp(m)=Ksp(n)=Ksp(p)<Ksp(q),错误;C项,向m点的溶液中加入Na2S固体,Ksp保持不变,S2-浓度增大,则Cd2+浓度减小,溶液组成由m沿mpn线向p方向移动,正确;D项,温度降低时,溶解度减小,q点的饱和溶液的组成由q沿qp线向p方向移动,正确。]
2.某温度下两种难溶性盐的沉淀溶解平衡曲线如图所示,图中X2-表示CO、SO,且MSO4不溶于酸,下列有关说法错误的是( )
A.MSO4的饱和溶液中c(M2+)=1×10-5 mol·L-1
B.MCO3(s)+SO(aq)MSO4(s)+CO(aq)的平衡常数K为10
C.用盐酸和浓碳酸钠溶液有可能将MSO4转化为MCl2
D.向a点含MSO4的分散系中加入M(NO3)2固体后,体系有可能转化为b点的分散系
D [加入的M(NO3)2溶解后会使溶液中c(M2+)增大,尽管平衡向生成沉淀的方向移动,但由勒夏特列原理知,重新达到平衡后c(M2+)仍是增大的,D错误。]
3.(2019·衡水模拟)室温下,分别向浓度均为0.010 mol·L-1的K2CrO4、NaBr溶液中逐滴加入0.010 mol·L-1的AgNO3溶液,所得沉淀溶解平衡曲线如图所示,已知:p(Ag+)=-lg c(Ag+),p(CrO)=-lg c(CrO),p(Br-)=-lg c(Br-)。下列叙述正确的是( )
A.Ksp(Ag2CrO4)的数量级为10-8
B.a点可以表示Ag2CrO4的不饱和溶液
C.升温,AgBr的溶解度增大,Ksp不变
D.向等浓度的CrO、Br-的混合液中滴入AgNO3溶液时,先产生Ag2CrO4沉淀
B [Ksp(Ag2CrO4)=c2(Ag+)·c(CrO)=(10-4)2×(10-4)=10-12,A项错误;a点可以表示Ag2CrO4的不饱和溶液,B项正确;升高温度,AgBr的溶解度增大,Ksp也增大,C项错误;根据图像可知,当CrO、Br-浓度相同时,生成AgBr沉淀所需的c(Ag+)小,先析出AgBr沉淀,D项错误。]
4.(2017·全国卷Ⅲ)在湿法炼锌的电解循环溶液中,较高浓度的Cl-会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是( )
A.Ksp(CuCl)的数量级为10-7
B.除Cl-反应为Cu+Cu2++2Cl-===2CuCl
C.加入Cu越多,Cu+浓度越高,除Cl-效果越好
D.2Cu+===Cu2++Cu平衡常数很大,反应趋于完全
C [由题图可知,当-lg=0时,lg约为-7,即c(Cl-)=1 mol·L-1,c(Cu+)=10-7mol·L-1,则Ksp(CuCl)的数量级为10-7,A项正确;根据题目信息可知B项正确;Cu、Cu2+是按一定物质的量之比反应的,并不是加入Cu越多,Cu+浓度越高,除Cl-效果越好,C项错误;由题图可知,交点处c(Cu+)=c(Cu2+)≈10-6mol·L-1,则2Cu+===Cu2++Cu的平衡常数K=≈106,该平衡常数很大,因而反应趋于完全,D项正确。]
5.某温度时,可用K2S沉淀Cu2+、Mn2+、Zn2+三种离子(M2+),所需S2-最低浓度的对数值lg c(S2-)与lg c(M2+)的关系如图所示。下列说法正确的是( )
A.三种离子对应的硫化物中Ksp(CuS)最小,约为1×10-20
B.向MnS的悬浊液中加入少量水,沉淀溶解平衡向溶解的方向移动,c(S2-)增大
C.可用MnS除去MnCl2溶液中混有的少量杂质ZnCl2
D.向浓度均为1×10-5 mol·L-1的Cu2+、Zn2+、Mn2+混合溶液中逐滴加入1×10-4 mol·L-1的Na2S溶液,Zn2+先沉淀
C [向横坐标作一垂线,与三条斜线相交,此时c(S2-)相同,而c(Cu2+)