- 447.00 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第7课时 化学能与电能(5)——含离子交换膜电池的应用(过热点)
近几年全国卷的高考中,涉及离子交换膜的试题较多,且常考常新。离子交换膜是一种含有离子基团的、对溶液中离子具有选择性透过的高分子膜。根据透过的微粒类型,离子交换膜可以分为多种,在高考试题中,主要出现的是阳离子交换膜(如2018·全国卷ⅠT27、2018·全国卷ⅢT27)、阴离子交换膜(2014·全国卷ⅠT27)和质子交换膜(2018·全国卷ⅠT13、2015·全国卷ⅠT11)三种,其功能是在于选择性通过某些离子和阻断某些离子或隔离某些物质,从而制备、分离或提纯某些物质。
[重难点拨]
1.离子交换膜的类型和作用
2.多室电解池
多室电解池是利用离子交换膜的选择透过性,即允许带某种电荷的离子通过而限制带相反电荷的离子通过,将电解池分为两室、三室、多室等,以达到浓缩、净化、提纯及电化学合成的目的。
(1)两室电解池
①制备原理:工业上利用如图两室电解装置制备烧碱
阳极室中电极反应:2Cl--2e-===Cl2↑,阴极室中的电极反应:2H2O+2e-===H2↑+2OH-,阴极区H+放电,破坏了水的电离平衡,使OH-浓度增大,阳极区Cl-放电,使溶液中的c(Cl-)减小,为保持电荷守恒,阳极室中的Na+通过阳离子交换膜与阴极室中生成的OH-结合,得到浓的NaOH溶液。利用这种方法制备物质,纯度较高,基本没有杂质。
②阳离子交换膜的作用
它只允许Na+通过,而阻止阴离子(Cl-)和气体(Cl2)通过。这样既防止了两极产生的H2和Cl2混合爆炸,又避免了Cl2和阴极产生的NaOH反应生成NaClO而影响烧碱的质量。
(2)三室电解池
利用三室电解装置制备NH4NO3,其工作原理如图所示。
阴极的NO被还原为NH:NO+5e-+6H+===NH+H2O,NH通过阳离子交换膜进入中间室;阳极的NO被氧化为NO:NO-3e-+2H2O===NO+4H+,NO通过阴离子交换膜进入中间室。根据电路中转移电子数相等可得电解总反应:8NO+7H2O3NH4NO3+2HNO3,为使电解产物全部转化为NH4NO3,补充适量NH3可以使电解产生的HNO3转化为NH4NO3。
(3)多室电解池
利用“四室电渗析法”制备H3PO2(次磷酸),其工作原理如图所示。
电解稀硫酸的阳极反应:2H2O-4e-===O2↑+4H+,产生的H+通过阳离子交换膜进入产品室,原料室中的H2PO穿过阴离子交换膜进入产品室,与H+结合生成弱电解质H3PO2;电解NaOH稀溶液的阴极反应:4H2O+4e-===2H2↑+4OH-,原料室中的Na+通过阳离子交换膜进入阴极室。
[考法精析]
应用一 用于物质的分离和提纯
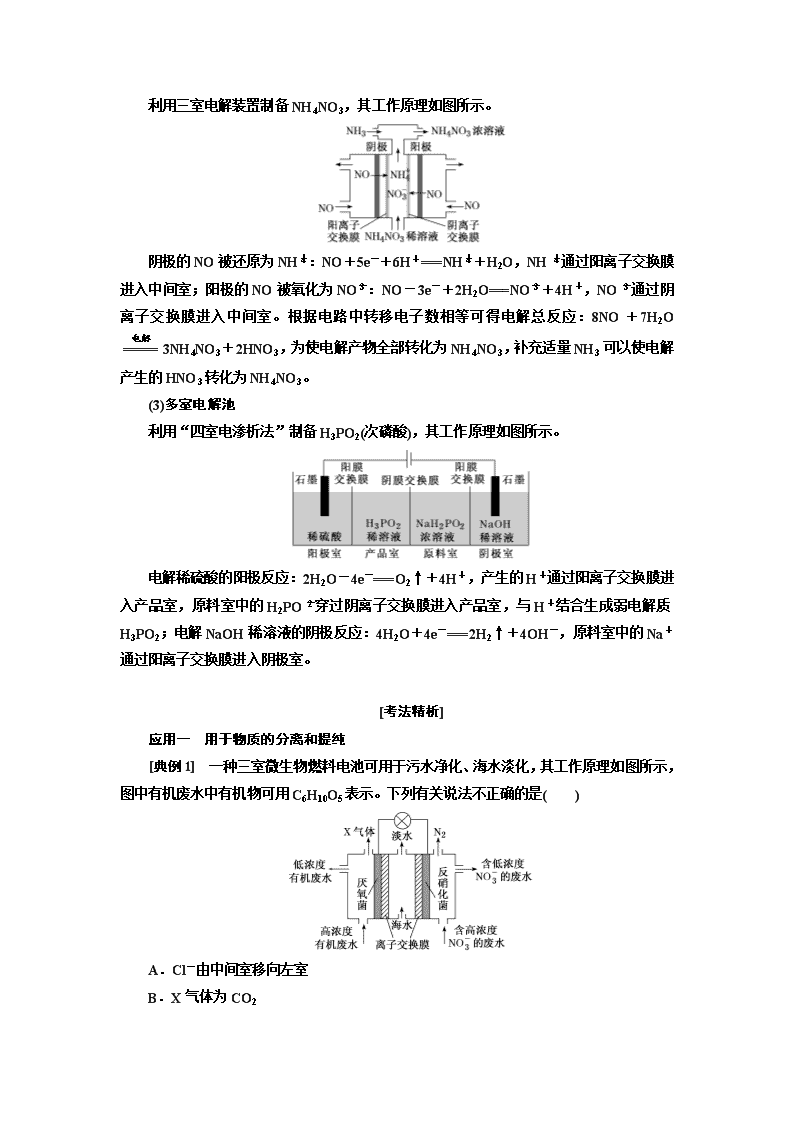
[典例1] 一种三室微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示,图中有机废水中有机物可用C6H10O5表示。下列有关说法不正确的是( )
A.Cl-由中间室移向左室
B.X气体为CO2
C.处理后的含NO废水的pH降低
D.电路中每通过4 mol电子,产生标准状况下X气体的体积为22.4 L
[解析] 该电池中,NO得电子发生还原反应,则装置中右边电极是正极,电极反应为2NO+10e-+12H+===N2↑+6H2O,装置左边电极是负极,负极上有机物失电子发生氧化反应生成X,电极反应C6H10O5-24e-+7H2O===6CO2↑+24H+。放电时,电解质溶液中阴离子Cl-移向负极室(左室),A项正确;X气体为CO2,B项正确;正极反应为2NO+10e-+12H+===N2↑+6H2O,H+参加反应导致溶液酸性减弱,溶液的pH增大,C项错误;根据负极电极反应C6H10O5-24e-+7H2O===6CO2↑+24H+知,电路中每通过4 mol电子,产生标准状况下CO2气体的体积为×6×22.4 L·mol-1=22.4 L,D项正确。
[答案] C
[备考方略] 含离子交换膜电化学装置题的解题步骤
应用二 用于物质的制备
类型(一) 判断离子的迁移方向
[典例2] (1)(2018·全国卷Ⅲ节选)KIO3可采用“电解法”制备,装置如图所示。
①写出电解时阴极的电极反应式________________________________________________________________________。
②电解过程中通过阳离子交换膜的离子主要为________,其迁移方向是________。
(2)(2018·全国卷Ⅰ节选)制备Na2S2O5可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。阳极的电极反应式为____________。电解后,________室的NaHSO3浓度增加。将该室溶液进行结晶脱水,可得到Na2S2O5。
[解析] (1)①该装置为电解池,电解时阴极电解质为KOH,水中氢离子放电,故电极反应式为2H2O+2e-===2OH-+H2↑;②电解过程中通过阳离子交换膜的离子主要为K+,在电解池中离子移动方向为阳离子移向阴极,故K+由a到b。(2)根据题中的图示,左侧为电解池的阳极,右侧为电解池的阴极,离子交换膜均为阳离子交换膜,只允许阳离子通过,阳极的电解质溶液为硫酸,所以阳极的电极反应式为2H2O-4e-===4H++O2↑,则阳极的氢离子会透过阳离子交换膜进入a室,与a室中的SO2碱吸收液中含有的Na2SO3发生反应生成NaHSO3,所以a室中的NaHSO3浓度增加。
[答案] (1)①2H2O+2e-===2OH-+H2↑ ②K+ a到b (2)2H2O-4e-===4H++O2↑ a
[备考方略] 有“膜”条件下离子定向移动方向的判断方法
类型(二) 判断离子交换膜的类型
[典例3] 四室式电渗析法制备盐酸和NaOH的装置如图所示。a、b、c为阴、阳离子交换膜。已知:阴离子交换膜只允许阴离子透过,阳离子交换膜只允许阳离子透过。下列叙述正确的是( )
A.b、c分别依次为阳离子交换膜、阴离子交换膜
B.通电后Ⅲ室中的Cl-透过c迁移至阳极区
C.Ⅰ、Ⅱ、Ⅲ、Ⅳ四室中的溶液的pH均升高
D.电池总反应为4NaCl+6H2O4NaOH+4HCl+2H2↑+O2↑
[解析] 由图中信息可知,左边电极与负极相连为阴极,右边电极为阳极,所以通电后,阴离子向右定向移动,阳离子向左定向移动,阳极上H2O放电生成O2和H+,阴极上H2O放电生成H2和OH-;H+透过c,Cl-透过b,二者在b、c之间的Ⅲ室形成盐酸,盐酸浓度变大,所以b、c分别为阴离子交换膜和阳离子交换膜;Na+透过a,NaOH
的浓度变大,所以a也是阳离子交换膜,故A、B两项均错误;电解一段时间后,Ⅰ中的溶液的c(OH-)升高,pH升高,Ⅱ中为NaCl溶液,pH不变,Ⅲ中有HCl生成,故c(H+)增大,pH减小,Ⅳ中H+移向Ⅲ,H2O放电生成O2,使水的量减小,c(H+)增大,pH减小,C不正确。
[答案] D
[备考方略] 离子交换膜类型的判断方法
根据电解质溶液呈中性的原则,判断膜的类型,判断时首先写出阴、阳两极上的电极反应,依据电极反应式确定该电极附近哪种离子剩余,因该电极附近溶液呈电中性,从而判断出离子移动的方向,进而确定离子交换膜的类型,如电解饱和食盐水时,阴极反应式为2H++2e-===H2↑,则阴极区域破坏水的电离平衡,OH-有剩余,阳极区域的Na+穿过离子交换膜进入阴极室,与OH-结合生成NaOH,故电解食盐水中的离子交换膜是阳离子交换膜。
[综合训练]
1.用一种阴、阳离子双隔膜三室电解槽处理废水中的NH,模拟装置如图所示。下列说法正确的是( )
A.阳极室溶液由无色变成棕黄色
B.阴极的电极反应式为4OH--4e-===2H2O+O2↑
C.电解一段时间后,阴极室溶液的pH升高
D.电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4
解析:选C Fe电极与电源正极相连,则Fe作阳极,电极反应式为Fe-2e-===Fe2+,反应中生成Fe2+,溶液由无色变为浅绿色,A错误;阴极上H+得电子发生还原反应,电极反应式为2H++2e-===H2↑,B错误;电解过程中阴极上消耗H+,则阴极室溶液的pH升高,C正确;电解时,(NH4)2SO4溶液中NH向阴极室迁移,故阴极室溶液中的溶质可能为(NH4)3PO4、(NH4)2HPO4、NH4H2PO4等,D错误。
2.高铁酸盐(如Na2FeO4)已经被广泛应用在水处理方面,以铁质材料为阳极,在高浓度强碱溶液中利用电解的方式可以制备高铁酸盐,装置如图。下列说法不正确的是( )
A.a为阳极,电极反应式为
Fe-6e-+8OH-===FeO+4H2O
B.为防止高铁酸根扩散被还原,则离子交换膜为阳离子交换膜
C.在电解过程中溶液中的阳离子向a极移动
D.铁电极上有少量气体产生原因可能是
4OH--4e-===O2↑+2H2O
解析:选C 铁电极材料为阳极,在高浓度强碱溶液中利用电解的方式可以制备高铁酸盐,所以铁是阳极,电极反应式为Fe-6e-+8OH-===FeO+4H2O,故A正确;阳离子交换膜可以阻止FeO进入阴极区域,故B正确;在电解过程中溶液中的阳离子向阴极移动,所以阳离子向b极移动,故C错误;铁电极上发生氧化反应,所以生成的气体可能是氧气,电极反应式是4OH--4e-===O2↑+2H2O,故D正确。