- 120.94 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
新 课 标 化 学 必 修 一
第一章 从实验学化学 -1- 化学实验基本方法
过滤 一帖、二低、三靠
分离固体和液体的混合体时, 除去液体中不溶性固体。 (漏
斗、滤纸、玻璃棒、烧杯)
蒸发
不断搅拌, 有大量晶体时就
应熄灯, 余热蒸发至干, 可
防过热而迸溅
把稀溶液浓缩或把含固态溶质的溶液干, 在蒸发皿进行蒸
发
蒸馏
①液体体积②加热方式③
温度计水银球位置④冷却
的水流方向⑤防液体暴沸
利用沸点不同除去液体混合物中难挥发或不挥发的杂质
(蒸馏烧瓶、 酒精灯、 温度计、 冷凝管、 接液管、 锥形瓶)
萃取
萃取剂: 原溶液中的溶剂互
不相溶;② 对溶质的溶解
度要远大于原溶剂;③ 要
易于挥发。
利用溶质在互不相溶的溶剂里溶解度的不同, 用一种溶剂
把溶质从它与另一溶剂所组成的溶液里提取出来的操作,
主要仪器:分液漏斗
分液 下层的液体从下端放出, 上
层从上口倒出
把互不相溶的两种液体分开的操作,与萃取配合使用的
过滤器上洗涤沉淀的操
作
向漏斗里注入蒸馏水,使水面没过沉淀物,等水流完后,
重复操作数次
配制一定物质的
量浓度的溶液
需用的仪器 托盘天平(或量筒)、烧杯、玻璃棒、容量瓶、胶头滴管
主要步骤:⑴ 计算 ⑵ 称量(如是液体就用滴定管量取)⑶ 溶解(少量水,搅拌,
注意冷却)⑷ 转液(容量瓶要先检漏,玻璃棒引流)⑸ 洗涤(洗涤液一并转移到
容量瓶中)⑹ 振摇⑺ 定容⑻ 摇匀
容量瓶
①容量瓶上注明温度
和量程。 ②容量瓶上只
有刻线而无刻度。
①只能配制容量瓶中规定容积的溶液; ②不能用容量
瓶溶解、稀释或久贮溶液;③容量瓶不能加热,转入
瓶中的溶液温度 20℃左右
第一章 从实验学化学 -2- 化学计量在实验中的应用
1 物质的量 物质的量实际上表示含有一定数目粒子的集体
2 摩尔 物质的量的单位
3 标准状况
STP
0℃和 1 标准大气压下
4 阿伏加德罗常数 NA 1mol 任何物质含的微粒数目都是 6.02× 1023 个
5 摩尔质量 M 1mol 任何物质质量是在数值上相对质量相等
6 气体摩尔体积 V m 1mol 任何气体的标准状况下的体积都约为 22.4l
7 阿伏加德罗定律 (由
PV=nRT推导出 )
同温同压下同体积的任何气体有同分子数
n 1 N1 V1
n 2 N2 V2
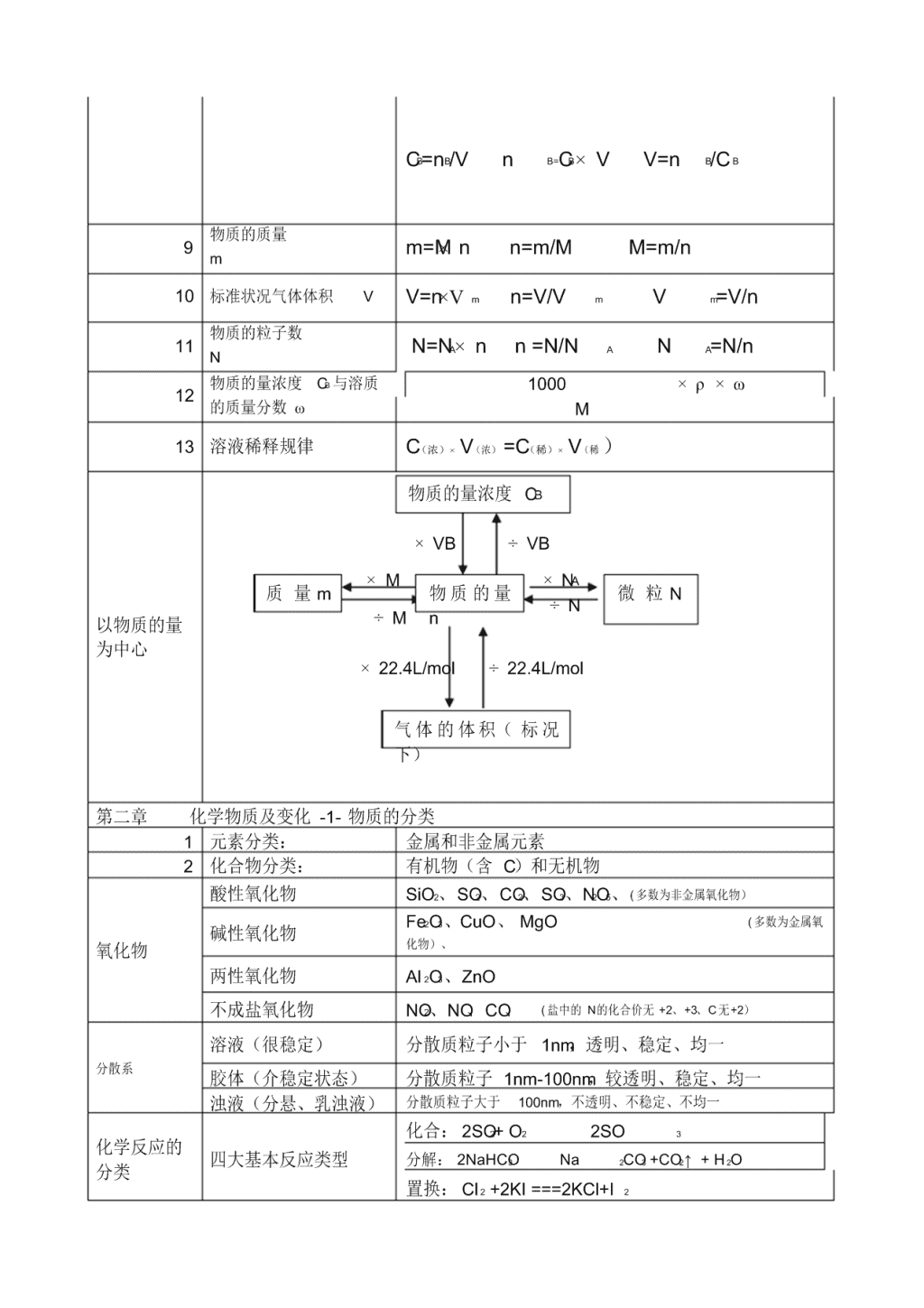
8 物质的量浓度 CB 1L 溶液中所含溶质 B的物质的量所表示的浓度
CB=nB/V n B=CB×V V=n B/C B
9 物质的质量
m m=M×n n=m/M M=m/n
10 标准状况气体体积 V V=n×Vm n=V/V m V m=V/n
11 物质的粒子数
N N=NA×n n =N/N A N A=N/n
12 物质的量浓度 CB 与溶质
的质量分数 ω
1000 ×ρ×ω
M
13 溶液稀释规律 C(浓)× V(浓) =C(稀)× V(稀 )
以物质的量
为中心
第二章 化学物质及变化 -1- 物质的分类
1 元素分类: 金属和非金属元素
2 化合物分类: 有机物(含 C)和无机物
氧化物
酸性氧化物 SiO2、SO2、CO2、SO3、N2O5、 ( 多数为非金属氧化物)
碱性氧化物 Fe2O3、CuO 、 MgO ( 多数为金属氧
化物)、
两性氧化物 Al 2O3、ZnO
不成盐氧化物 NO2、NO、CO、 ( 盐中的 N的化合价无 +2、+3、C无+2)
分散系
溶液(很稳定) 分散质粒子小于 1nm,透明、稳定、均一
胶体(介稳定状态) 分散质粒子 1nm-100nm,较透明、稳定、均一
浊液(分悬、乳浊液) 分散质粒子大于 100nm,不透明、不稳定、不均一
化学反应的
分类 四大基本反应类型
化合: 2SO2+ O2 2SO 3
分解: 2NaHCO3 Na 2CO3 +CO2↑+ H 2O
置换: Cl 2 +2KI ===2KCl+I 2
物质的量浓度 CB
质 量 m 微 粒 N
气 体 的 体 积( 标 况
下)
物 质 的 量
n
×VB ÷VB
×NA
÷N
÷22.4L/mol ×22.4L/mol
÷M
×M
复分解: 2NH4Cl +Ca(OH)2 CaCl 2 +2NH3↑+ 2H2O
是否有离子参加反应 (电解
质在水溶液中)
离子反应: Cl 2+H2O = HCl+HClO
非离子反应: 2Fe+3Cl 2 2FeCl3
是否有元素电子得失或偏
移(有升降价)
氧化还原反应: 2Na+2H2O=2NaOH+H2↑
非氧化还原反应: Al(OH) 3 + NaOH = NaAlO 2 + 2H 2O
热量的放出或吸收
放热反应: 3Fe+2O2 Fe3O 4
吸热反应: C+CO2 2CO
第二章 化学物质及变化 -2- 离子反应
电解质(酸、碱、盐、水) 在水溶液里或熔融状态下本身能够导电的化合物
非电解质(包括 CO2 、SO2) 在水溶液里或熔融状态下不能够导电的化合物
碳酸的电离方程式 H2CO3 H +
+HCO3
-
(弱电解质用“ ”
NaHCO3的电离方程式 NaHCO3=Na++HCO3
- (强电解质用“ = ”
离子反应式 用实际参加反应的离子所表示的式子
离子反应式写法 一写、二改、三删、四查
单质、氧化物、气体、难溶、难电离的物质要保留分子式
离子共存
有颜色的离子 MnO4
-
紫红、 Fe3+
棕黄、 Fe2+
浅绿、 Cu2+
蓝色
与 H+不共存(弱酸根) OH- 、CO3
2-、SO3
2- 、SiO3
2- 、AlO2
- 、S2- 、F- 等
与 OH-
不共存(弱碱金属阳
离子) H+、Fe3+、Fe2+、Fe3+、Cu2+、Al 3+、Mg2+、NH4
+ 等
与 H+和 OH-
都不共存 HCO3
-
、HSO3
-
、HS-
、
等
常见生成沉淀 Ba2+、Ca2+与 SO4
2-、CO3
2- Ag+与 Cl -
胶体
胶体的性质(介稳定) 丁达尔现象、布朗运动、电泳、聚沉
判断胶体最简单的方法 丁达尔现象
胶体提纯 渗析(胶体微粒不能透过半透膜)
Fe(OH)3 胶体制备的方
法
取烧杯盛 20mL蒸馏水,加热至沸腾,然后逐滴加入
饱和 FeCl3 溶液 1mL~2mL。继续煮沸至溶液呈红褐色。
观察所得红褐色液体 Fe(OH)3 胶体。
Fe(OH) 3 胶体制备方程式 FeCl3+3H2O Fe(OH)3( 胶体 ) +3HCl
胶体凝聚的条件 加热、加电解质、加相反电性的胶体
第二章 化学物质及变化 -3- 氧化还原反应
氧化还原反应的本质 有电子转移 ( 得失或偏移 )
氧化还原反应的特征 元素化合价的升降(不一定有氧的得失)
升失氧 还原剂、还原性、失电子、(升价)、 被氧化、发生氧化反应成氧化产物
降得还 氧化剂、氧化性、得电子、 (降价)、 被还原、发生还原反应成还原产物
化合反应 不一定是氧化还原反应,一般有单质参加的化合反应或有单质
生成的分解反应才属氧化还原反应分解反应
置换反应 一定是氧化还原反应
复分解反应 一定不是氧化还原反应
气体的检验
NH3 的检验 用湿润的红色石蕊试纸变蓝
SO2 的检验 用品红溶液褪色
SO2 的吸收 用 KMnO4 溶液 ( 强氧化性 )
CO2 的检验 用澄清石灰水变浊
Cl 2 的检验 用湿润的 KI 淀粉试纸变蓝
NO的检验 打开瓶盖后遇空气变红棕色
离子的检验
NH4
+的检验 加 NaOH溶液加热后放出气体用湿润的红色石蕊试纸变蓝
Fe3+的检验 ①加 NaOH溶液有红褐色沉淀②加 KSCN溶液出现血红色
Fe2+
的检验
①加 NaOH溶液有白色沉淀马上变灰绿色 , 最终变红褐色
②加 KSCN溶液无现象 , 再加氯水后出现血红色
SO4
2- 的检验 先加 HCl 无现象后加 BaCl2 溶液有不溶于酸的白色沉淀
Cl - 、(Br - 、I - ) 的检验 先加 AgNO3 后加 HNO3溶液有不溶于酸的白色沉淀 AgCl
( 淡黄色沉淀 AgBr、黄色沉淀 AgI)
NO3
- 的检验
加浓缩后加入少量浓硫酸和几块铜片加热有红棕色的气
体放出( NO2)
物质的保存
K、Na 保存在煤油中(防水、防 O2)
见光易分解的物质 用棕色瓶( HNO3、AgNO3、氯水、 HClO 等)
碱性物质 用橡胶塞不能用玻璃塞( Na2SiO3、NaOH、 Na2CO3)
酸性、强氧化性物质 用玻璃塞不能用橡胶塞( HSO4、 HNO3、KMnO4)
物质的保存
F2、HF(氢氟酸) 用塑料瓶不能用玻璃瓶(与 SiO2 反应腐蚀玻璃 )
保存在水中 白磷(防在空气中自燃)、 Br 2(防止挥发)
地壳中含量最多的元素 氧 O、硅 Si 、铝 Al 、铁 Fe
地壳有游离态存在的元素 金、铁(陨石)、硫(火山口附近)
金属共同的物理性质 有金属光泽、不透明、易导电、导热、延展性
能与 HCl 和 NaOH都能
反应的物质
两性: Al 、Al 2O3、 Al(OH) 3
弱酸的酸式盐: NaHCO3、NaHSO3、NaHS
弱酸的铵盐:( NH4)2CO3、(NH4) 2S
两性金属 锌 Zn、铝 Al (与酸和碱都放 H2)
钝化金属 铁 Fe、铝 Al (被冷的浓 H2SO4、浓 HNO3)
酸化学性质 稀、浓硫酸的通性
1 强酸性 ---- 反应生成盐
2 高沸点酸,难挥发性——制备易挥发性酸
浓硫酸的特性 1、吸水性—做干燥,不能干燥 NH3、H2S
2、脱水性—使有机物脱水炭化
3、强氧化性——与不活泼金属、非金属、还原性物质反应
硝酸 HNO3 1、强酸性 2 、强氧化性 3 、不稳定性 (见光、受热)
次氯酸 HClO 1、弱酸性 2 、强氧化性 3 、不稳定性 (见光、受热 )
硅酸 H2SiO3 1、弱酸性 2 、难溶性 3 、不稳定性 (热)
漂白
氧化型(永久) 强氧化性: HClO、 Na2O2、O3、浓 H2SO4、浓 HNO3
加合型(暂时) SO2 (使品红褪色,不能使石蕊变红后褪色)
吸附型(物理) 活性碳 明矾溶液生成的 Al(OH) 3 胶体
水溶液
氯水主要成分
分子: Cl 2、 H2O、 HClO
离子: H +、 Cl -、 ClO-
氨水主要成分 分子: NH3 H 2O NH 3·H2O
离子: NH4
+ OH ˉ
氯水与液氯、氨水与液氨的区别 氯水、氨水属混合物、液氯与液氨属纯净物
氯原子 Cl 与氯离子 Cl -
的区别 最外层电子数不同,化学性质不同,氯离子 Cl -
达稳定结构
气体
极易溶于水(喷泉) NH3( 1: 700) HCl (1:500)
只能用排气法收集 NO2 NH 3 HCl
只能用排气法收集 NO N 2 CO
钠与水的反
应
现象 : ①浮、②熔、
③游、④咝、⑤红
①钠浮在水面上——密度小于水;②水蒸气——放
热;③熔化成一个小球——溶点低; ④在水面上游动
——生成气体; 咝咝发出响声——反应剧烈; ⑤变色
——生成碱
俗名 苏打 Na2CO3、小苏打 NaHCO3 水玻璃: Na2SiO3 的水溶液 漂白粉主要成分:
Ca(ClO) 2、CaCl2,有效成分 Ca(ClO) 2
用途
Na2O2( 淡黄色 ) 用作呼吸面具, Al(OH) 3 和 NaHCO3 ( 小苏打)可中和胃酸
明矾用作净水剂,次氯酸 HClO杀菌、消毒、永久性漂白、 SO2暂时性漂白
自来水常用 Cl 2 来消毒、杀菌但产生致癌的有机氯 , 改用广谱高效消毒剂二氧
化氯 (ClO2)
Fe2O3—红色油漆和涂料; Al 2O3—耐火材料 ,NH3 可用于氮肥、制冷剂。
晶体硅 Si 作半导体、太阳能电池 ; SiO 2 可作光导纤维;硅胶是常用的干燥剂及催
化剂的载体。水玻璃可做肥皂填料、木材防腐防火剂及黏胶
第三章 金属及其化合物 -1- 金属的化学性质
1. 学习方法
2. 研究一种
物质的性质
的程序
观察物理性质 预测化学性质 验证或探究预测的性质
分析现象并解释 分类、比较、归纳、概括同类物质的性质
3. 观察法
(1)含义:是一种有计划、有目的地用感官考察研究对象的方法
(2)内容:可以直接用肉眼观察物质的颜色、状态,用鼻子闻物质的气味,
也可以借助一些仪器来进行观察, 提高观察的灵敏度。 人们既在观察过程中,
不仅要用感官去搜集信息,还要积极地进行思考,及时储存和处理所搜集的
信息。观察要有明确而具体的目的,要对观察到的现象进行分析和综合。
4. 金属钠的
物理性质
金属钠是一种银白色的金属;熔点低、密度小、硬度小、展性好。查表或看
书可知金属钠熔点为 97.81 。C,沸点为 882.9 。C;密度为 0.97g ·cm—3
5、金属与水
的反应 2Na +2H2O ====2NaOH + H2
6. 分类法
在研究物质性质时, 运用分类的方法, 分门别类地对物质及其变化进行研究,
可以总结出各类物质的通性和特性;反之,知道某物质的类别,我们就可推
知该物质的一般性质。
7. 比较法 运用比较的方法, 可以找出物质性质间的异同, 认识物质性质间的内在联系,
对物质的性质进行归纳和概括。
8. 实验法
(1)含义: 通过实验来验证对物质性质的预测或探究物质未知的性质的方
法。
(2)注意的问题:在进行实验时,要注意控制温度、压强、溶液的浓度等条
件,这是因为同样的反应物质在不同的条件下可能会发生不同的反应。
(3)实验法的步骤:实验前,要明确实验的目的要求、实验用品和实验步骤
等;实验中,要仔细研究实验现象,并做好实验记录;实验后,要写好实验
报告,并对实验结果进行分析。
9、金属和氧
气的反应 4Na +O2 ==== 2Na 2O 2Na +O2 ==== 2Na 2O2
10、Na2O2 与
H2O反应的
化学原理: 属于自身氧化还原反应; -1 价的氧元素具有强氧化性,所以能使色质褪色。
表现漂白性。
4. 铝箔熔化,失去光泽,但熔化的铝箔并不滴落,好像有一层膜兜着。这是
因为铝表面的氧化膜保护了铝,构成薄膜的氧化铝的熔点( 2050℃)高于铝
的熔点( 660℃),包在铝的外面,所以熔化了的液态铝不会滴落下来。
熔化的铝仍不会滴落,因为铝很活泼,磨去原来的氧化膜后,在空气中又会
很快的生成一层新的氧化膜。这也正是性质活泼的铝在空气中能稳定存在的
原因。
11.钠的保
存
由于钠的化学性质非常活泼,易与空气中的 O2 和 H2O等反应,所以金属钠保
存在煤油之中。 金属钠在空气中变质的过程可以表示为: 银白色的金属钠 表
面变暗(生成 Na2O) 出现白色固体( NaOH) 表面变成粘稠状( NaOH潮解)
白色块状固体( Na2CO3·10H2O) 风化为白色粉未状物质( Na2CO3)
12、铝与氢
氧化钠溶液
的反应
铝和强碱溶液反应,不是铝直接和碱反应,而是铝先和强碱溶液中的水反应
生成氢氧化铝,然后再和强碱反应生成偏铝酸盐:
2Al+6H 2O=2Al(OH)3+3H2↑ Al(OH) 3+NaOH=NaAlO2+2H2O
总反应:
(标电子转移时就必须清楚地理解铝和 NaOH溶液反应的实质)
简写为: 2Al+2H2O+2NaOH=2NaAlO2+3H2↑
第二节 几种重要的金属化合物
1、钠的盐—
碳酸钠、碳
酸氢钠
碳酸钠 (Na2CO3) 碳酸氢钠 (NaHCO3)
分类 正盐 酸式盐
俗称 纯碱、苏打 小苏打
色态 白色粉末 细小的白色晶体
化学性质
与酸反应
Na2CO3+HCl=NaCl+NaHCO3
(CO3
2- +H+=HCO3
- )
NaHCO3+HCl=NaCl+H2O+CO2↑
(HCO3
- +H+=H2O+CO2↑)
开始无外观现象(因为首先生成 HCO3
-
),随后出现气泡。
(若向足量 HCl 中分别滴入 Na2CO3 或 NaHCO3,则均会立刻出现气泡。)
NaHCO3+HCl=NaCl+H2O+CO2↑
(HCO3
- +H+=H2O+CO2↑)
滴入盐酸后,即刻出现气泡。
与碱反应
Na2CO3 不反应 :NaHCO3+ NaOH=H2O+ Na2CO3
与 Ca(OH)2 反应: Na2CO3+ Ca(OH)2= CaCO3↓+ 2NaOH
反应的本质是:
CO3
2- + Ca2+= CaCO3↓ NaHCO3 与少量石灰水的反应为:
2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O
2HCO3
- +Ca2++2OH-=CaCO3↓+CO3
2- +2H2O
若石灰水过量,则新生成的 Na2CO3 可与 Ca(OH)2 继续反应,即:
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
∴过量石灰水中 NaHCO3 与 Ca(OH)2 的反应为:
NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O
HCO3
- +Ca2++OH- =CaCO3↓+H2O
热稳定性
( 运用此性质可除去 Na2CO3 中的 NaHCO3) 很稳定受热不分解
(分解温度 851℃,酒精灯温度达不到) 不很稳定,受热易分解。
2NaHCO3
加热 Na2CO3+H2O+CO2↑
(分解温度 150℃)
二者之间相互转化
注意:将以上知识要灵活应用于识别、除杂及计算中。
二.铝的化
合物
(一)氧化铝( Al 2O3)
1 、物理性质:白色难熔固体、不溶于水。
2 、化学性质: Al 2O3 是典型的两性氧化物,既能与酸反应又能与强碱溶液
反应。
与强酸: Al 2O3+6H+=2Al 3++3H2O
与强碱: Al 2O3+2OH- =2AlO2- +H2O
3 、用途:耐火材料、制取铝的原料
(二)氢氧化铝
[Al(OH) 3]
1 、Al(OH) 3 的物理性质: Al(OH) 3 是不溶于水的白色胶状沉淀,是典型的两
性氢氧化物,能凝聚水中的悬浮物,又有吸附色素的性能。
2 、Al(OH) 3 的两性:
H ++AlO2
-+H2O=Al(OH)3 Al 3++3OH- = Al(OH) 3
酸式电离 碱式电离
当与强酸反应: Al(OH) 3+3H+=Al 3++3H2O
当与强碱溶液作用: Al(OH) 3+OH- =AlO2
- +2H2O
3 、Al(OH) 3 的制取:
(1)铝盐与碱反应:
用铝盐与可溶性弱碱氨水反应制 Al(OH) 3:Al 3++3NH3·H2O= Al(OH) 3↓
+3NH4
+
说明:制取 Al(OH) 3 也可用铝盐与强碱作用,但应严格控制加入碱的量,
因为强碱过量会使制得的 Al(OH) 3转化为偏铝酸盐: Al(OH) 3+OH- =AlO2
- +2H2O。
所以,实验室一般不采用这种方法制 Al(OH) 3
4 、Al(OH) 3 的用途:净水。
Al(OH) 3 胶体中胶粒有吸附水中悬浮杂质的作用,使其质量增大,沉降水
底,达到净化水的目的。
第三节 用途广泛的金属材料
一.铁的化
合物
(一)铁的氧化物
名 称 氧化亚铁 氧化铁 四氧化三铁
俗 称 ————— 铁 红 磁性氧化铁
化学式 FeO Fe 2O3 Fe 3O4
色 态 黑色粉末 红棕色粉末 黑色晶体
化合价 + 2 还原性为主 + 3 只有氧化性 + 2 ,+ 3
水溶性 不 溶 不 溶 不 溶
类 型 碱 性 氧 化 物 ————
共 性 与酸 都能与酸反应 如 Fe 2O3 + 6H+=2Fe3+ + 3H 2O
与还原剂 都能被还原 如 Fe 2O3 + 3CO=2Fe + 3CO2( 高温条件下反应 )
(二)氢氧化物
名称 氢氧化亚铁 氢氧化铁
化学式 Fe(OH)2 Fe(OH) 3
分 类 碱 碱 性
质 色 态 白色固体 红褐色固体
水溶性 不溶于水 不溶于水
与酸反应 Fe(OH) 2+2H+= Fe 2+ + 2H 2O Fe(OH) 3+3H+==Fe3++3H2O
还原性
稳定性 4Fe(OH) 2 + O 2 + 2H2O == 4Fe(OH) 3
2Fe(OH)3 =Fe 2O3+ 3H2O(受热分解)
制法 原 理 Fe 2+ +2OH- = Fe(OH) 2↓ Fe 3+ +3OH- = Fe(OH) 3↓
现 象 白色絮状沉淀 红褐色沉淀
(三)铁盐与亚铁盐
铁盐( Fe3+) 亚铁盐( Fe2+)
颜色 黄色 淡绿色
与碱反应 Fe 3++3OH—==Fe(OH)3↓, Fe 2++2OH—=Fe(OH) 2↓
氧化性、还原性 氧化性
2Fe3++Fe=3Fe2+ 氧化性: Fe2++Zn==Zn2++Fe
还原性: 2Fe2++Cl 2=2Fe3++2Cl—
(四) Fe2+、Fe3+的检验
鉴 别 方 法 Fe 2+ Fe 3+
直 接 观 色: 淡 绿 色 , 黄 色
与 KSCN :不显红色 ,血 红 色
与 OH-
作用 :白色↓→灰绿↓→红褐色↓ 红褐色沉淀
合金: 两种或两种以上的金属(或金属与非金属)熔合在一起而形成的具有金属特
性的物质
合金的特点 硬度一般比成分金属大而熔点比成分金属低,用途比纯金属要广泛。
第四章 非金属及其化合物
第一节 无机非金属材料的主角——硅
1. 硅元素:
无机非金属材料中的主角,在地壳中含量 26.3 %,次于氧。是一种亲氧元
素,以熔点很高的氧化物及硅酸盐形式存在于岩石、沙子和土壤中,占地壳
质量 90%以上。位于第 3 周期,第Ⅳ A 族碳的下方。
2、二氧化硅
(SiO 2)
天然存在的二氧化硅称为硅石,包括结晶形和无定形。石英是常见的结晶形
二氧化硅,其中无色透明的就是水晶,具有彩色环带状或层状的是玛瑙。二
氧化硅晶体为立体网状结构,基本单元是 [SiO4] ,因此有良好的物理和化学
性质被广泛应用。(玛瑙饰物,石英坩埚,光导纤维)
物理:熔点高、硬度大、不溶于水、洁净的 SiO2 无色透光性好
化学:化学稳定性好、除 HF 外一般不与其他酸反应,可以与强碱( NaOH )
反应,是酸性氧化物,在一定的条件下能与碱性氧化物反应
SiO2 +4HF == SiF4 ↑+2H2O
SiO2 +CaO ===( 高温 ) CaSiO3
SiO2 +2NaOH == Na2SiO3 +H2O
不能用玻璃瓶装 HF,装碱性溶液的试剂瓶应用木塞或胶塞。
3、硅酸
(H2SiO 3)
酸性很弱(弱于碳酸)溶解度很小,由于 SiO2 不溶于水,硅酸应用可溶性
硅酸盐和其他酸性比硅酸强的酸反应制得。
Na2SiO3 +2HCl == H2SiO3 ↓+2NaCl
硅胶多孔疏松,可作干燥剂,催化剂的载体。
4、硅酸盐
硅酸盐是由硅、氧、金属元素组成的化合物的总称,分布广,结构复杂化学
性质稳定。一般不溶于水。( Na2SiO3 、K2SiO3 除外)最典型的代表是硅
酸钠 Na2SiO3 :可溶,其水溶液称作水玻璃和泡花碱,可作肥皂填料、木
材防火剂和黏胶剂。 常用硅酸盐产品:玻璃、陶瓷、水泥
5、硅单质
与碳相似,有晶体和无定形两种。晶体硅结构类似于金刚石,有金属光泽的
灰黑色固体,熔点高( 1410 ℃),硬度大,较脆,常温下化学性质不活泼。
是良好的半导体,应用:半导体晶体管及芯片、光电池
第二节 富集在海水中的元素——氯
1、氯元素: 位于第三周期第Ⅶ A 族,原子结构: 容易得到一个电子形成
氯离子 Cl-,为典型的非金属元素,在自然界中以化合态存在。
2. 氯气
物理性质:黄绿色气体,有刺激性气味、可溶于水、加压和降温条件下可变
为液态 (液氯 )和固态。
制法 :MnO2 +4HCl ( 浓 ) MnCl2 +2H2O +Cl2
闻法 :用手在瓶口轻轻扇动 ,使少量氯气进入鼻孔。
化学性质:很活泼,有毒,有氧化性, 能与大多数金属化合生成金属氯化物
(盐)。也能与非金属反应:
2Na +Cl2 ===( 点燃 ) 2NaCl 2Fe +3Cl2===( 点燃 ) 2FeCl3 Cu +Cl2===( 点
燃) CuCl2
Cl2+H2 ===( 点燃 ) 2HCl 现象:发出苍白色火焰,生成大量白雾。
燃烧不一定有氧气参加,物质并不是只有在氧气中才可以燃烧。燃烧的本质
是剧烈的氧化还原反应,所有发光放热的剧烈化学反应都称为燃烧。
Cl2 的用途:
①自来水杀菌消毒 Cl2+H2O == HCl +HClO 2HClO ===( 光照 ) 2HCl +O2 ↑
1 体积的水溶解 2 体积的氯气形成的溶液为氯水,为浅黄绿色。其中次氯酸
HClO 有强氧化性和漂泊性,起主要的消毒漂白作用。次氯酸有弱酸性,不
稳定,光照或加热分解,因此久置氯水会失效。
②制漂白液、漂白粉和漂粉精
制漂白液 Cl2+2NaOH=NaCl +NaClO +H2O ,其有效成分 NaClO 比 HClO
稳定多 ,可长期存放制漂白粉 (有效氯 35%)和漂粉精 (充分反应有效氯 70%)
2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O
③与有机物反应,是重要的化学工业物质。
④用于提纯 Si、Ge、Ti 等半导体和钛
⑤有机化工:合成塑料、橡胶、人造纤维、农药、染料和药品
氯离子的检验
使用硝酸银溶液,并用稀硝酸排除干扰离子( CO32 -、 SO32 -)
HCl+AgNO3 == AgCl ↓+HNO3
NaCl +AgNO3 == AgCl ↓+NaNO3
Na2CO3 +2AgNO3 ==Ag2CO?3 ↓ +2NaNO3
Ag2CO?3 +2HNO3 == 2AgNO3 +CO2 ↑+H2O
Cl-+Ag+ == AgCl ↓
第三节 硫和氮的氧化物
1、二氧化硫
制法(形成):硫黄或含硫的燃料燃烧得到(硫俗称硫磺,是黄色粉末)
S+O2 ===( 点燃 ) SO2
物理性质:无色、刺激性气味、容易液化,易溶于水( 1:40 体积比)
化学性质:有毒,溶于水与水反应生成亚硫酸 H2SO3 ,形成的溶液酸性,有
漂白作用,遇热会变回原来颜色。这是因为 H2SO3 不稳定,会分解回水和
SO2
SO2 +H2O H2SO3 因此这个化合和分解的过程可以同时进行, 为可逆反应。
可逆反应 ——在同一条件下,既可以往正反应方向发生,又可以向逆反应方
向发生的化学反应称作可逆反应,用可逆箭头符号 连接。
2. 一氧化氮
和二氧化氮
一氧化氮在自然界形成条件为高温或放电: N2+O2 ========( 高温或放电 )
2NO ,生成的一氧化氮很不稳定, 在常温下遇氧气即化合生成二氧化氮: 2NO
+O2 == 2NO2
一氧化氮的介绍:无色气体,是空气中的污染物,少量 NO 可以治疗心血管
疾病。
二氧化氮的介绍:红棕色气体、刺激性气味、有毒、易液化、易溶于水,并
与水反应:
3 NO2 +H2O == 2HNO3 +NO 这是工业制硝酸的方法。
3. 大气污染
SO2 、NO2 溶于雨水形成酸雨。防治措施:
① 从燃料燃烧入手。
② 从立法管理入手。
③从能源利用和开发入手。
④从废气回收利用,化害为利入手。
(2SO2 +O2 2SO3 SO3 +H2O= H2SO4)
第四节 氨 硝酸 硫酸
1. 硫酸
物理性质:无色粘稠油状液体,不挥发,沸点高,密度比水大。
化学性质:具有酸的通性,浓硫酸具有脱水性、吸水性和强氧化性。是强氧
化剂。
C12H22O11 ======( 浓 H2SO4) 12C +11H2O 放热
2 H2SO4 ( 浓 )+C CO2 ↑+2H2O +SO2 ↑
还能氧化排在氢后面的金属,但不放出氢气。
2 H2SO4 ( 浓 )+Cu CuSO4 +2H2O +SO2 ↑
稀硫酸:与活泼金属反应放出 H2 ,使酸碱指示剂紫色石蕊变红,与某些盐
反应,与碱性氧化物反应,与碱中和
2. 硝酸
物理性质:无色液体,易挥发,沸点较低,密度比水大。
化学性质:具有一般酸的通性,浓硝酸和稀硝酸都是强氧化剂。还能氧化排
在氢后面的金属,但不放出氢气。
4HNO3( 浓 )+Cu == Cu(NO3)2 +2NO2 ↑+4H2O
8HNO3( 稀 )+3Cu 3Cu(NO3)2 +2NO ↑+4H2O
反应条件不同,硝酸被还原得到的产物不同,可以有以下产
物 :N(+4)O2,HN(+3)O2,N(+2)O,N(+1)2O,N(0)2, N(-3)H3 △硫酸和硝酸: 浓硫
酸和浓硝酸都能钝化某些金属(如铁和铝)使表面生成一层致密的氧化保护
膜,隔绝内层金属与酸,阻止反应进一步发生。因此,铁铝容器可以盛装冷
的浓硫酸和浓硝酸。硝酸和硫酸都是重要的化工原料和实验室必备的重要试
剂。可用于制化肥、农药、炸药、染料、盐类等。硫酸还用于精炼石油、金
属加工前的酸洗及制取各种挥发性酸。
3. 氨气及铵
盐
氨气的性质: 无色气体, 刺激性气味、 密度小于空气、 极易溶于水 (且快) 1:
700 体积比。溶于水发生以下反应使水溶液呈碱性: NH3 +H2O NH3?H2O
NH4 ++ OH- 可作红色喷泉实验。 生成的一水合氨 NH3?H2O 是一种弱碱,
很不稳定,会分解,受热更不稳定: NH3?H2O ===( △) NH3 ↑+H2O
浓氨水易挥发除氨气,有刺激难闻的气味。
氨气能跟酸反应生成铵盐: NH3 +HCl == NH4Cl ( 晶体 )
氨是重要的化工产品,氮肥工业、有机合成工业及制造硝酸、铵盐和纯碱都
离不开它。氨气容易液化为液氨,液氨气化时吸收大量的热,因此还可以用
作制冷剂。
铵盐的性质:易溶于水(很多化肥都是铵盐),受热易分解,放出氨气:
NH4Cl NH3 ↑+HCl ↑
NH4HCO3 NH3 ↑ +H2O ↑+CO2 ↑
可以用于实验室制取氨气:(干燥铵盐与和碱固体混合加热)
NH4NO3 +NaOH Na NO3 +H2O +NH3 ↑
2NH4Cl +Ca(OH)2 CaCl2 +2H2O +2NH3 ↑
用向下排空气法收集,红色石蕊试纸检验是否收集满。