- 170.00 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2018-2019学年广东省江门市第二中学高二10月月考化 学 试 题
时间:50分钟 分值:100分
第Ⅰ卷(选择题,共42分)
一、单择题(本题共7个小题,每小题6分,共42分,每小题只有一个选项符合题意)
可能用到的相对原子质量:H-1 O-16 C-12 Ca-40
1.下列有关能量转换的说法正确的是( )
A.煤燃烧的过程中,化学能全部转化为热能
B.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能
C.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程
D.植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程
2.下列热化学方程式中ΔH代表燃烧热的是( )
A.CH4(g)+3/2O2(g)===2H2O(l)+CO (g) ΔH1
B.S(s)+3/2O2(g)===SO3(g) ΔH2
C.C6H12O6(s)+6O2(g)===6CO2(g)+6H2O(l) ΔH3
D.2CO(g)+O2(g)===2CO2(g) ΔH4
3.根据下图所示的各物质能量变化关系,判断下列热化学方程式正确的是( )
A.C(s,金刚石)+O2(g)=== CO2(g)
ΔH1=a kJ·mol-1(a<0)
B.C(s,石墨)+O2(g)===CO2(g)
ΔH2=b kJ·mol-1(b>0)
C.C+O2===CO2 ΔH3=c kJ·mol-1(c>0)
D.C(s,金刚石)===C(s,石墨)
ΔH4=d kJ·mol-1(d>0)
4.已知25 ℃、101 kPa条件下:
(1)4Al(s)+3O2(g)===2Al2O3(s) ΔH=-2834.9 kJ·mol-1
(2)4Al(s)+2O3 (g)===2Al2O3(s) ΔH=-3119.1 kJ·mol-1
由此得出的正确结论是( )
A.等质量的O2比O3能量低,由O2变O3为吸热反应
B.等质量的O2比O3能量低,由O2变O3为放热反应
C.O3比O2稳定,由O2变O3为吸热反应
D.O2比O3稳定,由O2变O3为放热反应
5.下列关于化学反应限度的说法中正确的是 ( )。
A.改变外界条件不能改变化学反应的限度
B.当某反应在一定条件下达到反应限度时即达到了化学平衡状态
C.当某反应体系中气体的压强不再改变时,该反应一定达到了反应限度
D.当某反应达到限度时,反应物和生成物的浓度一定相等
6.下列方法对2SO2(g)+O2(g) 2SO3(g)的反应速率没有影响的是( )
A.加入SO3 B.容积不变,充入N2气体
C.压强不变,充入N2气体 D.降低温度
7.在密闭容器中,一定量混合气体发生下列反应: aM(g)+ bN(g) cW(g),达到平衡后,测得M气体的浓度为0.5mol/L。当在恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L。则下列叙述正确的是 ( )
A.反应速率增大 B.平衡向右移动
C.N的转化率提高 D.W的体积分数降低
第Ⅱ卷(非选择题,共58分)
二、非选择题(本题包括4道小题,共58分)
8.(15分) 50mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少一种玻璃仪器是__________。
(2)烧杯间填满碎泡沫塑料的作用是_____________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值________(填“偏大”或“偏小”或“无影响”)。
(4)实验中改用60mL 0.50mol·L-1盐酸跟50mL 0.55mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”),简述理由:_____________________________________。
(5) 实验过程中,准确读取反应混合溶液的最高温度的方法是__________________
(6) 某同学每次用50mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1 NaOH溶液进行多次实验,经数据处理后得到反应过程中放出的热量为1.421kJ,则该实验中盐酸与氢氧化钠反应中和热的热化学方程式可表示为_______________________________________
9.(14分)根据下列叙述写出相应的热化学方程式,回答有关问题:
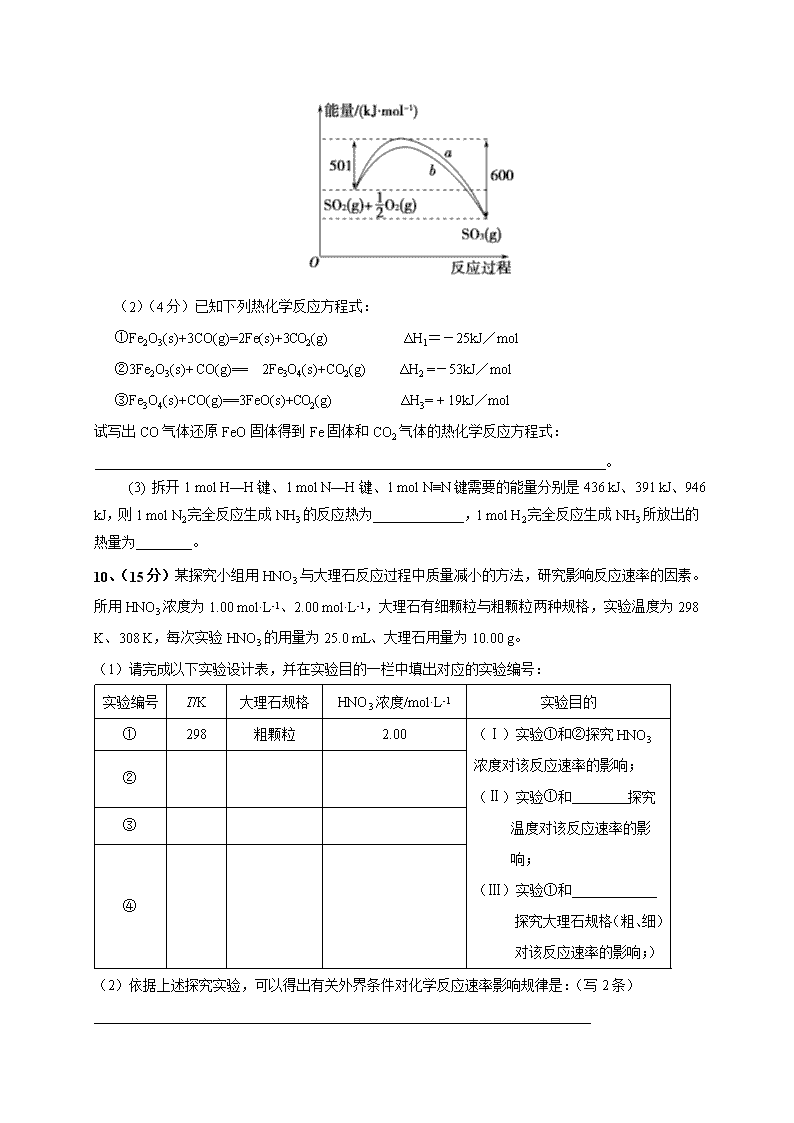
(1) 下图是SO2生成SO3反应过程中能量变化的曲线图。该反应的热化学方程式为:__________________________________________________________。
图中曲线_________(填“a”、“b”)能表示使用催化剂时反应过程的能量变化。
(2)(4分)已知下列热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1=-25kJ/mol
②3Fe2O3(s)+ CO(g)== 2Fe3O4(s)+CO2(g) ΔH2 =-53kJ/mol
③Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) ΔH3= + 19kJ/mol
试写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
。
(3) 拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键需要的能量分别是436 kJ、391 kJ、946 kJ,则1 mol N2完全反应生成NH3的反应热为_____________,1 mol H2完全反应生成NH3所放出的热量为________。
10、(15分)某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL、大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
实验编号
T/K
大理石规格
HNO3浓度/mol·L-1
实验目的
①
298
粗颗粒
2.00
(Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响;
(Ⅱ)实验①和 探究温度对该反应速率的影响;
(Ⅲ)实验①和 探究大理石规格(粗、细)对该反应速率的影响;)
②
③
④
(2)依据上述探究实验,可以得出有关外界条件对化学反应速率影响规律是:(写2条)
_______________________________________________________________________
_______________________________________________________________________
(3)实验①中CO2质量随时间变化的关系见下图:
依据反应方程式
CaCO3+HNO3=Ca(NO3)2+CO2↑+H2O,计算实验①在70-90 s [已知图中70s、90s对应CO2的质量分别是0.84g、0.95g]范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。
(4)请在答题卡的框图中,画出实验②、③和④其中一个实验中,CO2质量随时间变化关系的预期结果示意图,并做出必要标注。
11、(14分)在一定温度下,将5mol SO2、5mol O2充入10L体积不变的密闭容器中发生反应2SO2+O22SO3 △H<0,经10min后反应达平衡,测得SO3的浓度为0.4mol/L。
(1)下列依据不能判断该反应达到化学平衡的是____________;
A、反应速率 v(SO2)=v(SO3) B、单位时间内分解的SO3分子数是消耗O2分子数2倍
C、容器内的总压强保持不变 D、容器内SO2、O2、SO3的体积分数保持不变
E、容器内混合气体的密度保持不变
(2)写出该反应的平衡常数表达式K=______________________。若升高温度,K值_____(填“增大”“减小”“不变”)
(3)反应达平衡时O2的转化率为__________;若其他条件不变,只将容器体积压缩到5L,则再次平衡时O2的转化率将_____(填“增大”“减小”“不变”)
(4)计算此温度下该反应的平衡常数K是多少?(写出计算过程)
高二级10月月考
化学试题参考答案
一单项选择题(7*6分=42)1、B 2、C 3、A 4、A 5、B 6、B 7、D
8、(15分,没说明的,每空2分) (1)环形玻璃搅拌棒 (2)减少实验过程中的热量损失 (3)偏小
(4)不相等(1分) 相等(1分) 因为中和热是指酸跟碱发生中和反应生成1mol H2O所放出的热量,与酸碱的用量无关
(5)实验中每隔相同时间(0.5-1秒)或连续读出温度值,找出最高温度即可。
(6)HCl(aq)+NaOH(aq) ==H2O(l)+NaCl(aq) ΔH=-56.84 kJ·mol-1(3分)
9、(14分,热化学方程式每个4分,其余每空2分)
(1)2SO2(g)+O2(g)2SO3(g) ΔH=-198 kJ·mol-1;b
(2)CO(g) + FeO(s) == Fe(s)+CO2(g) ΔH=-10kJ/mol
(3)-92 kJ·mol-1 30.7 kJ
10、(15分)(1)(6分)
②
298
粗颗粒
1.00
③
308
粗颗粒
2.00
(II)和③
④
298
细颗粒
2.00
(III) 和 ④
(2)其他条件相同,升高温度,反应速率加快;其他条件相同,增大反应物浓度,反应速率加快;其他条件相同,增大固体表面积,反应速率加快;(任意2条,共4分)
(3)(3分)
(4)画对②、③和④中任一条,标注正确即可得2分。
11、(14分)(1)AE (3分,仅答对一个1分)
(2) (2分) ;减小 (2分)
(3)α(O2) =[0.2mol/L]/0.5mol/L×100%=40%(2分);增大(1分)
(4)(4分)反应前c(SO2)=c(O2)=5mol/10L=0.5mol/L
2SO2 + O2 2SO3 …………………1分
起始浓度(mol/L) 0.5 0.5 0
转化浓度(mol/L) 0.4 0.2 0.4
平衡浓度(mol/L) 0.1 0.3 0.4 ……………………2分
…4分 答: