- 913.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
可能用到的相对原子质量:N-14 O-16 Na-23 S-32 Ti-48
第I卷(选择题 共42分)
一、选择题(本题包括14小题,每小题3分,共42分。每小题只有一个选项符合题意)
1、化学与人类生活、社会发展密切相关。下列措施不利于节能减排、保护环境的是
A.研发易降解的生物农药,减少农药的残余量
B.推广使用节能环保材料,减少有害物质对环境的污染
C.开发太阳能水能、风能等新能源,减少使用煤,石油等化石燃料
D.研究采煤、采油新技术,提高产量以满足工业生产的快速发展
2、“水飞”是传统中医里将药材与适量水共研细,取极细药材粉末的方法。《医学入门》中记载了提纯铜绿的方法:“水洗净,细研水飞,去石澄清,慢火熬干。”文中不涉及的操作方法是
A.萃取 B.溶解 C.洗涤 D.蒸发
3、下列化学用语正确的是
A.氯化氢的电子式: B.质子数为30,中子数为35的锌原子:6535Zn
C.乙酸的结构简式:CH3COOH D.四氯化碳的比例模型:
4、某有机物A的结构简式如图所示。下列叙述不正确的是
A.有机物A的分子式为C12H14O5 B.有机物A中含有4种官能团
C.有机物A能够发生酯化反应 D.1 mol A和足量的NaHCO3溶液反应,可以生成1 molCO2
5、由水电离产生的c(H+)为1×10-12 mol/L的溶液中,能大量共存的离子组是
A.K+、Cl-、NH4+、HS- B.K+、Fe3+、I-、 SO42-
C.Na+、Cl-、NO3-、SO42-、 D.Na+、Ca2+、、Cl-、HCO3-
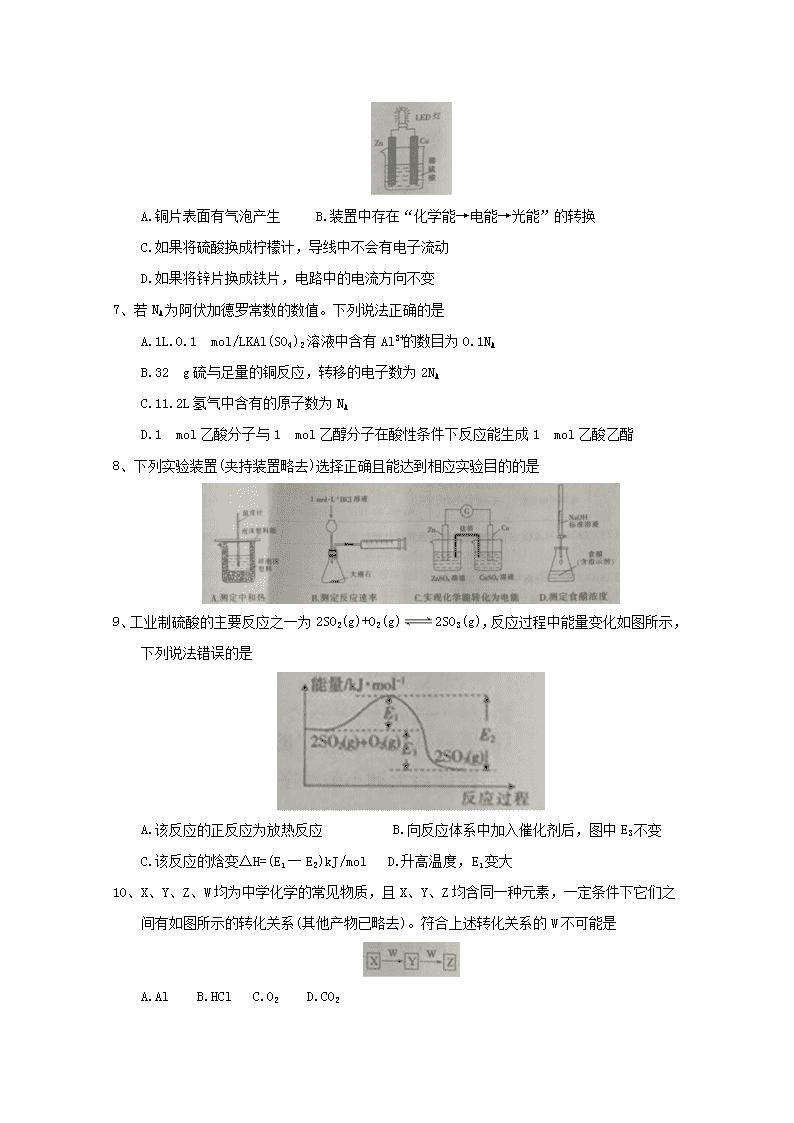
6、某课外活动小组设计用化学电源使LED灯发光的装置如图所示。下列说法错误的是
A.铜片表面有气泡产生 B.装置中存在“化学能→电能→光能”的转换
C.如果将硫酸换成柠檬计,导线中不会有电子流动
D.如果将锌片换成铁片,电路中的电流方向不变
7、若NA为阿伏加德罗常数的数值。下列说法正确的是
A.1L.0.1 mol/LKAl(SO4)2溶液中含有Al3+的数目为0.1NA
B.32 g硫与足量的铜反应,转移的电子数为2NA
C.11.2L氢气中含有的原子数为NA
D.1 mol乙酸分子与1 mol乙醇分子在酸性条件下反应能生成1 mol乙酸乙酯
8、下列实验装置(夹持装置略去)选择正确且能达到相应实验目的的是
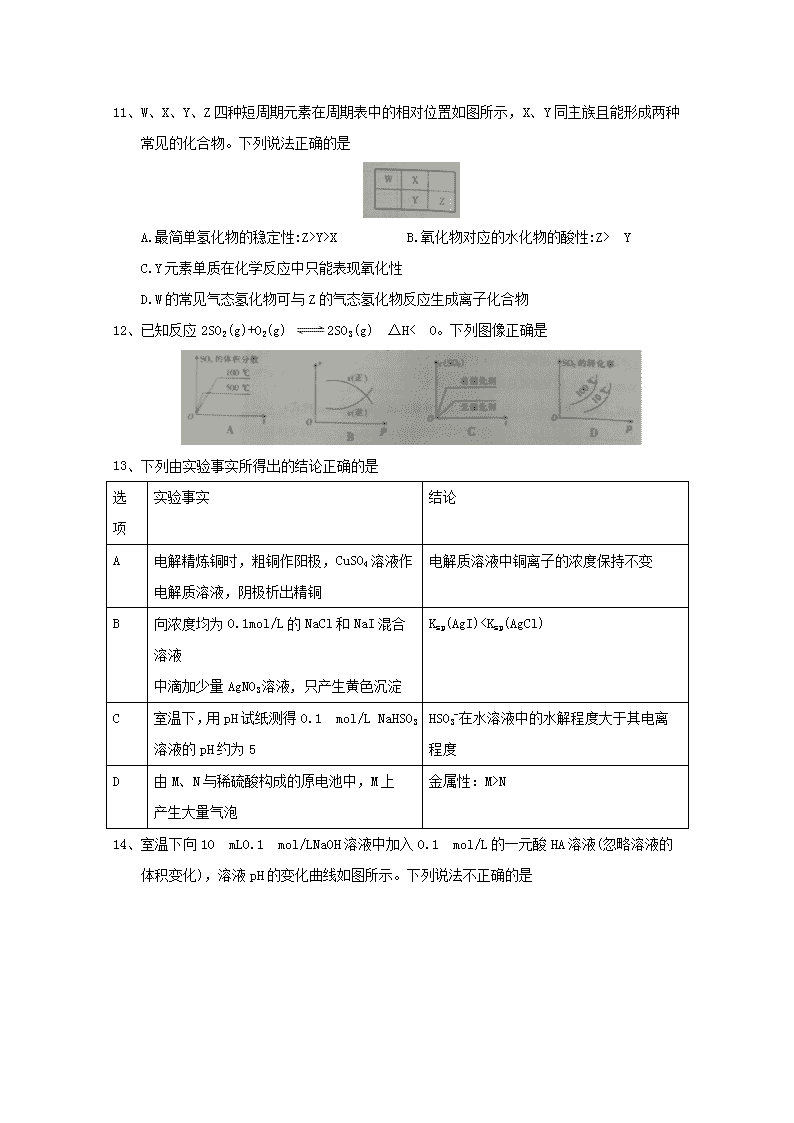
9、工业制硫酸的主要反应之一为2SO2(g)+O2(g) 2SO3(g),反应过程中能量变化如图所示,下列说法错误的是
A.该反应的正反应为放热反应 B.向反应体系中加入催化剂后,图中E3不变
C.该反应的焓变△H=(E1一E2)kJ/mol D.升高温度,E1变大
10、X、Y、Z、W均为中学化学的常见物质,且X、Y、Z均含同一种元素,一定条件下它们之间有如图所示的转化关系(其他产物已略去)。符合上述转化关系的W不可能是
A.Al B.HCl C.O2 D.CO2
11、W、X、Y、Z四种短周期元素在周期表中的相对位置如图所示,X、Y同主族且能形成两种常见的化合物。下列说法正确的是
A.最简单氢化物的稳定性:Z>Y>X B.氧化物对应的水化物的酸性:Z> Y
C.Y元素单质在化学反应中只能表现氧化性
D.W的常见气态氢化物可与Z的气态氢化物反应生成离子化合物
12、已知反应2SO2(g)+O2(g) 2SO3(g) △H< 0。下列图像正确是
13、下列由实验事实所得出的结论正确的是
选项
实验事实
结论
A
电解精炼铜时,粗铜作阳极,CuSO4溶液作
电解质溶液,阴极析出精铜
电解质溶液中铜离子的浓度保持不变
B
向浓度均为0.1mol/L的NaCl和NaI混合溶液
中滴加少量AgNO3溶液, 只产生黄色沉淀
Ksp(AgI)N
14、室温下向10 mL0.1 mol/LNaOH溶液中加入0.1 mol/L的一元酸HA溶液(忽略溶液的体积变化),溶液pH的变化曲线如图所示。下列说法不正确的是
A.a点所示溶液中c(A-)>c(Na+)>c(OH-)>c(H+)
B.a点所示溶液中:c(Na+)=0.05 mol/L
C.pH=7时,c(Na+)=c(A-)
D.b点所示溶液中:c(Na+)CH3COOH>H2CO3(1分)
(2)[c(H+)·c(CH3COO-)]/c(CH3COOH) (2分)
(3)HCO3-CO32-+H+(1分)
(4)H2SO3 +CH3COO-==HSO3-+CH3COOH(2分)
(5)c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)(2分)
19、(1)+2(1分)
(2)3.7≤pH<9.7(2分)
(3)2Fe2++2H++H2O2==2Fe3++2H2O(2分)
(4)1×10-11(1分);2Mg2++ 3CO32-+5H2O==MgCO3·Mg(OH)2·3H2O+2HCO3-(2分)
20、(1)3d24s2(2分)
(2)7(2分);O>N>C(2分)
(3)配位键、极性共价键(2分);18NA(2分)
(4)6(1分);正八面体(1分);4×62/[NA×(2a×10-7)3] (3分)
21、(1)2一甲基一1一丙烯(或2一甲基丙烯)(2分);氧化反应(1分)
(2) (2分)
(3)酯基、醛基(2分)
(4) (2分);
(2分)
(5)6(2分); (2分)