- 327.00 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2017—2018学年度第一学期半期考试
高二(理科)理综化学试题
7.下列说法正确的是( )
A.有气体参加的化学反应,若增大压强(缩小反应容器的容积),可增大活化分子的百分数,从而使反应速率增大。
B.凡是焓变小于零的反应都能自发进行。
C.对于常温下 浓度相同的两种弱酸HA和HB,电离常数大的酸溶液的酸性强,电离常数小的酸溶液的酸性弱。
D.强电解质溶液的导电能力一定比弱电解质溶液的强
8.下列 物质中既能导电又属于强电解质的一组物质是( )
A.熔融的MgCl2和熔融的NaOH B.液氨 和石灰水
C.石墨和食醋 D.稀硫酸和蔗糖
9.下列溶液一定呈中性的是( )
A.PH=7的溶液 B.非电解质溶于水形成的溶液
C.C(H+)=C(OH-)=10-6 mol/L 的溶液 D.酸和碱恰好完全反应生成的正盐溶液
10 常温下,某溶液中由水电离出来的c(OH-)=1×10—11 mol/L,若向该溶液中滴入2~3滴酚酞,溶液的颜色可能是( )
A.只显红色 B.呈无色
C.无色或蓝色 D.红色或无色
11.电离度是描述弱电解质电离程度的物理量
图 CB3-1
电离度=(已电离的物质的量/原来的总物质的量)×100%。现取20 mL pH=3的CH3COOH溶液,加入0.2 mol·L-1的氨水,测得溶液导电性变化如图CB3-1,则加入氨水前CH3COOH的电离度为( )[]
A.0.5% B.1.5% C.0.1% D.1%
12.对于可逆反应:2A(g)+B(g)2C(g) ΔH<0,下列各图正确的是( )
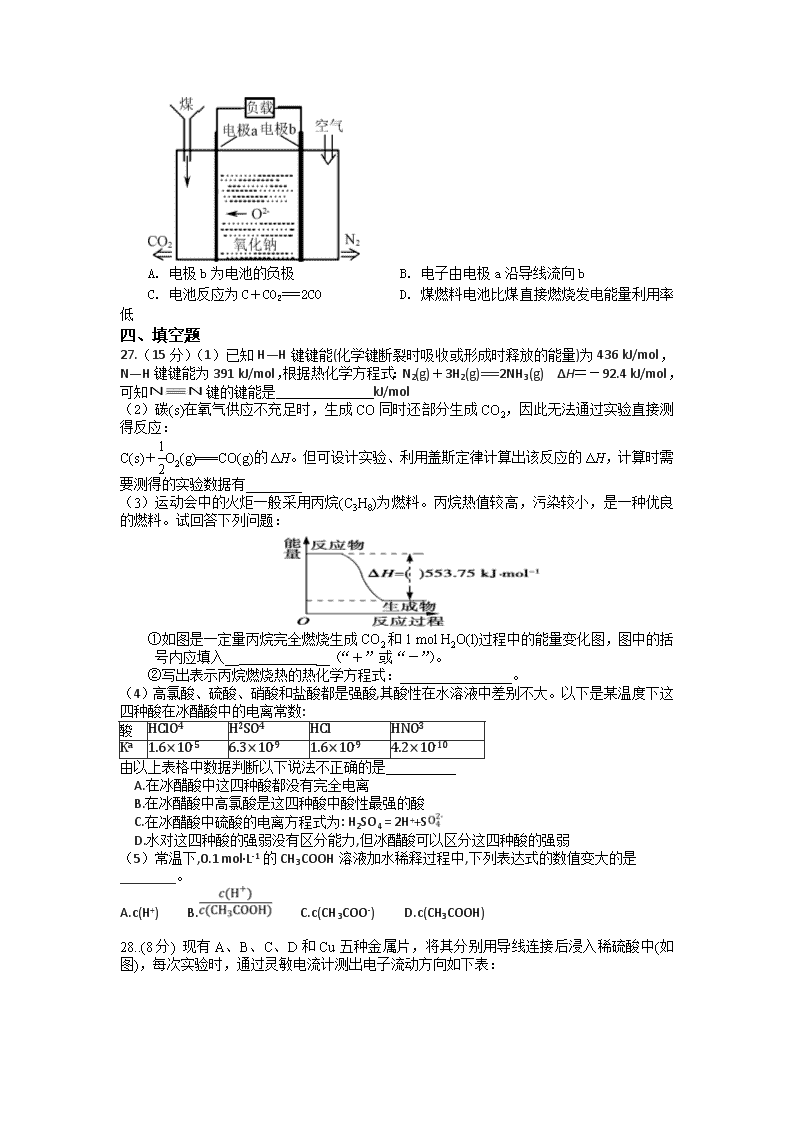
13. “直接煤燃料电池”能够将煤中的化学能高效、清洁地转化为电能,如图是用固体氧化物作“直接煤燃料电池”的电解质。下列有关说法正确的是( )
A. 电极b为电池的负极 B. 电子由电极a沿导线流向b
C. 电池反应为C+CO2===2CO D. 煤燃料电池比煤直接燃烧发电能量利用率低
四、填空题
27.(15分)(1)已知H—H键键能(化学键断裂时吸收或形成时释放的能量)为436 kJ/mol,N—H键键能为391 kJ/mol,根据热化学方程式:N2(g)+3H2(g)===2NH3(g) ΔH=-92.4 kJ/mol,可知键的键能是 kJ/mol
(2)碳(s)在氧气供应不充足时,生成CO同时还部分生成CO2,因此无法通过实验直接测得反应:
C(s)+O2(g)===CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有________
(3)运动会中的火炬一般采用丙烷(C3H8)为燃料。丙烷热值较高,污染较小,是一种优良的燃料。试回答下列问题:
①如图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图,图中的括号内应填入__ __(“+”或“-”)。
②写出表示丙烷燃烧热的热化学方程式:________________。
(4)高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
酸
HClO4
H2SO4
HCl
HNO3
Ka
1.6×10-5
6.3×10-9
1.6×10-9
4.2×10-10
由以上表格中数据判断以下说法不正确的是
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中酸性最强的酸
C.在冰醋酸中硫酸的电离方程式为: H2SO4 = 2H++S
D.水对这四种酸的强弱没有区分能力,但冰醋酸可以区分这四种酸的强弱
(5)常温下,0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数值变大的是________。
A.c(H+) B. C.c(CH3COO-) D.c(CH3COOH)
28..(8分) 现有A、B、C、D和Cu五种金属片,将其分别用导线连接后浸入稀硫酸中(如图),每次实验时,通过灵敏电流计测出电子流动方向如下表:
实验分组
所用金属
电子流向
①
A、Cu
A→Cu
②
C、D
D→C
③
A、C
C→A
④
B、Cu
Cu→B
⑤
……
……
根据上述情况,回答下列问题:
(1) 五种金属的活动性按从大到小的顺序是____________________。
(2) 在①中,Cu片上观察到的现象是____________________。
(3) 在②中,溶液中H+向金属片________移动。
(4) 如果实验⑤用B、D作电极,则导线中电流方向为________(填“B→D”或“D→B”)。
29.(13分)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的炭即可产生水煤气,热化学方程式为:
C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
能使化学反应速率加快的措施有________(填序号)。
①增大C的物质的量
②升高反应温度
③随时吸收CO、H2转化为CH3OH
④密闭定容容器中充入CO(g)
(2)将不同物质的量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下两组数据:
实验组
温度/℃
起始量/mol
平衡量/mol
达到平衡所需时间/min
H2O
CO
H2
CO
1
650
2
4
1.6
2.4
5
2
900
1
2
0.4
1.6
2
①实验1中用CO2表示的化学反应速率为__________________。
②温度从650 ℃升高到900 ℃时,化学平衡常数会________(填“增大”“减小”或“不变”),则该反应的正反应为________(填“吸热”或“放热”)反应。
(3)在一容积为2 L的密闭容器内加入2 mol的CO和6 mol的H2,在一定条件下发生如下反应CO(g)+2H2(g) CH3OH(g) ΔH<0,该反应的逆反应速率与时间的关系如图所示。
t1 t2 t3 t4 t5 t6 t7 t8
若t4时降压,t5时达到平衡,t6时改变的条件可能是____________。
30..(22分)现使用酸碱中和滴定法测定市售白醋(主要成分是CH3COOH)的总酸量(g·100 mL-1)。
已知CH3COOH + NaOH=====CH3COONa + H2O 终点时所得溶液呈碱性。
Ⅰ.实验步骤:
(1)用________________(填仪器名称)量取10.00 mL食用白醋,
在__________(填仪器名称)中用水稀释后转移到100 mL__________(填仪器名称)中定容,摇匀即得待测白醋溶液。
(2)用 取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴__________作指示剂。
(3)读取盛装0.100 0 mol·L-1NaOH 溶液的碱式滴定管的初始读数。如果液面位置如右图所示,则此时的读数为________mL。
(4)滴定。当____________________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录
实验数据(mL) 滴定次数
1
2
3
4
V(样品)
20.00
20.00
20.00
20.00
V(NaOH)(消耗)
15.95
15.00
15.05
14.95
Ⅲ.数据处理与讨论:
(1)甲同学在处理数据时计算得:
平均消耗的NaOH溶液的体积
V=mL=15.24 mL。
指出他计算的不合理之处: _______。
按正确数据处理,可得c(市售白醋)=________mol·L-1;市售白醋总酸量=________g·100 mL-1。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是_________(填写序号)。
A.碱式滴定管在滴定时未用标准NaOH溶液润洗
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出
半期考试高二化学答案
一, 选择题
1C 2A 3 C 4D 5D 6A 7B
二.填空题
1.16分
(1)945.6 kJ·mol-1 : 3分
(2)碳和CO的燃烧热; 3分
(3) - ;1分,
C3H8(g)+5O2(g)===3CO2(g)+4H2O(l) ΔH=-2215.0 kJ·mol-1;3分
(4) C;3分
(5) B ;3分
2.8分,每空2分
(1) D>C>A>Cu>B
(2) 有无色气泡生成
(3) C
(4) B→D
3.12分。第3小题4分,其余每空2分
(1) ② ④
(2)①0.16 mol/(L·min) ②减小 放热
(3)增大反应物的浓度
4.每空2分,共22分
Ⅰ.(1) 酸式滴定管(或10 mL移液管) 烧杯 容量瓶
(2)酸式滴定管酚酞 (3)0.60 (4)溶液由无色恰好变为浅红色,并在半分钟内不褪色 Ⅲ.(1)第1次滴定误差明显大,属异常值,应舍去 0.075 0.45
(2)c
(3)ab