- 2.29 MB
- 2021-11-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2009年全国初中化学素质和实验能力竞赛(第十九届天原杯)复赛试题
试题说明:
1、考试时间:2小时
2、本试卷共6页,满分100分。附加题20分计入总分。答案必须写在答题卷上。
3、可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24
Si:28 S:32 C1:35.5 Fe:56 Cu.:64 Zn:65 Ba:137
一、选择题(本题包括15个小题,每小题2分,共30分。每小题有1个或2个选项符合题意。若有两个答案的错1个不得分,漏选1个扣1分。)
1、为了警示世人因气候变化对人类危害的关注,2009年“世界环境日”的主题是:“团结起来应对气候变化”。下列做法或认识不符合这—主题的是
A、提倡乘坐公共交通、骑自行车或步行的方式出行
B、在生产和生活活动中提倡使用节能技术和节能用具
C、植树造林,严禁乱砍滥伐
D、广泛使用酒精、沼气,既可解决能源问题,也有利减轻温室效应
2、分类法是一种行之有效、简单易行的科学方法。某同学用下表所示形式对所学知识进行分类,其中甲与乙、丙、丁是包含关系。下列各组中,有错误的组合是
选项
甲
乙、丙、丁
A
常见干燥剂
浓硫酸、石灰石、碱石灰
B
常见合金
不锈钢、焊锡、生铁
C
常见营养物质
蛋白质、维生素、无机盐
D
常见碱
烧碱、纯碱、熟石灰
3、2008年诺贝尔化学奖授予钱永健等发明的绿色荧光蛋白标记技术,这项发明为细胞生物学和神经生物学的发展带来一场革命,对我们理解绿色荧光蛋白如何发光作出了贡献。绿色荧光蛋白分子中含有氨基(一NH2,具有碱的性质)和羧基(一COOH,具有酸的性质)。该分子具有的性质是
A、只能与硫酸反应,不能与氢氧化钾反应 B、只能与氢氧化钾反应,不能与硫酸反应
C、既能与硫酸反应,又能与氢氧化钾反应 D、既不能与硫酸反应,又不能与氢氧化钾反应
4、1~18号元素中X元素的原子最外层只有1个电子,Y元素的原子的第三层有6个电子,
Z元素的第二层也有6个电子,在化合物中只有Z元素的化合价为负。由这三种元素组
成的化合物的化学式可能是
A、XYZ4 B、X2YZ3 C、X3YZ4 D、XYZ3
5.咖喱是一种烹饪辅料,若白衬衣被咖喱汁玷污后,用普通肥皂洗涤时,会发现黄色污渍变
为红色,浸泡在水中后红色又变黄色。据此判断可能与咖喱有相似化学作用的试剂是
A、活性炭 B、石蕊溶液 C、无水硫酸铜 D、淀粉溶液
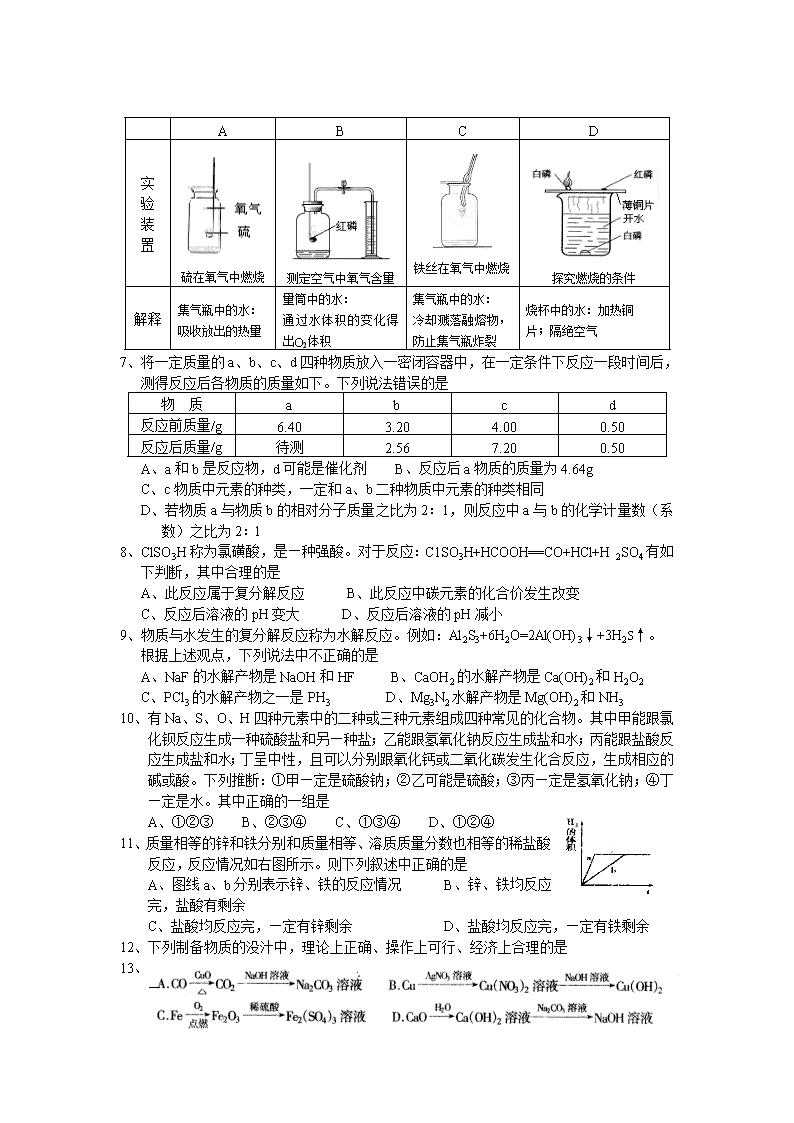
6、对下列实验指定容器中的水,其解释没有体现水的主要作用的是
A
B
C
D
实
验
装
置
硫在氧气中燃烧
测定空气中氧气含量
铁丝在氧气中燃烧
探究燃烧的条件
解释
集气瓶中的水:
吸收放出的热量
量筒中的水:
通过水体积的变化得出O2体积
集气瓶中的水:
冷却溅落融熔物,防止集气瓶炸裂
烧杯中的水:加热铜
片;隔绝空气
7、将一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下。下列说法错误的是
物 质
a
b
c
d
反应前质量/g
6.40
3.20
4.00
0.50
反应后质量/g
待测
2.56
7.20
0.50
A、a和b是反应物,d可能是催化剂 B、反应后a物质的质量为4.64g
C、c物质中元素的种类,一定和a、b二种物质中元素的种类相同
D、若物质a与物质b的相对分子质量之比为2﹕1,则反应中a与b的化学计量数(系数)之比为2﹕l
8、ClSO3H称为氯磺酸,是—种强酸。对于反应:C1SO3H+HCOOH==CO+HCl+H2SO4有如下判断,其中合理的是
A、此反应属于复分解反应 B、此反应中碳元素的化合价发生改变
C、反应后溶液的pH变大 D、反应后溶液的pH减小
9、物质与水发生的复分解反应称为水解反应。例如:Al2S3+6H2O=2Al(OH)3↓+3H2S↑。
根据上述观点,下列说法中不正确的是
A、NaF的水解产物是NaOH和HF B、CaOH2的水解产物是Ca(OH)2和H2O2
C、PCl3的水解产物之一是PH3 D、Mg3N2水解产物是Mg(OH)2和NH3
10、有Na、S、O、H四种元素中的二种或三种元素组成四种常见的化合物。其中甲能跟氯化钡反应生成一种硫酸盐和另—种盐;乙能跟氢氧化钠反应生成盐和水;丙能跟盐酸反应生成盐和水;丁呈中性,且可以分别跟氧化钙或二氧化碳发生化合反应,生成相应的碱或酸。下列推断:①甲—定是硫酸钠;②乙可能是硫酸;③丙—定是氢氧化钠;④丁—定是水。其中正确的一组是
A、①②③ B、②③④ C、①③④ D、①②④
11、质量相等的锌和铁分别和质量相等、溶质质量分数也相等的稀盐酸反应,反应情况如右图所示。则下列叙述中正确的是
A、图线a、b分别表示锌、铁的反应情况 B、锌、铁均反应完,盐酸有剩余
C、盐酸均反应完,—定有锌剩余 D、盐酸均反应完,—定有铁剩余
12、下列制备物质的没汁中,理论上正确、操作上可行、经济上合理的是
13、—
定质量某硝酸钾样品中不含可溶性杂质。在10℃时加蒸馏水使之充分溶解,残留固体
的质量为250g。若该实验在40℃下进行时,残留固体质量为120g;70℃时为20g。已知KNO3
在不同温度下的溶解度如下。对该样品的推断正确的是
温度/℃
10
40
55
70
溶解度/g
20
65
100
140
A、该硝酸钾样品为纯净物 B、40℃时溶于水的硝酸钾为130g
C、70℃时KNO3溶液为饱和溶液 D、55℃左右时KNO3完全溶解
14、一定量的木炭在盛有氮气和氧气混合气体的密闭容器中燃烧后生成CO和CO2,且测得
反应后所得CO、CO2、N2的混合气体中碳元素的质量分数为24%,则其中氮气的质量分
数可能为
A、10% B、30% C、50% D、70%
15、用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管(包括氧
化铜)的质量差和U型管(包括碱石灰)的质量差,计算得氢元素和氧元素的质量比大于1﹕8。
下列对导致这一结果的原因的分析中合理的是
A、I、Ⅱ装置之间缺少干燥装置
B、III装置干燥剂量不足,水没有被完全吸收
C、CuO没有全部被还原
D、Ⅱ装置中玻璃管内有水冷凝
二、填空题(本题包括10个小题,共40分)
16.(2分)构建和谐社会,建设社会主义新农村的目标之一是让农民饮用清洁的自来水。ClO2是新一代饮用水的消毒剂,许多发达国家采用ClO2代替C12进行自来水的消毒。
请回答下列问题:
(1) ClO2的名称为_____________;(2)制取ClO2的微观过程如图所示:
(其中: 表示钠原子, 表示氯原子, 表示氧原子)
该反应的化学方程式是 _____________________________________。
17.(5分)2008年9月27日,太空第一次留下了“中国人的脚印”。我国研制的航天员舱外
服为航天员成功进行太空行走提供了可靠的保证。
(1)航天员舱外服除了要隔热、散热外,在航天服这个密封的空间中还要有通讯系统、动力
系统、输送养料系统和废气处理系统,其中废气处理包括两个步骤:第一步,让废气进入
一个装有木炭的盒子除去臭气,这一过程利用了木炭的 性,发生了_________(填
“物理变化”或“化学变化”);笫二步,再用氢氧化锂(LiOH)作吸收剂除去二氧化碳(氢氧
化锂和氢氧化钠都是碱,具有相似的化学性质),写出该反应的化学方程式____________。
(2)在太空舱里,NiFe2O4可用于促进宇航员呼出的CO2转化为O2,而自身的质量及化学性
质保持不变,你认为NiFe2O4在这一反应中是________。你对维持舱内O2、CO2气体含量
的建议是_______________。
18.(3分)废旧干电池中许多物质应该是可以回收利用的。某种型号干电池的剖面如下图
所示。请回答下列问题:
(1)提取干电池内填充物中的MnO2:取填充物溶于水、过滤、洗涤,得到黑色不溶物。再经过__________的处理,即得到MnO2。
(2)取(1)中过滤得到的滤液,分为两份,一份加入烧碱溶液,加热产
生一种刺激性气味的气体,该气体的水溶液pH>7,且常用作化肥,则
该气体的化学式为______;另一份加入AgNO3溶液,产生白色沉淀,滴加稀HNO3沉淀不
溶解,则可推知A物质的化学式为________________。
19、(2分)某环境监测小组的同学,利用CO与PdCl2溶液反应(水也参与反应)产生黑色金 属钯粉末的反应原理,来检测CO对空气的污染情况。请写出此反应的化学方程式__________________,反应中作还原剂的物质名称是_______________。
20、(4分)现有X、Y、Z三种元素,其中X原子核内只有一个质子;Y原子L层电子数是K层电子数的2倍;X与Z形成的化合物的分子式为ZX3,每个分子内有10个电子。请回答 下列问题:
(1)写出Z元素的原子结构示意图__________;X分别与Y、Z形成的化合物中,具有5个
原子核的微粒的化学式为________________。
(2)某些常见物质可用来合成新材料,如利用高温高压法使石墨转变为人造金刚石。科学家认为Y、Z元素可形成一种比金刚石更硬的化合物,后来人们在实验室成功合成了含有这些元素的化合物(制作晶体薄膜材料),这种化合物的化学式是______________;试推测合成这种化合物所需的条件是____________________。
21、(5分)硫化氢(H2S)是一种有毒的气体,工业上产生的硫化氢要经过处理,使其变成硫单 质。富玛克斯法治理硫化氢的方法和步骤如下:
①用2%~3%的Na2CO3溶液作吸收剂生成两种酸式盐,其中一种为NaHS;
②再加入一种RNO(液)(R表示一种有机基团)与生成的这种酸式盐的水溶液反应生成 硫、碱和RNHOH;
③第二步生成的碱在溶液中与另一种酸式盐反应生成正盐;
④RNHOH与空气中的氧发生反应又得到RNO。
B
C
一
D
↓
一
E
一
一
一
↑
F
一
一
↓
↓
A
B
C
D
E
(1)写出步骤①中另一种酸式盐的化字式______;(2)步骤②反应的化学方程式为__________;富玛克斯法的总反应的化学方程式为____________;RNO在整个过程中起到_________的作用。(3)富玛克斯法治理硫化氢优点是__________________。
22、(6分)实验室有A、B、C、D、E、F六瓶溶液,另有六张写有Na2CO3、BaCl2、Ca(NO3)2、KCl、稀H2SO4、AgNO3的标签。现将部分瓶内溶液各取少许进行两两混合实验,结果见右图(说明:“↓”表示生成沉淀、“↑”表示生成气体、“一”表示无明显变化或生成微溶物,空格表示该实验未做。)
由实验结果,判断各瓶上应贴的标签是:
A________;B________;C________;D________;E________;F________。
23、(4分)由新型无机非金属材料制成的新型发动机,热效率高、寿命长。这类材料中研究
较多的是化合物G。化合物G的相对分子质量为140,含有硅元素,其质量分数为60%,另
含有元素Y。化合物E(含两种元素)与NH3反应制得G和HCl。
(1)G和E的化学式分别为_________、________。(2)粉末状G能够与氧气在高温下反应,所得产物中有一种是空气的主要成分,另一种是氧化物,该过程的化学方程式为___________。
(3)常压的条件下向G中添加氧化铝,经高温烧结制成一种高强度、超硬度、耐磨损、抗
腐蚀的陶瓷材料“赛伦”,化学式可表示为Si6-xAlxOxY8-x。不同温度下x的值不同,在
1400℃时x为2.0,则“赛伦”中Y元素的化合价为___________。
24、(5分)常温下由两种常见的气体A和B组成的混合物,经分析混合气体中只含碳和氢
两种元素,并且A的相对分子质量大于B的相对分子质量,不论A和B以何种比例混合,
碳元素与氢元素的质量比总小于3:1,由此可确定A的化学式是_________;B的化学式是
_______;这样判断的理由是_____________________。若上述气体中碳元素与氢元素的质量
比为6:5,则混合气体中A与B的质量之比为______________。
25.(4分)某化学实验小组为了除去混在N2中的O2,将混合气体通过红热的铜丝网后,发现铜丝网变黑。在研究如何除去黑色物质,回收再利用铜丝网的讨论中,制定了下列方案。
请根据以上方案回答:
(1)乙方案的烧杯中发生反应的化学方程式是(其中B物质自行确定)_________。两种方案相比较,甲方案明显的不足之处是_____________。
(2)若采用甲乙两种方案处理此黑色铜丝网,则回收的铜丝网a的质量 (填“<”、“>”、“=”)铜丝网b的质量。
(3)实验小组的同学发现,按乙方案反应后烧杯中的液体有腐蚀性,应加以适当的处理。他们采取加入铁粉的方案处理废液。加入足量的铁粉充分搅拌,最后得到的溶液中溶质为______________。
三、实验题(本题包括4个小题,共20分)
说明书
主要成分:碳酸镁
适 应 症:用于缓解胃酸过多引起的胃痛。
用 法:嚼碎后服用
注意事项:胃溃疡患者慎服。
26、(5分)人的胃液里含有适量的盐酸,可以帮助消化,但如果胃酸分泌过多,人会感到胃痛。小军拿来了一种抗酸药(治疗胃酸过多的药物),该药物说明书的部分内容如图所示。
当小军看到药物说明书上的服用方法后,对此产生了探究的兴趣,请你和他一起完成探究活动。(写实验操作和实验现象)
【提出问题】抗酸药为什么嚼碎后服用。
【作出猜想】他的猜想是 。
【设计实验】实验一:将一片完整的药片放入试管中,向其中加入5mL5%的稀盐酸;
实验二:将一片药片 放入试管中,向其中加入5mL5%的稀盐酸。
【现象与结论】实验二比实验一反应快。证明小军的猜想正确。
【拓展探究】(1)氢氧化镁、碳酸钙、碳酸氢钠等也常用于制作抗酸药。这些物质必须具备两个条件:一是对身体________________;二是能与胃酸作用。
(2)患有胃溃疡(胃黏膜溃烂)的病人胃酸过多时,不宜服用含碳酸盐的抗酸药,其原因是
。
27.(4分)甲、乙两个实验小组分别进行“Na2CO3和NaCl混合物中Na2CO3含量测定”的实验:
(1)甲组的方法是:用已知浓度盐酸滴加到一定质量的混合物,根据消耗盐酸溶液的体积来测定碳酸钠的含量。在实验过程中除盐酸、试样与水以外,判断反应是否完全必须用到的试剂是
_____________。
(2)乙组的方法是:将样品与稀盐酸反应,测定反应后生成CO2的体积,经换算并计算出样品中Na2CO2的质量。用右图装置测定产生的CO2气体的体积,请分析图Ⅱ装置中油层的作用是______________;使反应前后油层上方气体压强和外界大气压相同操作方法是_____________。
(3)请你再设计一个与甲、乙组操作不同的实验方法,测定混合物中的Na2CO2含量。设计方法是_____________________。
28、(5分)为了测定硫酸铵和氯化铵混合物中氯化铵的质量分数,甲、乙两位同学按下图所示的实验步骤进行实验:
(1)实验时,甲同学使用硝酸银溶液作试剂A,乙同学选用氯化钡溶液作试剂A。其中所选择的试剂A不合理的是_______同学。
(2)以下都是指正确使用试剂A时进行的实验:
①为进行称量、溶解、反应、过滤、洗涤沉淀的各项操作,准备了以下仪器:托盘天平与砝码、烧杯、过滤器、铁架台及附件、胶头滴管、量筒。其中还缺少的一件必备仪器是___________。
②简述判断沉淀B是否洗净的方法____________________________。
③若实验中测得样品质量为W g,沉淀质量为mg则氯化铵的质量分数=______________。
④若过滤所得沉淀未经洗涤即烘干称重,测得结果将___________(填“偏高”、“偏低”、“不变”)。
29.(6分)某市热电厂使用的燃料是含硫较多的煤。该厂附近一所中学的同学经常闻到空气有异味,且空气能见度差。学校研究性学习小组意识到这有可能是该厂排出的废气超标造成的,于是在老师的指导下做了探究实验,请你填写下列空白。
【提出问题】空气里SO2是否超标呢?
【查阅资料】Ⅰ.我国关于SO2在风景区、居民区、工厂区的空气质量标准分别见下表:
地 区
风景区
居民区
工厂区
SO2浓度限值(mg/m3)
0.15
0.50
0.70
Ⅱ.硫酸钡既不溶于水,也不溶于酸(如不与稀盐酸、稀硝酸等反应)。
【设计实验】同学设计以下步骤来测定空气中SO2的含量。
(1)采集工厂附近的空气样品250L。
(2)将空气样品通过NaOH溶液,加入一定量氧化剂H2O2,使其中Na2 SO3完全转化为Na2SO4,反应的化学方程式: 。
(3)再加入过量的BaCl2溶液,经过过滤、洗涤、烘干,称量固体质量为1.2mg。
计算:250L空气样品中SO2的质量为__________mg。由空气质量标准可得出结论:该厂排放的SO2__________。
(4)简述采集空气样品的方法_________________。
【发现新问题】考虑到空气中的各种气体成分,有同学认为该实验测得的SO2的含量偏大,其依据及你提出的实验改进方案是_________________________。
【反思与应用】为尽快改善该地区的空气质量,请你提出一条合理化建议:_______________。
四、计算题(本题包括2个小题,共10分)
30.(5分)将10gCuO粉末加入到100g一定质量分数的稀硫酸中,微热至氧化铜全部溶解再向蓝色溶液中加入m g铁粉,充分反应后,过滤,将滤渣烘干得到干燥固体物质m g。
求:(1)所加稀硫酸的溶质的质量分数;
(2)当m取何值时,才能满足加入的铁粉和得到的固体质量相等。
31.(5分)燃烧矿物燃料释放出CO2导致温室效应已引起广泛关注。已知燃烧16gCH4 (相对分子质量是16)释放890kJ能量;燃烧114g汽油(分子式为C8H18、相对分子质量是114)释放5451kJ能量。经计算,综合分析哪种燃料为较清洁的燃料?
附加题(20分):
1.(10分)向100g质量分数分别为3.65%盐酸和12%MgSO4的混合溶液中,滴加质量分数为3.42%的Ba(OH)2溶液至过量。(为便于计算设溶液的密度为1g/cm3)
(1)请将产生不同沉淀阶段的沉淀的化学式与加入Ba(OH)2溶液体积(V)间的关系填入下表:
Ba(OH)2溶液体积(V)/mL
沉淀的化学式
(2)请在下面坐标系中完成沉淀的质量和Ba(OH)2溶液体积(V)间的关系图线。
2.(10分)以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:
氯化铵和硫酸钠的溶解度随温度变化如上图所示。回答下列问题:
(1)实验室进行蒸发浓缩用到的主要仪器有____________、烧杯、玻璃棒、酒精灯等。
(2)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为____________。
(3)不用其它试剂,检查NH4Cl产品是否纯净的方法及操作是___________________________
_______________________________________________________________________。
(4)设计实验验证硫酸钠中含有NH4Cl
________________________________________________________________________________________________________________________________。
2009年全国初中学生化学素质
和实验能力竞赛(第十九届天原杯)复赛试题参考答案
一、选择题:
题号
1
2
3
4
5
6
7
8
答案
D
A、D
C
B
B
A
B
D
题号
9
10
11
12
13
14
15
答案
C
D
A、D
D
D
B
A、D
二、填空题:(除表明分数外,其余皆为每空1分)
16.(2分)(1)二氧化氯 (2)Cl2 + 2NaClO2 = 2ClO2 + 2NaCl
17.(5分)(1)吸附; 物理变化; 2 LiOH + CO2 == Li2CO3 + H2O
(2)催化剂;种植绿色植物,经光合作用来维持O2、CO2气体含量的相对稳定
18.(3分)(1)灼烧 (2) NH3;NH4Cl
19.(2分)CO + PdCl2 + H2O=2HCl + Pd + CO2; 一氧化碳
20.(4分)(1)
;CH4(NH4+也可) (2)C3N4; 高温高压
21.(5分)(1) NaHCO3
(2)NaHS + RNO + H2O == S↓+ NaOH + RNHOH;2H2S + O2 == 2 S↓ + 2 H2O;催化
(3)可循环利用反应物,符合绿色化学理念。(类似回答也算正确。)
22.(6分)A.Ca(NO3)2 B.KCl C.AgNO3 D.Na2CO3 E.H2SO4 F.BaCl2
23.(4分)(1)Si3N4;SiCl4(2)Si3N4 + 3 O2 == 3 SiO2 + 2 N2(3)−3
24.(5分)CH4; H2;在CH4分子中,C、H的质量比为3 ∶1,在CH4中混入任何比例的H2都将使C、H的质量比小于3 ∶1; 8 ∶3(2分)
25.(4分)(1)CuO + H2SO4 == CuSO4 + H2O(其他合理答案也可);需要制取CO且CO有毒、尾气CO未处理、实验装置复杂等(其他合理答案也可) (2)>
(3)硫酸亚铁(其他合理答案也可)。
三、实验题:(除表明分数外,其余皆为每空1分)
26.(4分)嚼碎后服用疗效快(或嚼碎后药物与胃酸的反应快;或反应物的接触面积增大,化学反应加快) 研碎 (1)副作用小(其他合理答案也可) (2)碳酸盐与盐酸作用生成二氧化碳气体,可能加重胃溃疡病情
27.(5分)(1)指示剂(或甲基橙等)
(2) 防止二氧化碳溶于水,影响气体体积的测定; 打开弹簧夹,移动量气管,使油层与量气管的液面处于同一水平面 。
(3)取一定量的混合物溶解后加入足量的CaCl2,然后过滤、洗涤、烘干、称量碳酸钙的质量,由碳酸钙的质量算出Na2CO3的质量。(2分)
28.(5分)(1)甲 (2)① 玻璃棒 ② 取最后的洗涤液,滴加AgNO3溶液。若无沉淀生成,则沉淀已洗净;反之未洗净。 ③ ④偏低
29.(6分)(2)Na2SO3 + H2O2 == Na2SO4 + H2O (3)0.33; 超标;
(4)用打气管注入;瘪的塑料袋撑起……(其他合理答案也可;但遇水不给分) 空气中的二氧化碳也要和氢氧化钠溶液反应,并继续与BaCl2溶液反应,生成碳酸钡沉淀。向沉淀中加入过量的稀硝酸后,再进行其余操作。 工厂废气进行治理,达标后再排放。
四、计算题:
30.(5分)(1)14%(2分)(2)m≥8 g(3分)
31`.(5分)燃烧等质量(设为1.0 g)CH4、C8H18释放热量分别为56 kJ/g、48 kJ/g
燃烧等质量(设为1.0 g)CH4、C8H18释放CO2的量分别为2.8 g、3.1 g
燃烧1.0 g CH4释放的热量多于燃烧1.0 g C8H18释放的热量,而前者释放CO2的量又低于后者,所以CH4是清洁燃料(仅从任一方面说明、只给3分)。
附加题:(20分)
1.( 10分)(1)(前三组每组2分,最后一组不计分)
Ba(OH)2溶液体积(V)/mL
[0 ~250]
(250 ~500]
(500 ~ 750]
(750 -
沉淀的化学式
BaSO4
BaSO4、Mg(OH)2
Mg(OH)2
─
(2)(图线正确3分,坐标完整1分)
2.(10分)(1)蒸发皿(1分) (2)35~45℃ (2分) (3)加热法。取少量氯化铵产品于试管底部,加热,若试管底部无残留物,表明氯化铵产品纯净(4分)
(4)把少量固体放入试管中,加氢氧化钠溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝色,证明含有氯化铵(或把少量固体放入研钵中,加入消石灰,研磨,有刺激性气味的气体产生,证明含有氯化铵)(3分)