- 337.50 KB
- 2022-04-01 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2020-2021学年九年级化学上学期期中备考必刷题专练04(流程推断题)(基础)1.A、B、C、D、E、F等六种物质之间可发生如下反应:①将黑色粉末A和无色液体B混合,生成一种无色无味的气体C,②加热暗紫色固体E,可同时得到A和C,无色气体C能使带火星的木条复燃,③若将金属D放在盛有C的集气瓶中燃烧,火星四射,生成一种黑色固体F,并放出热量。(1)试推断A、C、E、F各是什么物质?(用物质的化学式填空)A是_____,C是____,E是_____,F是____。 (2)写出①③反应的化学反应符号表达式,并指明反应类型;①____________________,__________。③____________________,__________。【答案】(1)MnO2O2KMnO4Fe3O4(2)H2O2H2O+O2分解反应Fe+O2Fe3O4化合反应【解析】无色气体C能使带火星的木条复燃,说明C是氧气,①将黑色粉末A和无色液体B混合能够制取氧气,是过氧化氢和二氧化锰制取氧气,黑色粉末A是二氧化锰、无色液体B是过氧化氢溶液;②加热暗紫色固体E,可同时得到A和C,是高锰酸钾加热生成二氧化锰和氧气,暗紫色固体E是高锰酸钾;③若将金属D放在盛有氧气的集气瓶中燃烧,火星四射,生成一种黑色固体F,并放出热量。说明是铁丝在氧气中燃烧生成四氧化三铁,金属D是铁,生成一种黑色固体F是四氧化三铁。(1)A是二氧化锰MnO2;C是氧气O2;E是高锰酸钾KMnO4;F是四氧化三铁Fe3O4。(2)①过氧化氢和二氧化锰制取氧气,同时生成水,H2O2H2O+O2;分解反应。③铁丝在氧气中燃烧生成四氧化三铁,Fe+O2Fe3O4;化合反应。(重点)2.A、B、C、D四种元素,A元素的原子的第三层电子层上有1个电子;B元素最低价态为﹣2价,其离子的核外电子数与A离子的核外电子数相同;C元素的单质是密度最小的气体;D元素原子核外有2层电子,且可与B形成DB2型化合物,一个DB2分子中含有22个质子。请填写下列空白:(1)A、B、C、D四种元素分别为:A_____、B_____、C_____、D_____。
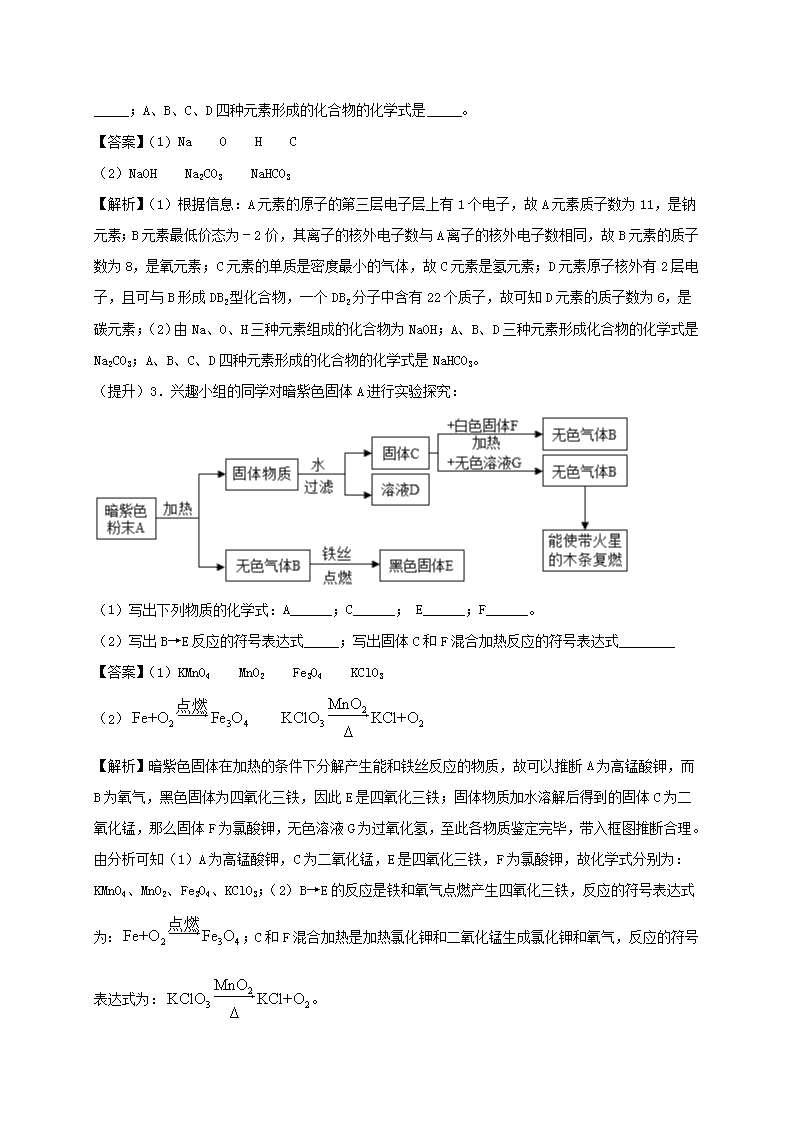
(2)A、B、C三种元素形成化合物的化学式是_____;A、B、D三种元素形成化合物的化学式是_____;A、B、C、D四种元素形成的化合物的化学式是_____。【答案】(1)NaOHC(2)NaOHNa2CO3NaHCO3【解析】(1)根据信息:A元素的原子的第三层电子层上有1个电子,故A元素质子数为11,是钠元素;B元素最低价态为﹣2价,其离子的核外电子数与A离子的核外电子数相同,故B元素的质子数为8,是氧元素;C元素的单质是密度最小的气体,故C元素是氢元素;D元素原子核外有2层电子,且可与B形成DB2型化合物,一个DB2分子中含有22个质子,故可知D元素的质子数为6,是碳元素;(2)由Na、O、H三种元素组成的化合物为NaOH;A、B、D三种元素形成化合物的化学式是Na2CO3;A、B、C、D四种元素形成的化合物的化学式是NaHCO3。(提升)3.兴趣小组的同学对暗紫色固体A进行实验探究:(1)写出下列物质的化学式:A______;C______;E______;F______。(2)写出B→E反应的符号表达式_____;写出固体C和F混合加热反应的符号表达式________【答案】(1)KMnO4MnO2Fe3O4KClO3(2)【解析】暗紫色固体在加热的条件下分解产生能和铁丝反应的物质,故可以推断A为高锰酸钾,而B为氧气,黑色固体为四氧化三铁,因此E是四氧化三铁;固体物质加水溶解后得到的固体C为二氧化锰,那么固体F为氯酸钾,无色溶液G为过氧化氢,至此各物质鉴定完毕,带入框图推断合理。由分析可知(1)A为高锰酸钾,C为二氧化锰,E是四氧化三铁,F为氯酸钾,故化学式分别为:KMnO4、MnO2、Fe3O4、KClO3;(2)B→E的反应是铁和氧气点燃产生四氧化三铁,反应的符号表达式为:;C和F混合加热是加热氯化钾和二氧化锰生成氯化钾和氧气,反应的符号表达式为:。
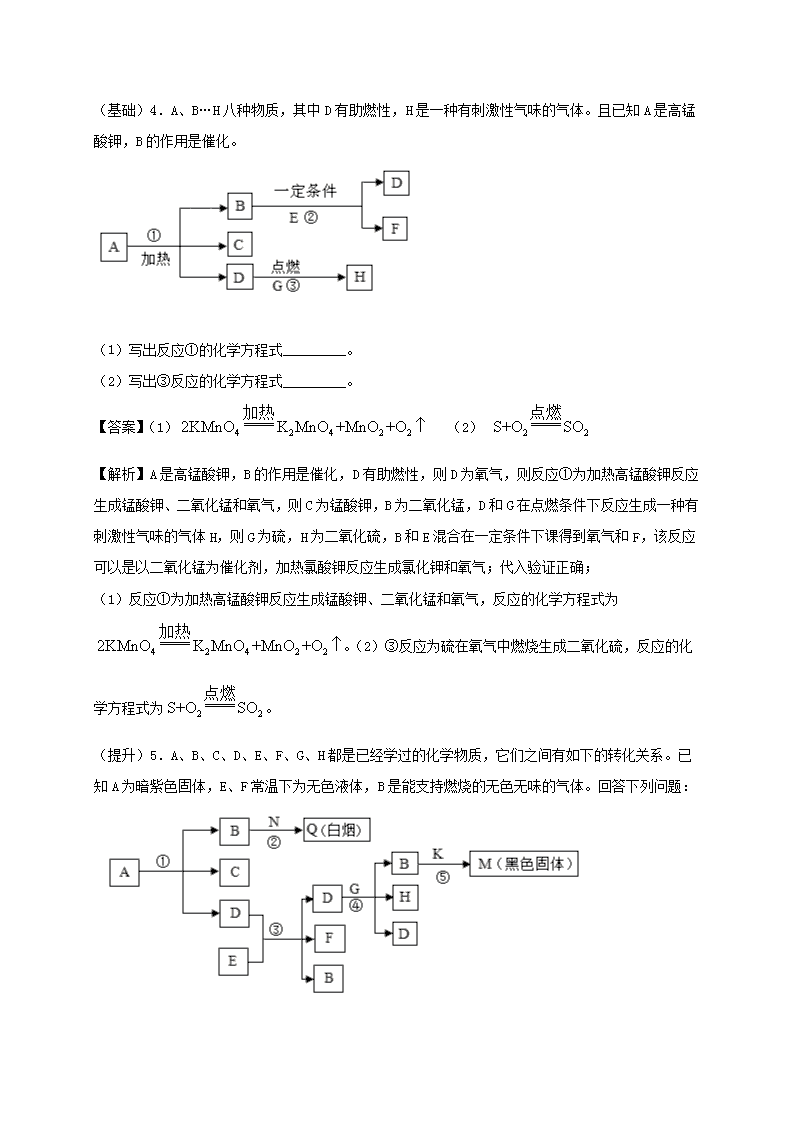
(基础)4.A、B…H八种物质,其中D有助燃性,H是一种有刺激性气味的气体。且已知A是高锰酸钾,B的作用是催化。(1)写出反应①的化学方程式_________。(2)写出③反应的化学方程式_________。【答案】(1)(2)【解析】A是高锰酸钾,B的作用是催化,D有助燃性,则D为氧气,则反应①为加热高锰酸钾反应生成锰酸钾、二氧化锰和氧气,则C为锰酸钾,B为二氧化锰,D和G在点燃条件下反应生成一种有刺激性气味的气体H,则G为硫,H为二氧化硫,B和E混合在一定条件下课得到氧气和F,该反应可以是以二氧化锰为催化剂,加热氯酸钾反应生成氯化钾和氧气;代入验证正确;(1)反应①为加热高锰酸钾反应生成锰酸钾、二氧化锰和氧气,反应的化学方程式为。(2)③反应为硫在氧气中燃烧生成二氧化硫,反应的化学方程式为。(提升)5.A、B、C、D、E、F、G、H都是已经学过的化学物质,它们之间有如下的转化关系。已知A为暗紫色固体,E、F常温下为无色液体,B是能支持燃烧的无色无味的气体。回答下列问题:
(1)写出下列物质的名称:C_________;H___________;(2)写出下列物质的化学式:F______;G___________;(3)写出下列化学反应的化学方程式:反应②:__________;反应⑤:___________。【答案】(1)锰酸钾氯化钾(2)H2OKClO3(3)4P+5O22P2O53Fe+2O2Fe3O4(或2Cu+O22CuO)【解析】A、B、C、D、E、F、G、H都是已经学过的化学物质,E、F常温下为液体,B为能支持燃烧的无色气体,所以B是氧气;氧气和N反应生成白烟Q,所以N是磷,Q是五氧化二磷;A为暗紫色固体,暗紫色的物质A分解生成氧气,所以A是高锰酸钾,高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气;过氧化氢在二氧化锰催化作用下分解生成水和氧气,E、F常温下为液体,D和E反应生成D、F和氧气,所以D是二氧化锰,E是过氧化氢溶液,F是水,C是锰酸钾;二氧化锰和G也会生成氧气,且D(二氧化锰)不变,氯酸钾在二氧化锰催化作用下分解生成氯化钾和氧气,则G是氯酸钾,H是氯化钾;氧气和K反应生成黑色固体M,铁在氧气中燃烧生成四氧化三铁,铜与氧气加热生成氧化铜,所以K是铁(或铜),M是四氧化三铁(或氧化铜),将推断的物质代入验证正确。(1C物质的名称是:锰酸钾;H物质的名称是:氯化钾;(2)F是H2O,G是KClO3;(3)由分析知,反应②是磷燃烧生成了五氧化二磷,反应的化学方程式是:4P+5O22P2O5;反应⑤可以是铁在氧气中燃烧生成四氧化三铁,也可以是铜与氧气加热生成氧化铜,反应的化学方程式是:3Fe+2O2Fe3O4、2Cu+O22CuO。(提升)6.如图中A—E是初中化学常见的物质,已知A、B、E是氧化物,且A和B组成元素相同,D转化成E时会发生火星四射。(1)C物质的化学式为_____。(2)D转化成E的化学方程式为。该反应属于___反应。(3)写出D物质的一个用途____________________。
【答案】(1)H2(2)3Fe+2O2Fe3O4化合(3)供给呼吸等【解析】D转化成E时会发生火星四射,说明氧气和铁生成了四氧化三铁,又A、B、E是氧化物,且A和B组成元素相同,故A为过氧化氢,B为水,水通电生成氢气,氢气燃烧生成水C为氢气,D为氧气,E为四氧化三铁,代入转化关系,符合题意。(1)C为氢气,故填:H2。(2)D为氧气,E为四氧化三铁,铁和氧气反应生成四氧化三铁,反应多变一,属于化合反应,化学方程式3Fe+2O2Fe3O4,故填:3Fe+2O2Fe3O4;化合。(3)D为氧气,可以共给呼吸,故填:供给呼吸等。(提升)7.氧气是空气的主要成分之一,地球上一切生命体每时每刻都离不开氧气.氧气的化学性质比较活泼,能与多种物质发生化学反应.比如,硫可以在氧气中燃烧,发出的火焰颜色为_____色.如图是有关氧气的知识结构图(部分反应条件省略,参加反应的氧气为足量).回答下列问题:(Ⅰ)反应①得到的气体体积比V(正):V(负)=___;(Ⅱ)反应②的符号表达式为_______;属于____反应(填基本反应类型);(Ⅲ)反应③中二氧化锰的作用是_______;(Ⅳ)物质④排放过多会造成___________环境问题;(Ⅴ)其中带点元素的化合价为___价;(Ⅵ)写出在点燃条件下生成⑤的符号表达式为_____________.【答案】蓝紫(Ⅰ)1:2(Ⅱ)KMnO4K2MnO4+MnO2+O2分解(Ⅲ)催化作用(Ⅳ)温室效应(Ⅴ)+5(Ⅵ)Fe+O2Fe3O4
【解析】硫可以在氧气中燃烧,发出的火焰颜色为蓝紫色。(Ⅰ)反应①电解水负极产生氢气,正极产生氧气,得到的气体体积比V(正):V(负)=1:2;(Ⅱ)反应②高锰酸钾加热产生锰酸钾、二氧化锰和氧气的符号表达式为KMnO4K2MnO4+MnO2+O2;该反应符合“一变多”属于分解反应;(Ⅲ)反应③氯酸钾与二氧化锰混合加热产生氧气,二氧化锰的作用是:催化剂作用,加速氯酸钾的分解;(Ⅳ)碳在氧气中燃烧产生二氧化碳,二氧化碳排放过多会造成温室效应环境问题;(Ⅴ)设磷元素的化合价为x,则2x+(-2)×5=0,x=+5;(Ⅵ)铁在氧气中燃烧产生四氧化三铁的符号表达式为:Fe+O2Fe3O4。(提升)8.甲、乙、丙三种物质均含地壳中含量最多的元素。甲、乙是组成元素完全相同的化合物,丙是单质;甲为液体,在一定条件下可分解生成乙和丙。它们之间有如图所示的转化关系。(1)写出物质的化学式:甲_____;乙_____。(2)从微观的角度解释甲、乙性质有差异的原因是_____。(3)A是一种黑色固体粉末,能加快甲的分解速度,但反应前后其质量和化学性质没有发生变化,则A的化学式可能是_____,在该反应中作_____。(4)反应③的文字表达式是:_____,其基本反应类型属于_____。从反应③可以推测丁物质具有的一种化学性质是:_____。丁是未来能源领域中的新型高能燃料,从环保的角度看,其突出的优点是_____。【答案】(1)H2O2H2O(2)分子构成不同(3)MnO2催化剂(4)氢气+氧气水化合反应可燃性产物是水,不污染环境【解析】(1)地壳中含量最多的元素为氧元素,则单质丙为氧气;甲为液体,在一定条件下可分解生成乙和丙,可判断乙为水、甲为过氧化氢,水通电分解生成氧气和氢气,丁和丙反应生成水,所以丁是氢气,丙是氧气,故甲、乙的化学式分别为:H2O2、H2O;(2)根据物质结构决定性质,甲-过氧化氢H2O2、乙-水H2
O,两物质的组成元素相同,但两物质的分子结构不同,所以两物质的性质有差异;(3)A是一种黑色固体粉末,能加快甲的分解速度,但反应前后其质量和化学性质没有发生变化,所以A是二氧化锰,在该反应中作催化剂;(4)反应③是氢气在氧气中燃烧,文字表达式是:氢气+氧气水,此反应属于化合反应;氢气作为能源的最大优点是产物是水,不污染环境。(提升)9.A、B、C、D、E、F分别为初中常见的六物质,A、B均为白色固体,C、E均为人类生命活动不可缺少的物质,C、E为气体,D为淡黄色粉末,F与C反应的生成黑色固体,图中“→”表示一种物质能生成另一种物质,“一”表示两种物质能发生反应。下图表示物质之间的反应关系和转化关系,请回答下列问题。(1)请你写出图中下列物质的化学式或名称:A_____,C_____,E_____,F_____。(2)请写出C与D反应的实验现象_____。(3)请写出A生成C和B的符号表达式_____。【答案】(1)氯酸钾氧气二氧化碳铁(2)淡黄色固体燃烧,发出明亮的蓝紫色火焰,生成一种有刺激性气味的气体(3)【解析】本题突破口应先从D物质推起,D是淡黄色粉末,且与人类不可缺少气体C反应,可以确定D为硫,C为氧气;A是可以产生氧气的白色固体,且A还可以生成白色固体B,则A为氯酸钾,B为氯化钾;氧气还可以生成另一种人类不可缺少气体E,氧气不能生成氮气,E也不可能是有害气体,那么E确定是二氧化碳;F与C反应的生成黑色固体,则F为铁,铁与氧气反应生成黑色的四氧化三铁。(1)图中下列物质的化学式或名称:A是氯酸钾,C是氧气,E是二氧化碳,F是铁。(2)C与D反应是硫在氧气中燃烧,实验现象是淡黄色固体燃烧,发出明亮的蓝紫色火焰,生成一种有刺激性气味的气体。(3)A生成C和B是氯酸钾分解生成氯化钾和氧气,符号表达式。(提升)10.如图中的A~E表示几种初中化学常见的物质,其中C、D是单质,A、B、E是氧化物;B中两种元素的质量比为1∶16。图中“—”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去。
(1)B的化学式是__________。(2)写出有关反应的化学方程式:B→A:__________,A→C:____________。(3)若D转化为E时火星四射,有黑色固体产生,则E的化学式是____________。【答案】(1)H2O2(2)2H2O22H2O+O2↑2H2O2H2↑+O2↑(3)Fe3O4【解析】(1)A~E表示几种初中化学常见的物质,C、D是单质,A、B、E是氧化物,B中两种元素的质量比为1:16,B会生成A、D,A会生成D,所以B是过氧化氢溶液,A是水,D是氧气,C是氢气,经过验证,推导正确,所以B是:H2O2;(2)B→A是过氧化氢在二氧化锰催化作用下生成水和氧气,方程式是2H2O22H2O+O2↑;A→C是水电解生成氢气和氧气,方程式是2H2O2H2↑+O2↑;(3)若D转化为E时火星四射,有黑色固体产生,铁和氧气在点燃的条件下生成四氧化三铁,剧烈燃烧,火星四射,生成黑色固体,所以E的化学式为:Fe3O4;(基础)11.空气中氧气约占21%,利用分离液态空气的方法得到氧气是工业上制取氧气的重要途径,下面是工业上制氧气流程图:
(1)工业上分离液态空气制氧气的变化属于_____(填“物理变化”或“化学变化”);(2)氮气的沸点-196℃,氩气的沸点-186℃,氧气的沸点-183℃,在蒸发的过程中先被蒸发出来的是_____(填化学符号);(3)这样制得的氧气是_____(填“纯净物”或“混合物”);(4)任何物质我们都要辩证的看待,氧气既有利的一面,也有有害的一面请各写出一点:有利的一面(用途)_____,有害的一面_____。【答案】(1)物理变化(2)(3)混合物(4)供给呼吸(或支持燃烧或医疗急救等)食物变质(或金属生锈等)(答案合理即可)【解析】(1)工业上分离液态空气制氧气的变化过程是利用空气中各成分的沸点不同,可先后挥发而分离,没有新的物质生成,是物理变化;(2)氮气的沸点-196℃,氩气的沸点-186℃,氧气的沸点-183℃,在蒸发的过程中先被蒸发出来的是氮气:N2;(3)这样制得的氧气是混合物,含有空气中其他物质;(4)任何物质我们都要辩证的看待,氧气既有利的一面,也有有害的一面请各写出一点:有利的一面(用途)供给呼吸,支持燃烧,有害的一面:食物变质(或金属生锈等)(答案合理即可)。(提升)12.空气中氮气的含量最多,氮气在高温、高能量条件下可与某些物质发生反应。下图是以空气和其他必要的原料合成氮肥(NH4NO3)的工业流程。请按要求回答下列问题:
(1)空气中氧气的体积分数是__________。(2)步骤①中发生的是________(填“物理”或“化学”)变化。(3)写出步骤③中发生反应的符号表达式_____________________________。(4)上述化学反应中属于化合反应的有________个。(5)右图是化肥硝酸铵包装袋上的部分说明,硝酸铵应具有的性质是______(填字母)。A.易溶于水B.熔点高C.受热易分解【答案】(1)21%(2)物理(3)NH3+O2NO+H2O(4)3(5)AC【解析】(1)由教材可知,按体积分数空气中各成分的含量为78%的氮气,21%的氧气,0.94%的稀有气体,0.03%的二氧化碳,0.03%的其他气体和杂质,故填21%。(2)空气属于混合物,可以利用各成分的沸点不同,用蒸发的方法将各成分分离开,而蒸发属于物理变化,故填物理。(3)该处变化是氨气和氧气在催化剂和加热条件下反应生成一氧化氮和水,故符号表达式写为NH3+O2NO+H2O。(4)反应中的②④⑤都是两种物质参加反应生成一种新物质,属于化合反应,故填3。(5)硝酸铵是一种极易溶于水的盐,并且在受热的条件极易发生分解反应生成氨气等物质,故填AC。(提升)13.实验室用高锰酸钾制取氧气,并对相关物质进行回收。实验过程如下所示,根据以上流程回答下列问题:(1)高锰酸钾制取氧气的方程式__________(2)实验室收集无色气体A的方法有______________
(3)固体B的成分是______________(4)已知二氧化锰难溶于水,锰酸钾可溶于水,则操作I的名称是__________,回收到黑色固体D,可用于_____________________.【答案】(1)(1)排水法或向上排空气法(1)KMnO4和K2MnO4和MnO2(1)过滤实验室用过氧化氢分解制氧气的催化剂【解析】(1)高锰酸钾制取氧气的方程式为:;(2)高锰酸钾加热可以生成氧气,氧气不易溶于水且密度比空气大,可以排水法或向上排空气法收集;(3)因为固体B在加热情况下仍可以生成氧气,说明固体B含有KMnO4,同时还含有上一步反应生成的固体K2MnO4和MnO2,故固体B为KMnO4和K2MnO4和MnO2。(4)过滤可以将固液分离,故操作I的名称是过滤;黑色固体是二氧化锰,可以作实验室用过氧化氢分解制氧气的催化剂。(重点)14.某兴趣小组在实验室模拟水厂将浑浊的湘江水净化成自来水,并最终制成蒸馏水,其实验流程如下图所示:请回答下列问题:(1)加入明矾的作用是______;操作1的名称是______。(2)利用如图所示的装置进行操作2,此操作的作用是_____待处理的水应该从____端通入(填“a”或“b”),理由是_________。(3)取少量的液体D于试管中,滴入肥皂水振荡,发现有较多的浮渣产生,说明此液体为_____(填“软水”或“硬水”),生活中常用_____的方法软化硬水。(4)通过操作3可以得到净化程度较高的蒸馏水,操作3的名称是____。【答案】(1)吸附固体,加速沉降过滤
(2)除去色素和异味b净化效果更好(3)硬水煮沸(4)蒸馏【解析】(1)明矾溶于水形成具有吸附性的物质,能加速除去水中的不溶性固体杂质,故加入明矾的作用是吸附固体,加速沉降;操作1得到的是固体和液体,故该操作的名称是过滤;(2)利用如图所示的装置进行操作2,可以利用活性炭的吸附性,除去色素和异味,待处理的水应该从b端通入,水与活性炭充分接触,净化效果更好;(3)取少量的液体D于试管中,滴入肥皂水振荡,发现有较多的浮渣产生,说明此液体为硬水,水样煮沸时,水中的可溶性钙、镁化合物转化为沉淀,水的硬度下降,生活中常用煮沸的方法软化硬水;(4)通过操作3可以得到净化程度较高的蒸馏水,操作3是蒸馏。(提升)15.中水又称再生水,是指废水或雨水经适当处理后,达到一定的水质指标,可以在一定范围内重复使用的非饮用水(如满足市政、农业用水等)。下图为某中水处理系统流程图,请回答下列问题。(1)调节池预处回理用需不断搅拌,在实验室里用于搅拌的玻璃仪器是_____。(2)格栅和石英砂的作用相当于实验操作中的_____,活性炭的作用是_____。(3)消毒池中通常加入二氧化氯(化学式),其中Cl的化合价是_____。(4)用____可初步判断清水池中水的软硬度,若中水为硬水,则实验现象是_____。(5)节约用水是每个公民应尽的义务。下列措施应提倡的是_____。A用淘米水浇花B用喷灌方式灌溉园林C久置的桶装水直接倒掉【答案】(1)玻璃棒(2)过滤吸附(3)(4)肥皂水产生的泡沫少,浮渣多
(5)AB【解析】(1)在实验室里用于搅拌的玻璃仪器是玻璃棒。(2)格栅和石英砂能除去不可溶性的杂质,作用相当于实验操作中的过滤,活性炭的作用是吸附。(3)在二氧化氯化学式)中氧元素的化合价为价,推出氯的化合价是。(4)用肥皂水可初步判断清水池中水的软硬度,若中水为硬水,则实验现象是产生的泡沫少,浮渣多。(5)A、用淘米水浇花,一水多用,能节约用水,应提倡;B、用喷灌方式灌溉园林,能节约用水,应提倡;C、久置的桶装水直接倒掉,会造成水的浪费,不应提倡。