- 105.50 KB
- 2022-04-01 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第十一单元盐化肥《课题1生活中常见的盐》导学案(第1课时)一、学习目标1.认识生活中常见的盐。2.初步学会鉴别碳酸根离子的方法,能判断复分解反应的类型和发生条件。3.了解我国科学家对化学工业的杰出贡献,激发爱国热情。二、自主学习:(一)创设学习情境老师展示一袋食盐,并问同学们这是什么?这是食盐。那我们化学中的盐是不是指的也是食盐呢?(二)自主学习【知识点1】认识生活中常见的盐。请同学们阅读教材第72页,回答下列问题。1.生活中的盐是,工业用盐指的是。化学中的盐是。2.碳酸钠俗称是,碳酸氢钠俗称是.3.食盐的用途有。【知识点2】碳酸根离子的鉴别1.回忆实验室制取二氧化碳的反应现象及方程式。新课标第一网2.学生实验:【实验11-1】并参照碳酸钙与盐酸的反应书写方程式。碳酸钠+盐酸碳酸氢钠+盐酸现象方程式【思考讨论】为什么这些反应都生成了二氧化碳?【总结归纳】碳酸根离子的鉴别方法是。【思考讨论】这些碳酸盐有什么用途?【总结归纳】物质氯化钠碳酸钠碳酸氢钠碳酸钙化学式俗名主要用途三、合作探究:我们生活中哪些物质含有碳酸盐,怎样证明?【总结归纳】1.生活中含碳酸盐的物质有证明方法是四、巩固达标:
1、我国有端午节吃粽子的风俗,“返青粽叶”包装的粽子中含有硫酸铜,误食这样的粽子有害健康。硫酸铜属于()A.混合物B.氧化物C.盐D.酸2、下列说法正确的是( )A 盐都能食用,故称食盐 B 盐就是食盐,易溶于水C 盐都用咸味,都是白色晶体 D 盐是一类物质的总称3、下列常见盐在生产、生活中的用途不合理的是()新|课|标|第|一|网A.用亚硝酸钠腌制食品B.用硫酸铜精炼铜C.用纯碱消耗面粉发酵生成的酸D.用食盐生产烧碱3、请从下列物质中选择适当的物质填空:A.盐酸B.氧气C.氢气D.硝酸钾E.碳酸氢钠F.氢氧化钠G.明矾H.肥皂水(1)被称为最理想的“绿色能源”是(填字母,下同);(2)常用于金属除锈的是;(3)常用净水剂是;(4)常用于区分硬水与软水的是;(5)常用于治疗胃酸过多的是;4、小红发现松软的面包和酥脆的饼干内部都有很多小孔。为探究这个问题,她从面点师那里了解到:此类食品制作过程中常加入膨松剂,碳酸氢钠就是常用的膨松剂。她买来一袋碳酸氢钠,进行探究:(1)阅读使用说明:食用时与面粉混合均匀,加水搅拌,成型后烘烤(2)观察到样品为白色粉末状物质(3)取少量样品加入水,发现完全溶解(4)用PH试纸测得溶液的酸碱度为11(5)取少量样品加入稀盐酸,产生大量气泡(6)取样品加入试管中加热,产生可以使澄清石灰水变浑浊的气体请你通过以上实验判断,①形成小孔的气体应该是________你猜测产生这种气体的原因是_____________②将少量面粉加入水中,取上层清液用pH试纸测定,显中性,由此你认为碳酸氢钠能使食品蓬松的主要原因是________________③请你通过以上探究活动,总结碳酸氢钠的物理性质__________________④请你写出你所了解的碳酸氢钠的其他用途_______________________。五、本节课学会了什么?
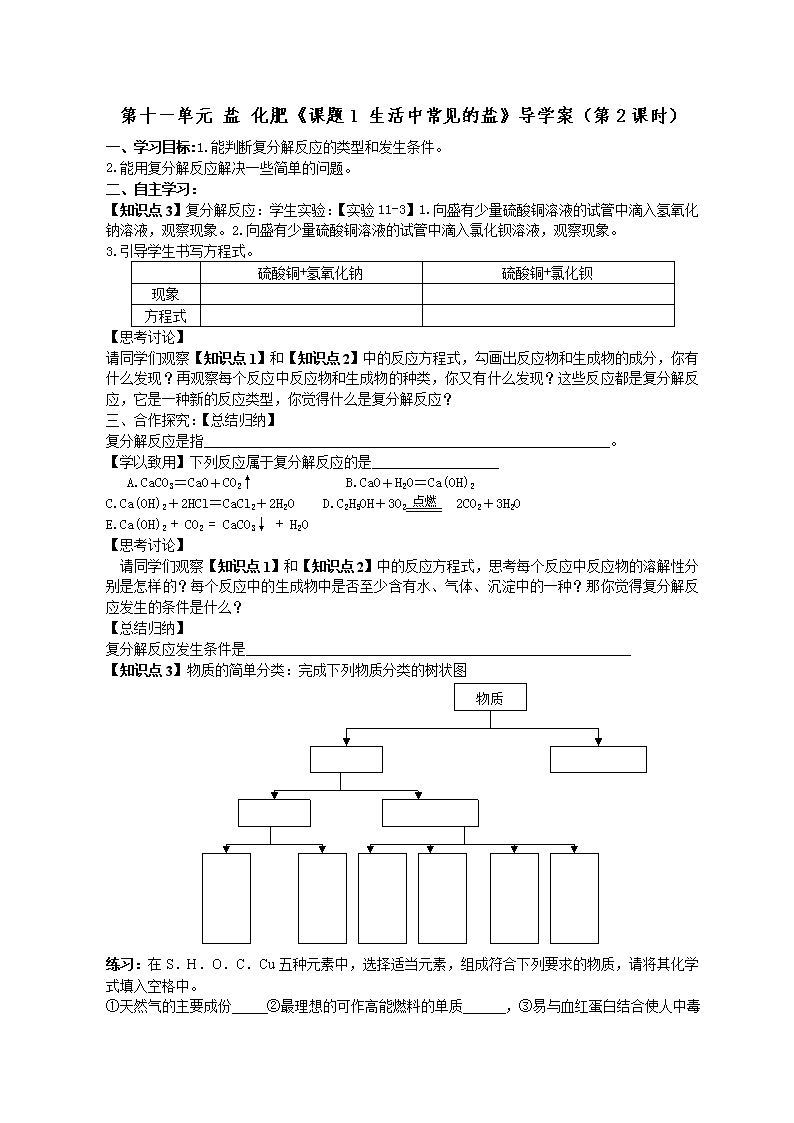
第十一单元盐化肥《课题1生活中常见的盐》导学案(第2课时)一、学习目标:1.能判断复分解反应的类型和发生条件。2.能用复分解反应解决一些简单的问题。二、自主学习:http://www.xkb1.com【知识点3】复分解反应:学生实验:【实验11-3】1.向盛有少量硫酸铜溶液的试管中滴入氢氧化钠溶液,观察现象。2.向盛有少量硫酸铜溶液的试管中滴入氯化钡溶液,观察现象。3.引导学生书写方程式。硫酸铜+氢氧化钠硫酸铜+氯化钡现象方程式【思考讨论】请同学们观察【知识点1】和【知识点2】中的反应方程式,勾画出反应物和生成物的成分,你有什么发现?再观察每个反应中反应物和生成物的种类,你又有什么发现?这些反应都是复分解反应,它是一种新的反应类型,你觉得什么是复分解反应?三、合作探究:【总结归纳】复分解反应是指。【学以致用】下列反应属于复分解反应的是点燃A.CaCO3=CaO+CO2↑B.CaO+H2O=Ca(OH)2C.Ca(OH)2+2HCl=CaCl2+2H2OD.C2H5OH+3O22CO2+3H2OE.Ca(OH)2+CO2=CaCO3↓+H2O【思考讨论】请同学们观察【知识点1】和【知识点2】中的反应方程式,思考每个反应中反应物的溶解性分别是怎样的?每个反应中的生成物中是否至少含有水、气体、沉淀中的一种?那你觉得复分解反应发生的条件是什么?【总结归纳】复分解反应发生条件是【知识点3】物质的简单分类:完成下列物质分类的树状图物质练习:在S.H.O.C.Cu五种元素中,选择适当元素,组成符合下列要求的物质,请将其化学式填入空格中。①天然气的主要成份②最理想的可作高能燃料的单质,③
易与血红蛋白结合使人中毒的氧化物④用于建筑的碱⑤实验室常用的酸⑥一种常见的盐四、巩固达标:1、写出下列反应的化学方程式:(1)氯化钡溶液和碳酸钠溶液(2)碳酸钾溶液和稀盐酸(3)氢氧化钡和稀硝酸上述复分解反应为什么能够发生呢?因为在这些反应物中含有一些“特殊”的阴阳离子。它们能相互结合。如(1)中实际参加反应的离子是钡离子和硫酸根离子,而氯离子和钠离子是旁观者,并没有参加反应,那么(2)中实际参加反应的离子是____________(3)中实际参加反应的离子是_____________。那么请判断下列反应能否发生?(1)氯化钠溶液和硫酸(2)氯化钠溶液和稀硝酸溶液(3)氯化铜溶液和硝酸银溶液(4)碳酸钾溶液和稀硫酸(5)氯化镁溶液和氢氧化钾溶液2、除去下列物质中的杂质所选用的试剂合理的是( )A碳酸钠溶液中的碳酸氢钠(盐酸) B氢氧化钠溶液中的碳酸钠(氯化钙)C二氧化碳中的水蒸气(浓硫酸) D硝酸钾溶液中的硫酸钾(氢氧化钡)3、下列实验能观察到明显现象的是()A.硝酸银溶液滴入氯化钠溶液中B.稀盐酸滴入氯化钠溶液中C.氢氧化钠溶液滴入硝酸钠溶液中D.硫酸钠溶液滴入氯化铜溶液中4、列各组变化中,每一转化在一定条件下均能一步实现的是A.①和②B.②和③C.①和③D.①②③5、填表:(物质类别填写单质、氧化物、酸、碱、盐、有机物等)新课标第一网物质名称干冰苛性钠水银沼气化学式FeSO4H2CO3类别6、有下列四组物质,每组均有一种与其它物质所属类别不同,请在下面的横线上填写这种物质的名称:①食醋、牛奶、加碘盐、水;②冰、干冰、氧化铁、铜绿;③蛋白质、油脂、维生素、煤气;④纯碱、烧碱、食盐、石灰石(主要成分)①__________②__________③__________④__________7、进入21世纪,全球拥有化合物已超过2000万种,其中部分物质由碳、氢、氧、钠中某些元素组成,请用上述元素,按要求各写出一种常见物质的化学式:①用于炼铁的气体且有可燃性的氧化物__________;②“汽水”“雪碧”中含有的一种酸__________;③能溶解蛋白质、油脂、纸张的工业原料的碱__________;④家庭中常用作洗涤剂的纯碱是__________;⑤可造人工雨雾的一种氧化物是__________;⑥“西气东输”工程中将要输送的有机物是__________。五、本节课学会了什么?
第十一单元盐化肥《课题1生活中常见的盐》导学案(第3课时)一、学习目标:1.初步学会粗盐提纯的方法。2.通过实验体验科学探究过程,激发学习兴趣。3.培养学生合作、探究的科学品质和实验操作能力二、自主学习:创设学习情境教师出示一瓶粗盐、一瓶食盐。一瓶粗盐水、一瓶食盐水。请同学们观察粗盐和食盐、粗盐水和食盐水的差异。并提出问题:如何将粗盐初步提纯?如何转化成精盐?【探究活动一】怎样除去粗盐中难溶性杂质?见课本87页的实验活动8。【思考讨论】1.请同学们讨论除掉粗盐中难溶性杂质地方法及操作步骤和注意事项。2.指导同学们制作过滤器。三、合作探究:【总结归纳】1.操作注意事项2.滤液浑浊原因可能是3.过滤速度慢原因可能是二、自主学习:【学生实验】过滤粗食盐水【探究活动二】怎样从滤液中提取氯化钠?【思考讨论】XKb1.Com请同学们阅读教材87页3蒸发,讨论蒸发的注意事项。【总结归纳】蒸发时应用加热,并用搅拌,其目的是,待停止加热。【学生实验】蒸发滤液三、合作探究:【总结归纳】1.粗盐初步提纯的步骤是、、。2.计算粗盐的产率,需要称量、。【思维拓展】粗盐如何转化成精盐?若粗盐中含有氯化钙、氯化镁等可溶性杂质,怎样除去?四、巩固达标:1.提纯含有少量泥沙的粗盐,下列操作顺序正确的是()A.过滤、蒸发、结晶、溶解B.溶解、蒸发、结晶、过滤C.溶解、蒸发、过滤、结晶D.溶解、过滤、蒸发、结晶2.小红同学在家做“粗盐提纯”的实验,对其做法的认识中,错误的是()A.将粗盐放入玻璃杯中加水溶解----粒子在不断运动
B.溶解时用筷子搅拌----加快粗盐溶解C.用自制净水器过滤粗盐----可将粗盐水变为纯净物D.实验时不用一次性塑料杯或纸杯----保护环境从身边小事做起3.若按粗盐提纯的实验步骤对下列各组物质进行分离,可以达到目的的是A.从空气中分离出氧气 B.将混入硝酸钾中的少量氯化钠除去C.从草木灰中提取碳酸钾 D.从氯酸钾制取氧气的残渣中,回收二氧化锰和氯化钾4.一包从海水中获得的粗盐,已经经过初步的提纯。课外活动小组对它的成分进行探究.并将粗盐进一步提纯。探究一:这包粗盐中还有什么杂质?(1)根据海水的成分和初步提纯的实验操作,估计该粗盐可能还含有的杂质是CaCl2或MgCl2。现用实验验证这种推测:取样品并溶解,加入数滴NaOH溶液,目的是检验样品中有没有(填化学式);接着再加入数滴Na2CO3溶液,目的是检验样品中有没有(填化学式)。实验证明:这包粗盐中含有的杂质是CaCl2。探究二:这包粗盐中NaCl的质量分数是多少?按下面步骤继续进行实验,①称取一定质量的样品;②将样品加水溶解,制成粗盐溶液;③向粗盐溶液中加入过量的某种试剂,过滤;④洗涤沉淀后小心烘干,得到纯净固体A;⑤滤液在进行某一操作后,移人蒸发皿蒸发,得到纯净固体B;⑥称量实验中得到的某种固体。(2)在②③⑤的步步骤中,都使用到同一仪器(填名称);它在步骤②和⑤中的操作方法相同,但目的不同,在步骤②中的目的是,在步骤⑤中的目的是。(3)步骤③中加入的试剂是(写化学式),步骤⑤进行的某一操作是,目的是。新-课-标-第-一-网(4)步骤⑥中.你认为不需要称量的固体是固体(填A或B),你不选择称量另一种固体的理由是。5.粗盐中含有较多的杂质,小林按照课本“活动与探究”的要求做粗盐提纯实验。⑴仪器B的名称是,在实验中用得最多的仪器是,它在各步操作中的作用分别是、、。(填序号)。⑵称量食盐应放在仪器A的盘,蒸发时防止液滴飞溅的操作是⑶“活动与探究”中,操作步骤有:①计算产率、②过滤、③溶解、④蒸发,正确的操作顺序为(填序号)。⑷小林通过正确的计算发现,所得实验结果对与该粗盐的实际含量对比,实验测得的结果比实际偏低,请分析可能的原因:。五、本节课学会了什么?
相关文档
- 2019年全国各地中考化学试题-四川2022-04-018页
- 2019年中考化学试题分类:2二氧化碳 2022-04-012页
- 初中化学真题汇编常用的酸和碱2022-04-012页
- 2019-2020学年四川省绵阳市九年级(2022-04-0119页
- 怀化市2020年中考化学试题及答案2022-04-0126页
- 人教版九年级化学(下册)第八单元测试2022-04-0110页
- 2019九年级化学全册 第二单元 常见2022-04-0111页
- 2019年全国各地中考化学试题-浙江2022-04-0149页
- 九年级化学全册1-1化学给我们带来2022-04-0114页
- 2020九年级化学上册 第六单元二氧2022-04-014页