- 336.00 KB
- 2021-11-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
常见的酸和碱
自我小测
1. 物质的性质决定其保存方法。固体氢氧化钠具有以下性质:①白色固体②有腐蚀性
③易吸收水分 ④能与空气中的二氧化碳反应。由此可知,氢氧化钠固体必须密封保 存的
主要原因是( )
A.①② B.②③ C.①③ D.③④
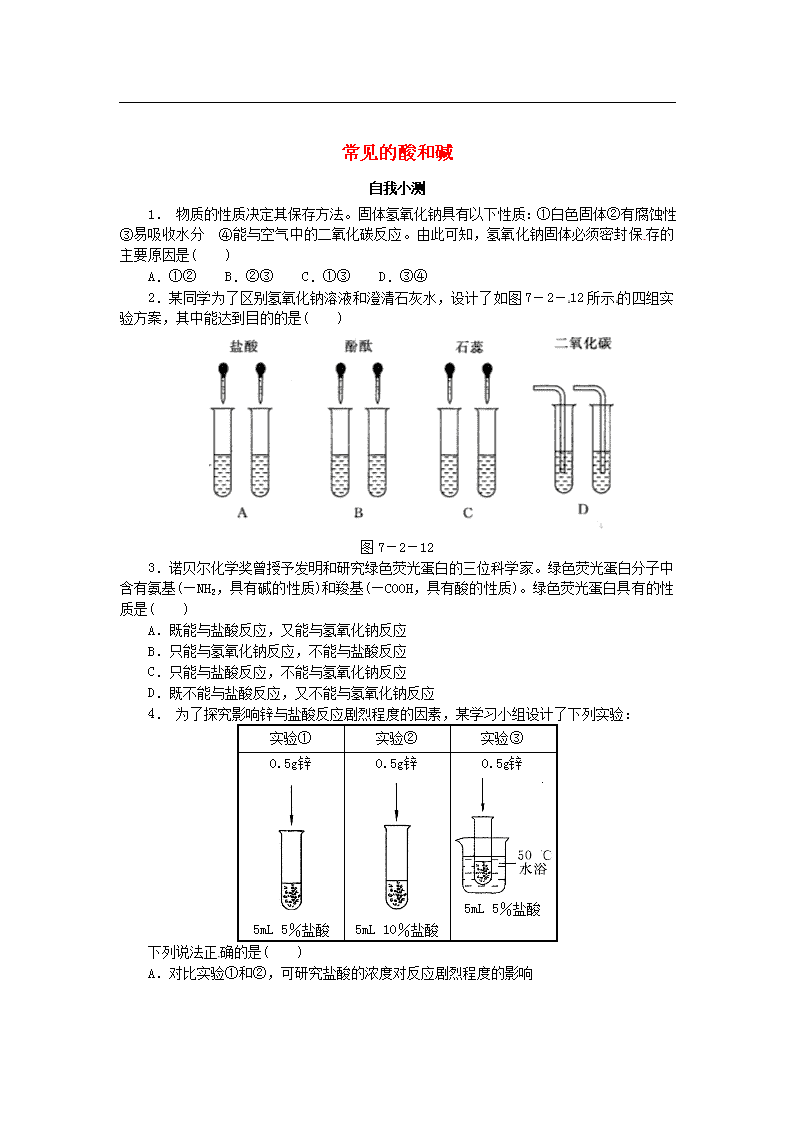
2.某同学为了区别氢氧化钠溶液和澄清石灰水,设计了如图 7-2- 12 所示 的四组实
验方案,其中能达到目的的是( )
图 7-2-12
3.诺贝尔化学奖曾授予发明和研究绿色荧光蛋白的三位科学家。绿色荧光蛋白分子中
含有氨基(—NH2,具有碱的性质)和羧基(—COOH,具有酸的性质)。绿色荧光蛋白具有的性
质是( )
A.既能与盐酸反应,又能与氢氧化钠反应
B.只能与氢氧化钠反应,不能与盐酸反应
C.只能与盐酸反应,不能与氢氧化钠反应
D.既不能与盐酸反应,又不能与氢氧化钠反应
4. 为了探究影响锌与盐酸反应剧烈程度的因素,某学习小组设计了下列实验:
实验① 实验② 实验③
0.5g锌
5mL 5%盐酸
0.5g锌
5mL 10%盐酸
0.5g锌
5mL 5%盐酸
下列说法正确的是( )
A.对比实验①和②,可研究盐酸的浓度对反应剧烈程度的影响
B.对比实验②和③,可研究盐酸的浓度对反应剧烈程度的影响
C.对比实验②和③,可研究温度对反应剧烈程度的影响
D.对比实验①和②,可研究温度对反应剧烈程度的影响
5.下列离子组能在 pH=1 的无色溶液中大量共存的是( )
A. 3NO Fe3+ Na+ OH- B.K+ 2
4SO Na+
3NO
C.Cl- K+ 2
4SO Ba2+ D.Ca2+ Cl- 2
3CO Na+
6.将某金属 M 置于硫酸锌溶液中,无明显现象发生;而将其置于硫酸铜溶液中时,表
面有红色固体物质析出。由此可判断 M、Zn、Cu 的金属活动性由强到弱的顺序为( )
A.M、Zn、Cu B.Zn、M、Cu C.Zn、Cu、M D.Cu、M、Zn
7.某校实验室有一批生锈的铁架台,该校初三(1)班化学兴趣小组设计了一个铁架台翻
新“三步骤”方案:①用砂纸打磨铁架台;②用适量稀酸清洗,水洗,晾干;③防锈处理。
请回答:
(1)①的目的是________________。
(2)②中所用的稀酸是__________,其除锈的化学方程式为_______________________。
(3)写出③的具体做法:__________________________________________________。
8.某工厂欲从只含有 CuSO4 的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业
流程如下:
(1)操作 a、b 的名称分别是__________、__________。
(2)写出流程中有关反应的化学方程式:__________________,__________________。
以上两个反应能够发生的原因是__________________。
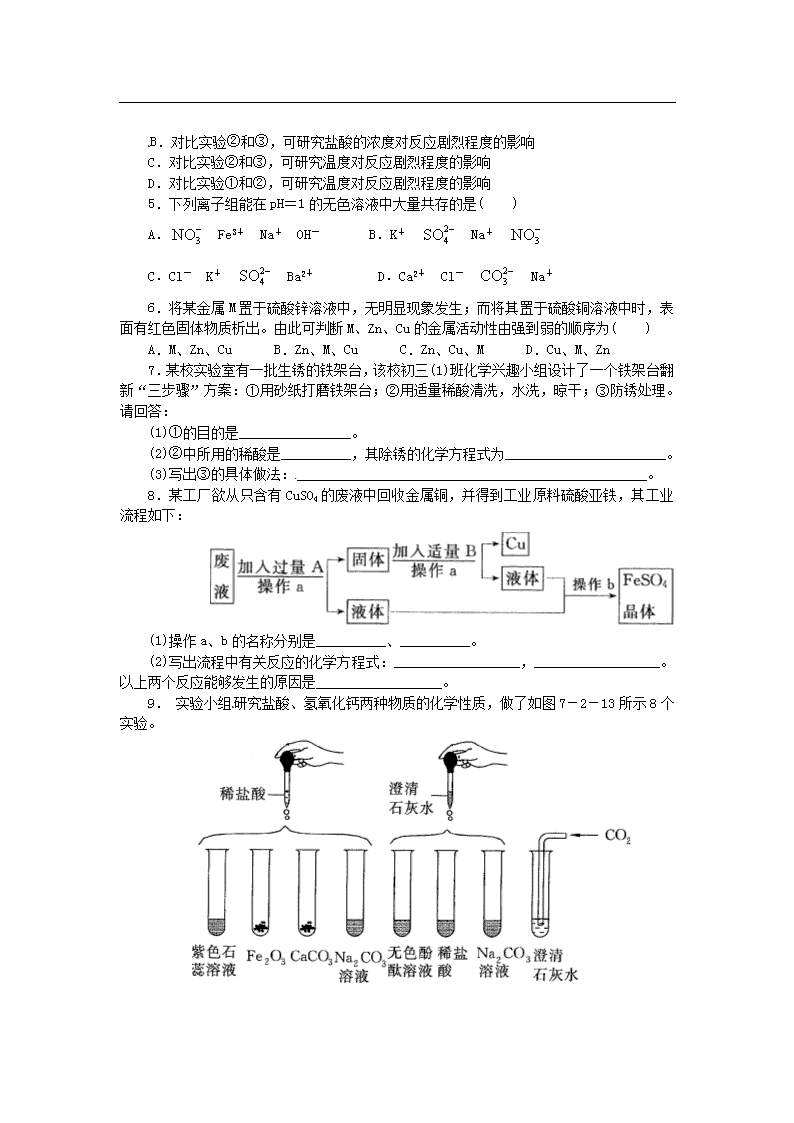
9. 实验小组研究盐酸、氢氧化钙两种物质的化学性质,做了如图 7-2-13 所示 8 个
实验。
图 7-2-13
已知:Na2CO3+CaCl2 CaCO3↓+2NaCl
(1)实验后某试管中为黄色溶液,该试管中发生反应的化学方程式为_______________。
(2)实验后某试管中为红色溶液,向其中加入足量的______________,溶液变为无色。
由此推断,该试管中最初盛有的物质是____________________。
(3)实验后某试管的底部有白色固体,过滤后向滤液中滴加稀盐酸,一段时间后有气泡
出现。由此推断,该试管中最初发生反应的化学方程式为________________。
(4)实验后某试管中只得到无色溶液,向其中加入足量的 Na2CO3 溶液,无明显现象。由
此推断,该试管中最初发生反应的化学方程式为______________,原无色溶液中的溶质是
______________(写出所有可能)。
参考答案
1.D 解析:固体氢氧化钠必须密封保存的原因是氢氧化钠易吸水而潮解以及氢氧化钠
能与空气中的二氧化碳反应。
2.D 解析:CO2 使澄清石灰水变浑浊而与 NaOH 反应无沉淀生成。
3.A 解析:绿色荧光蛋白分子中的氨基具有碱的性质,可与盐酸反应,羧基具有酸的
性质,可与氢氧化钠反应,A 正确。
4.A 解析:①②两个实验除采用盐酸的浓度不同外,其余条件都一样,可比 较盐酸
的浓度对反应剧烈程度的影响,但不能比较温度对反应剧烈程度的影响。②③可变化的因素
有两个:一是盐酸浓度;二是反应所处的温度。无法确定是哪个因素影响了反应的剧烈程度。
5.B 解析:pH=1 的溶液为强酸性溶液,与 H+不能共存的离子有:A 中 OH-,D 中 2
3CO ,
故排除 A 和 D 两选项,在 C 中 2
4SO 和 Ba2+不能共存,易反应生成 BaSO4 沉淀。
6.B 解析:金属 M 不与 ZnSO4 溶液反应,则 M 排在 Zn 的后面;金属 M 与 CuSO4 溶液反
应置换出 Cu,则 M 排在 Cu 的前面,故三种金属的活动性顺序是 Zn>M>Cu。
7 . (1) 除 铁 锈 (2) 稀 盐 酸 ( 或 稀 硫 酸 )Fe2O3 + 6HCl 2FeCl3 + 3H2O[ 或 Fe2O3 +
3H2SO4 Fe2(SO4)3+3H2O] (3)涂 上防锈漆(其他合理答案也可)
解析:(1)用砂纸打磨的目的 是除去铁架台表面的铁锈;(2)除去铁锈可用稀盐酸或稀
硫酸;(3)防锈的措施有涂油、刷漆、镀上一层金属、改变金属的结构等。
8.(1)过滤 蒸发 (2)Fe+CuSO4 FeSO4+Cu Fe+H2SO4 FeSO4+H2↑ 在金属
活动性顺序中,铁位于氢、铜之前
解析:工业流程利用过量铁将 CuSO4 置换得到固体 Cu 和 FeSO4,过滤(a)得到的固体中
含有 Cu 和 Fe(过量),再加入适量稀 H2SO4(B),利用铁与 H2SO4 反应除去固体中过量的铁,从
而得到纯净的 Cu;将滤液蒸发结晶得到 FeSO4 晶体。
9.(1)Fe2O3+6HCl 2FeCl3+3H2O(2)稀盐酸 无色酚酞溶液
(3)Ca(OH)2+Na2CO3 CaCO3↓+2NaOH
(4)Na2CO3+2HCl 2NaCl+H2O+CO2↑ Na2C O3、NaCl 或只有 NaCl
解析:(1)由 Fe3+呈黄色可推知是 Fe2O3 和稀盐酸反应所得溶液呈黄色。(2)从溶液由红
色变无色的过程知,只有含酚酞的碱性溶液遇到能使溶液变中性或酸性的物质才可以。(3)
能与稀盐酸反应产生气体的为碳酸盐或金属,而且在原反应中还要有沉淀生成,必然是氢氧
化钙与碳酸钠的反应。(4)由无色溶液可排除从左边起的 1、2、5、7、8 五支试管。因加足
量的碳酸钠溶液,可根据已知排除产物中含有的氯化钙,所以为碳酸钠和盐酸的反应。当盐
酸恰好反应时溶质为只有 NaCl,当盐酸量不足时,Na2CO3 有剩余,溶质为 Na2CO3、NaCl。